Bmab:ベバシズマブ(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 5mg/kg 点滴 | 1~ | Day1,15 |
CPT-11:イリノテカン塩酸塩水和物(カンプト®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg/m² 点滴 | 1~ | Day1,15 |
S-1:テガフール・ギメラシル・オテラシルカリウム(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/日 経口 分2朝夕食後 | 1~ | Day1夕~15朝 |
前投薬
| イリノテカンの悪心・嘔吐予防目的に制吐剤を投与する。 例:デキサメタゾン注射液3.3mg2A+パロノセトロン点滴静注バッグ0.75mg |
その他
| 1コース28日間。 |
| CPT-11+S-1をIRISと呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- カンプト®など (添付文書¹⁾)
DNAトポイソメラーゼ1阻害薬 イリノテカン
- ティーエスワン® (添付文書²⁾/ 適正使用情報³⁾*)
代謝拮抗薬 テガフール・ギメラシル・オテラシルカリウム
*大鵬薬品工業株式会社の外部サイトへ遷移します
抗VEGFヒト化モノクローナル抗体 ベバシズマブ
*中外製薬の外部サイトへ遷移します
投与スケジュール
TRICOLORE試験⁶⁾のプロトコル
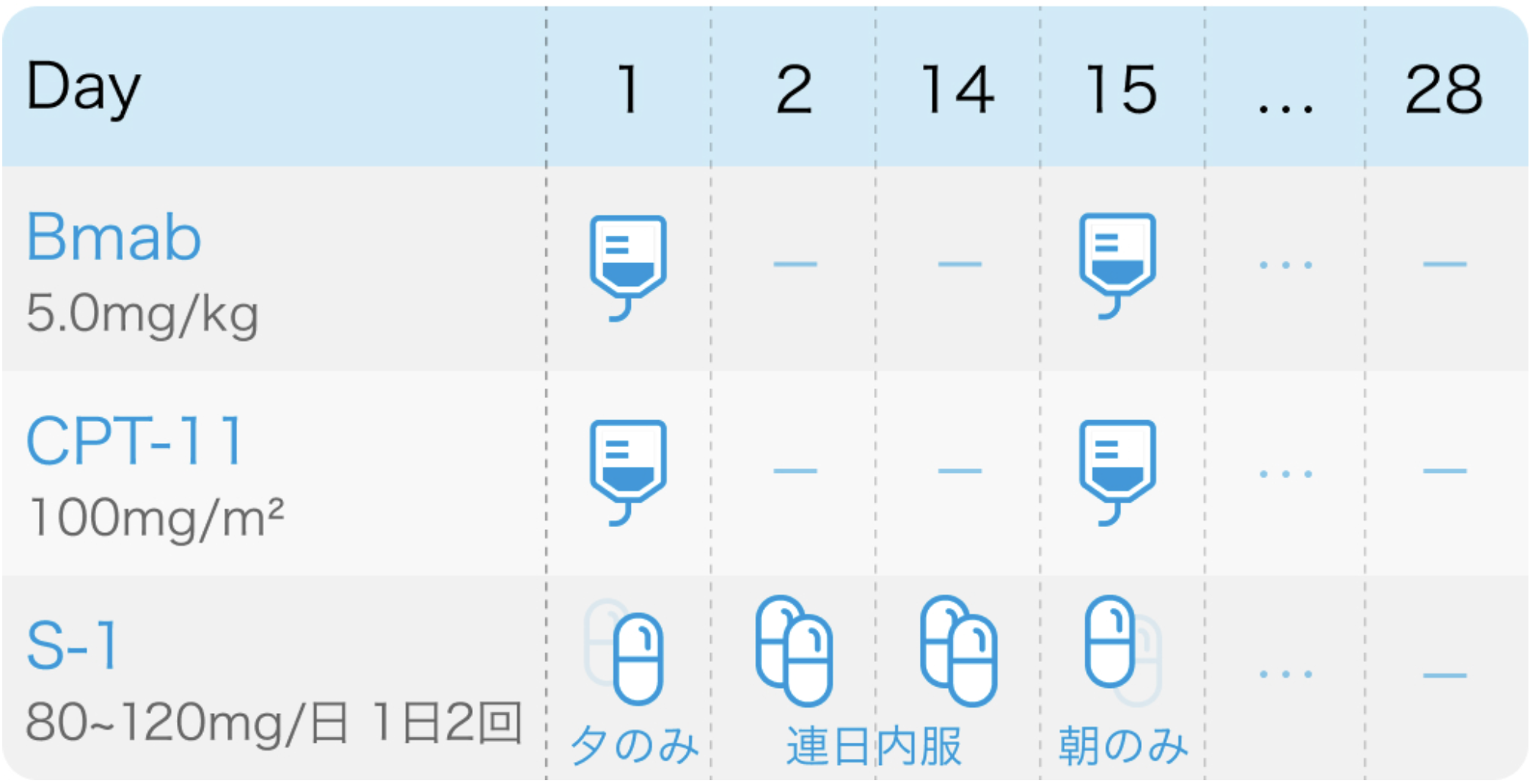
Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
前投薬例
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
イリノテカンの悪心・嘔吐予防目的に制吐剤
例 : デキサメタゾン注射液3.3mg2A+パロノセトロン点滴静注バッグ0.75mg
特徴と注意点
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
ガイドラインの推奨について
大腸癌治療ガイドラインでは、FOLFIRI+Bmabと同様に、 1次治療の標準治療である⁷⁾。
適応と治療ラインについて
オキサリプラチンによる末梢神経障害を回避したい症例、 左側・RAS野生型であっても、 抗EGFR抗体による皮膚障害が許容できない症例、 中心静脈ポート留置拒否例に良い適応である。
用法および用量について
IRIS+Bmabの投与方法は、 イリノテカン150mg/m²、 ベバシズマブ7.5mg/kgをday1に、 S–1 (40–60mg/m²) をday1–14に投与する3週1サイクルで投与する方法と、 イリノテカン100mg/m²、 ベバシズマブ5mg/kgをday1と15に、 S–1 (40–60mg/m²)をday1–14に投与する4週1サイクルで投与する方法がある。
Tricolore試験⁶⁾では4週1サイクル投与が3週1サイクルよりもOSが良好な傾向にあった (それぞれ、 14.3ヵ月、 13.2ヵ月)。 実臨床では、 忍容性や通院の利便性を考慮して両レジメンを使い分けることが多い。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
各プロトコル
投与開始基準
TRICOLORE試験⁶⁾のプロトコル
治療開始前日または当日の検査値及び臨床症状が全ての基準を満たすことが必要
①IRISの投与開始基準
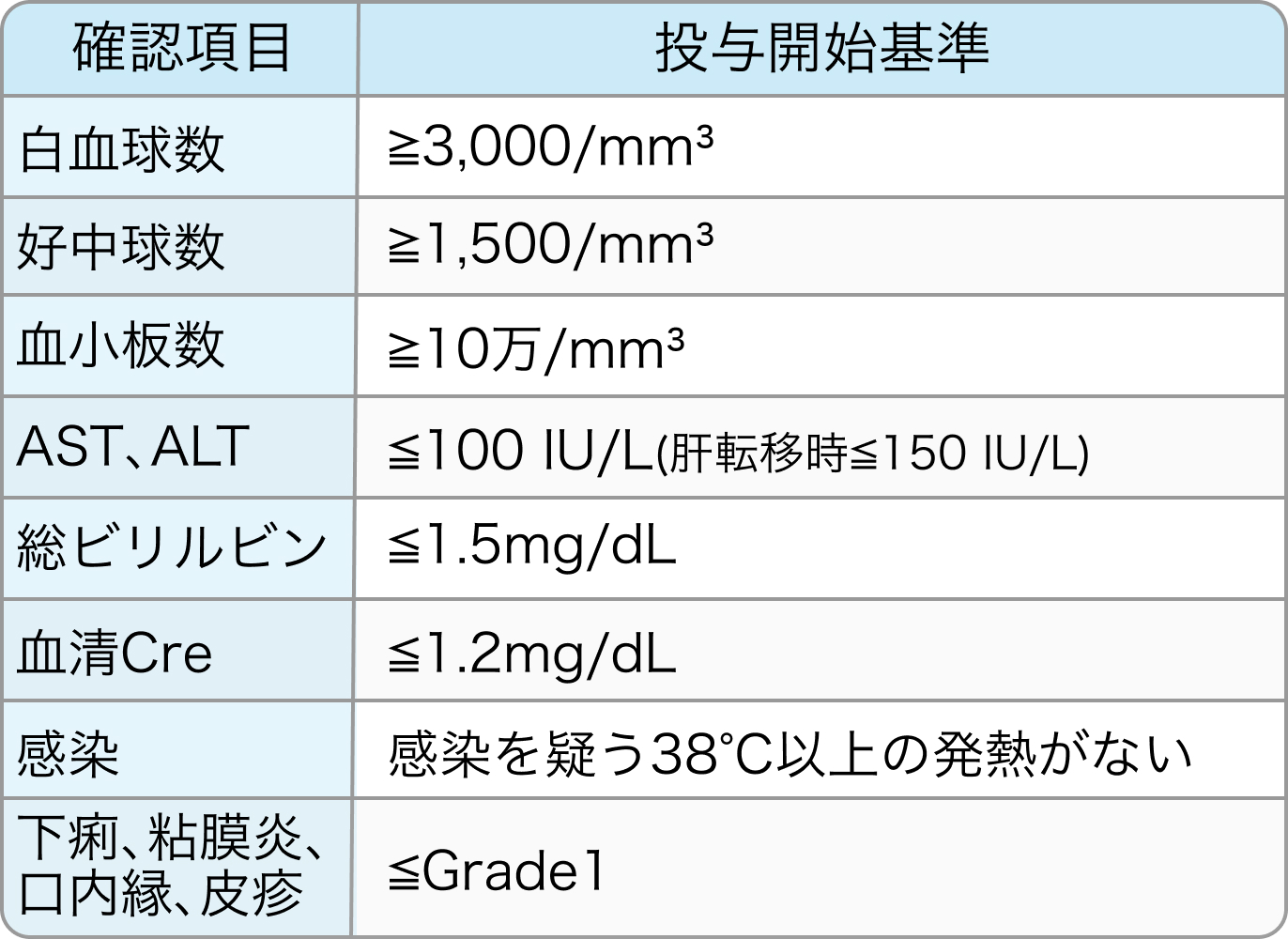
②Bmabの投与開始基準

Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
その他の対応について
①を満たさないが ②を満たす : IRIS + Bmab併用療法の延期 (Bmabのみの投与は行わない)
①は満たすが ②を満たさない : IRISの投与のみ (Bmabは有害事象の軽快によってDay1もしくはDay15に合わせて投与可能)
減量基準
TRICOLORE試験⁶⁾のプロトコル
IRIS+Bmab併用療法の減量基準に一つでも該当した場合、 1段階減量を実施する。 ただし、 減量は2段階までとし、 減量後に再増量は行わない。 Bmabの減量は行わない。
IRISの減量基準
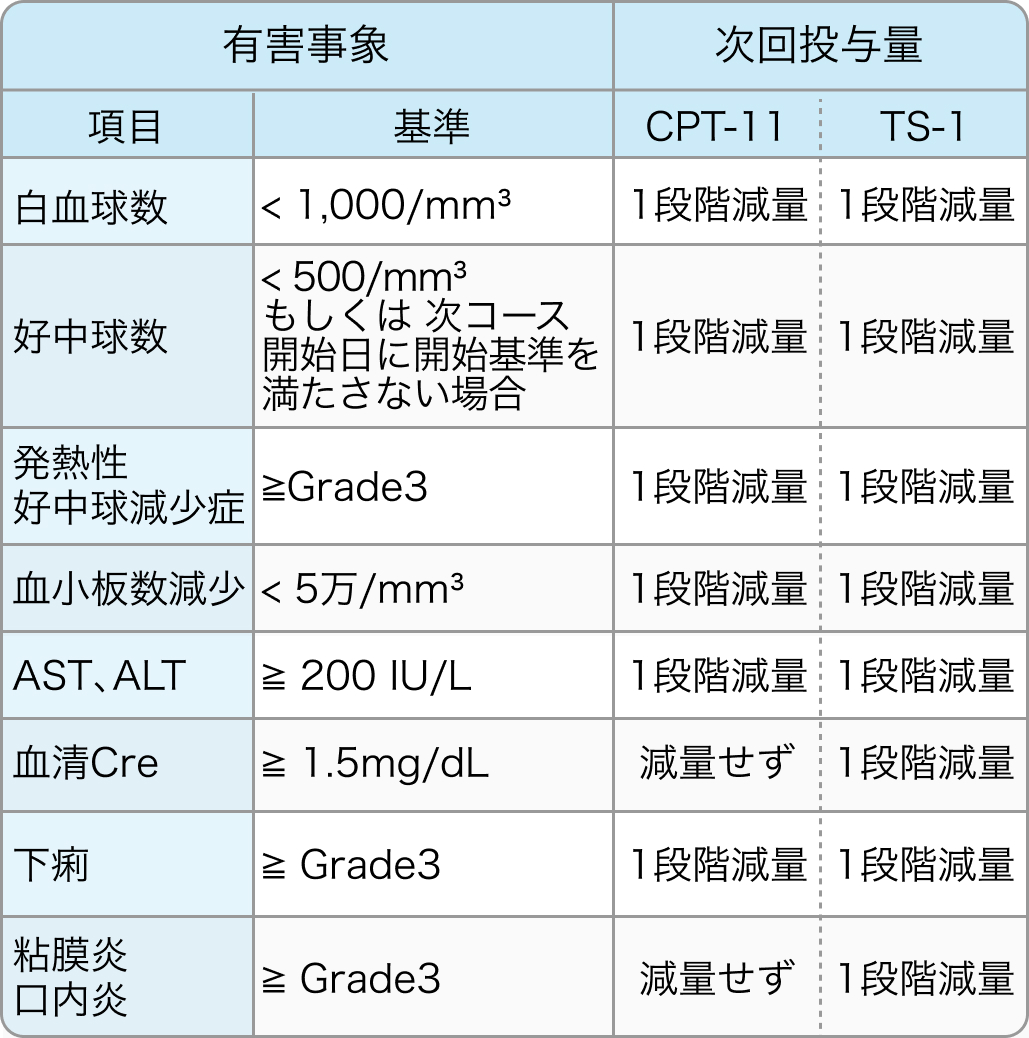
初回基準量と減量レベル
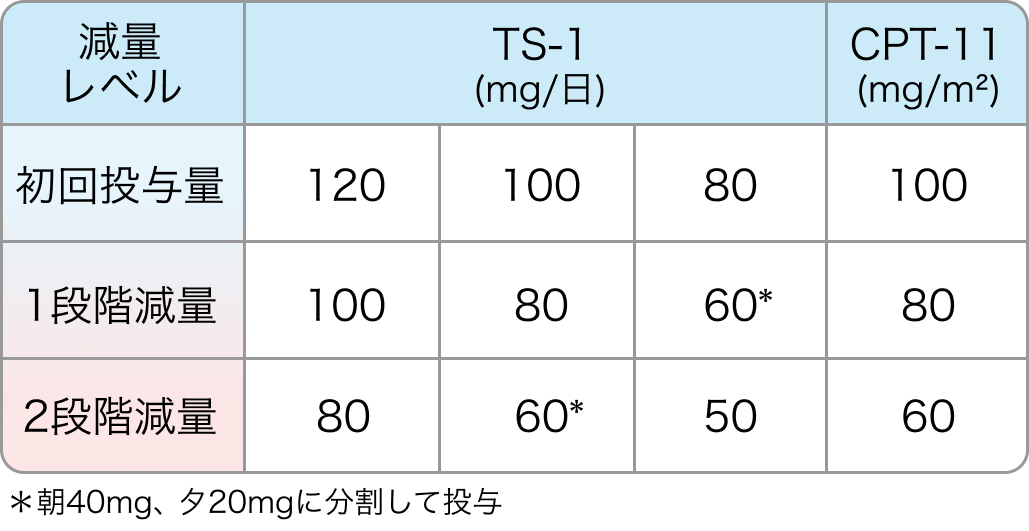
Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
中止基準
TRICOLORE試験⁶⁾のプロトコル
中止基準に一つでも該当した場合、 投与を中止する。 Bmabの減量は行わない。
Bmabの中止基準
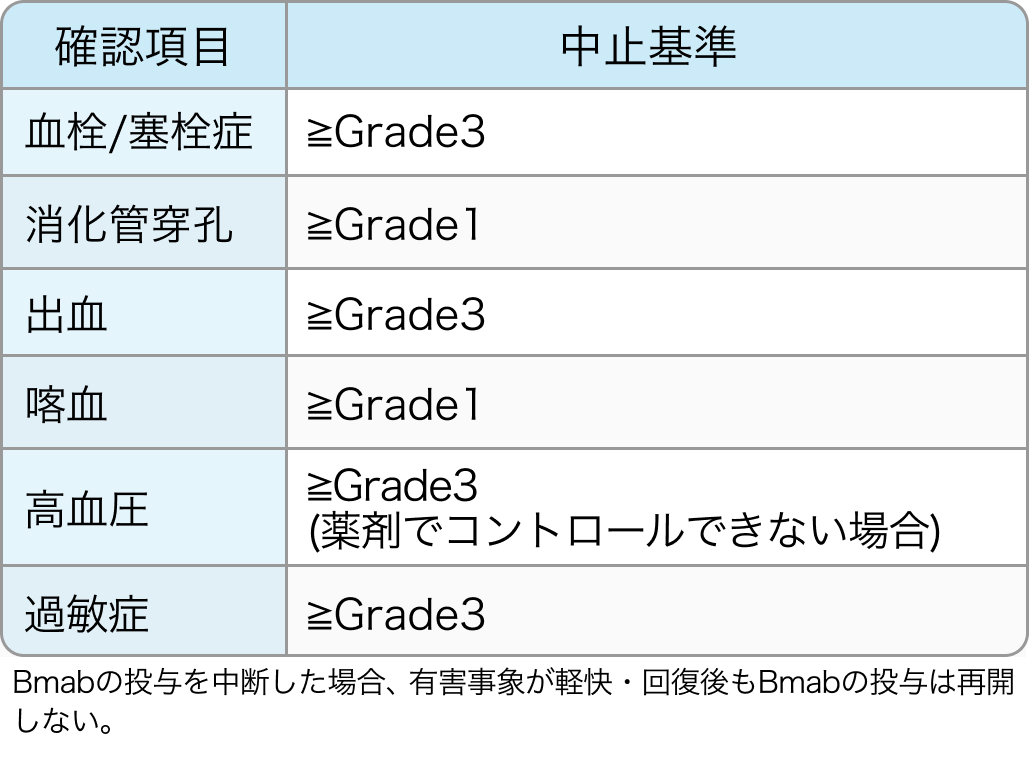
Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
休薬・再開基準
TRICOLORE試験⁶⁾のプロトコル
TS-1の休薬・再開基準
休薬基準に一つでも該当した場合、 休薬する。 有害事象が先述の減量基準に該当する場合、 再開時に減量する。
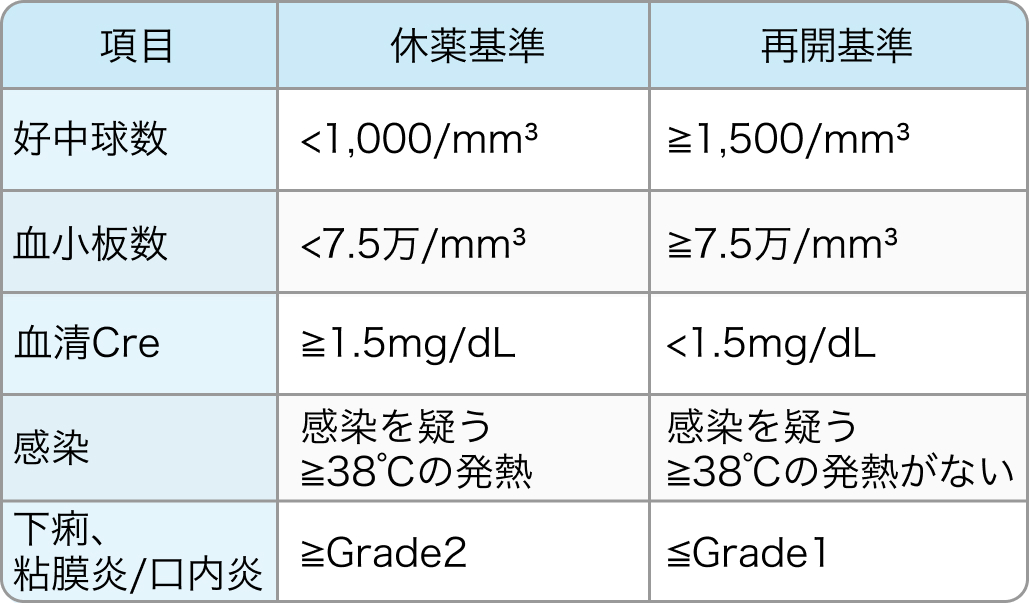
Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
KeyData|臨床試験結果
(1) TRICOLORE試験⁶⁾
転移性直腸結腸癌患者の1次治療において、 IRIS療法(イリノテカン+S-1)+ベバシズマブ(Bmab)のFOLFOX/CAPOX療法+Bmabに対する非劣性が、 無増悪生存期間 (PFS) を指標として証明された。
PFS中央値
- IRIS+Bmab群 : 14.0ヵ月
(95%CI 12.4-15.5ヵ月)
- FOLFOX / CAPOX+Bmab群 : 10.8ヵ月
(95%CI 9.6-11.6ヵ月)
HR 0.84 (95%CI 0.70-1.02)、 p<0.0001
※非劣性マージンは0.25に設定 (HR1.25)
Post-Hoc解析では、 腫瘍占居部位が左側かつRAS野生型においてIRIS+Bmab群のPFSがより良好であったと報告されている。
HR 0.68 (95%CI 0.48-0.96)、 p=0.028
OS中央値
- IRIS+Bmab群 : 34.9ヵ月
(95%CI 31.9-42.4ヵ月)
- FOLFOX / CAPOX+Bmab群 : 33.6ヵ月
(95%CI 29.8-40.1ヵ月)
HR 0.86 (95%CI 0.66-1.13)、 p=0.28
TTF中央値
- IRIS+Bmab群 : 9.6ヵ月
(95%CI 8.2-11.0ヵ月)
- FOLFOX / CAPOX+Bmab群 : 7.7ヵ月
(95%CI 7.1-8.2ヵ月)
HR 0.71 (95%CI 0.59-0.85)、 p=0.0002
奏効率
- IRIS+Bmab群 : 66.4%
- FOLFOX / CAPOX+Bmab群 : 70.6%
p=0.34
疾患特異的QOL尺度
24週の観察期間を通して、 FACT-C TOIに差は認めなかったが、 FACT/GOG-NtxはIRIS+Bmab群で良好であった。
バイオマーカー解析
PFS、 OS共に、 RAS変異およびBRAF変異の有無による群間差は認めなかった。
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 65.7% (8.8%)
- 好中球数減少 62.8% (24.3%)
- 血小板減少症 31.0% (0.8%)
- 貧血 50.6% (5.0%)
- AST上昇 33.5% (2.1%)
- ALT上昇 35.1% (2.1%)
- 食欲不振 59.8% (6.7%)
- 悪心 56.9% (3.3%)
- 嘔吐 24.7% (2.1%)
- 下痢 62.3% (13.4%)
- 倦怠感 59.4% (3.8%)
注意すべき有害事象 (カッコ内はGrade3~4)
- タンパク尿 43.1% (2.5%)
- 脱毛症 59.8% (0%)
- 高血圧 31.8% (8.4%)
Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
(2) FIRIS試験⁸⁾
転移性直腸結腸癌患者の2次治療について、 IRIS (イリノテカン+ S-1) 療法のFOLFIRI (フルオロウラシル+レボホリナート+イリノテカン) に対する非劣性が、 無増悪生存期間 (PFS) を指標として証明された。
PFS中央値中間解析
- IRIS群 : 5.8ヵ月
- FOLFIRI群 : 5.1ヵ月
調整HR 1.077 (95%CI 0.879-1.319)、 p=0.039
※非劣性マージンは0.333に設定 (HR1.333)
長期解析
- IRIS群 : 5.8ヵ月
- FOLFIRI群 : 5.1ヵ月
調整HR 1.058 (95%CI 0.869-1.289)、 p=0.022
L-OHP前治療歴に交互作用が認められ、 L-OHP前治療歴がある患者はIRIS群が優れ、 L-OHP治療歴がない患者はFOLFIRI群が優れる傾向を認めた。
OS中央値 中間解析
- IRIS群 : 19.5ヵ月
- FOLFIRI群 : 18.2ヵ月
調整HR 0.909 (95%CI 0.699-1.181)
長期解析
- IRIS群 : 17.8ヵ月
- FOLFIRI群 : 17.4ヵ月
調整HR 0.900 (95%CI 0.728-1.112)、 p=0.0003
奏効率
- IRIS群 : 18.8%
- FOLFIRI群 : 16.7%
出典
- ヤクルト本社. カンプト®電子添文 (2022年12月改訂第1版) [最終閲覧 : 2024/7/4]
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2023年9月改訂 第3版) [最終閲覧 : 2024/7/4]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド (2023年10月27日 更新) [最終閲覧 : 2024/7/4]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/7/4]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2023年11月改訂) [最終閲覧 : 2024/7/4]
- S-1 and irinotecan plus bevacizumab versus mFOLFOX6 or CapeOX plus bevacizumab as first-line treatment in patients with metastatic colorectal cancer (TRICOLORE): a randomized, open-label, phase III, noninferiority trial. Ann Oncol. 2018 Mar 1;29(3):624-631. PMID: 29293874
- 金原出版株式会社.大腸癌治療ガイドライン医師用2024年版. 大腸癌研究会編.
- Irinotecan plus S-1 (IRIS) versus fluorouracil and folinic acid plus irinotecan (FOLFIRI) as second-line chemotherapy for metastatic colorectal cancer: a randomised phase 2/3 non-inferiority study (FIRIS study). Lancet Oncol. 2010 Sep;11(9):853-60. PMID: 20708966
最終更新日 : 2024年12月6日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
IRIS + Bmab
Bmab:ベバシズマブ(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 5mg/kg 点滴 | 1~ | Day1,15 |
CPT-11:イリノテカン塩酸塩水和物(カンプト®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg/m² 点滴 | 1~ | Day1,15 |
S-1:テガフール・ギメラシル・オテラシルカリウム(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/日 経口 分2朝夕食後 | 1~ | Day1夕~15朝 |
前投薬
| イリノテカンの悪心・嘔吐予防目的に制吐剤を投与する。 例:デキサメタゾン注射液3.3mg2A+パロノセトロン点滴静注バッグ0.75mg |
その他
| 1コース28日間。 |
| CPT-11+S-1をIRISと呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- カンプト®など (添付文書¹⁾)
DNAトポイソメラーゼ1阻害薬 イリノテカン
- ティーエスワン® (添付文書²⁾/ 適正使用情報³⁾*)
代謝拮抗薬 テガフール・ギメラシル・オテラシルカリウム
*大鵬薬品工業株式会社の外部サイトへ遷移します
抗VEGFヒト化モノクローナル抗体 ベバシズマブ
*中外製薬の外部サイトへ遷移します
投与スケジュール
TRICOLORE試験⁶⁾のプロトコル

Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
前投薬例
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
イリノテカンの悪心・嘔吐予防目的に制吐剤
例 : デキサメタゾン注射液3.3mg2A+パロノセトロン点滴静注バッグ0.75mg
特徴と注意点
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
ガイドラインの推奨について
大腸癌治療ガイドラインでは、FOLFIRI+Bmabと同様に、 1次治療の標準治療である⁷⁾。
適応と治療ラインについて
オキサリプラチンによる末梢神経障害を回避したい症例、 左側・RAS野生型であっても、 抗EGFR抗体による皮膚障害が許容できない症例、 中心静脈ポート留置拒否例に良い適応である。
用法および用量について
IRIS+Bmabの投与方法は、 イリノテカン150mg/m²、 ベバシズマブ7.5mg/kgをday1に、 S–1 (40–60mg/m²) をday1–14に投与する3週1サイクルで投与する方法と、 イリノテカン100mg/m²、 ベバシズマブ5mg/kgをday1と15に、 S–1 (40–60mg/m²)をday1–14に投与する4週1サイクルで投与する方法がある。
Tricolore試験⁶⁾では4週1サイクル投与が3週1サイクルよりもOSが良好な傾向にあった (それぞれ、 14.3ヵ月、 13.2ヵ月)。 実臨床では、 忍容性や通院の利便性を考慮して両レジメンを使い分けることが多い。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
各プロトコル
投与開始基準
TRICOLORE試験⁶⁾のプロトコル
治療開始前日または当日の検査値及び臨床症状が全ての基準を満たすことが必要
①IRISの投与開始基準

②Bmabの投与開始基準

Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
その他の対応について
①を満たさないが ②を満たす : IRIS + Bmab併用療法の延期 (Bmabのみの投与は行わない)
①は満たすが ②を満たさない : IRISの投与のみ (Bmabは有害事象の軽快によってDay1もしくはDay15に合わせて投与可能)
減量基準
TRICOLORE試験⁶⁾のプロトコル
IRIS+Bmab併用療法の減量基準に一つでも該当した場合、 1段階減量を実施する。 ただし、 減量は2段階までとし、 減量後に再増量は行わない。 Bmabの減量は行わない。
IRISの減量基準

初回基準量と減量レベル

Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
中止基準
TRICOLORE試験⁶⁾のプロトコル
中止基準に一つでも該当した場合、 投与を中止する。 Bmabの減量は行わない。
Bmabの中止基準

Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
休薬・再開基準
TRICOLORE試験⁶⁾のプロトコル
TS-1の休薬・再開基準
休薬基準に一つでも該当した場合、 休薬する。 有害事象が先述の減量基準に該当する場合、 再開時に減量する。

Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
KeyData|臨床試験結果
(1) TRICOLORE試験⁶⁾
転移性直腸結腸癌患者の1次治療において、 IRIS療法(イリノテカン+S-1)+ベバシズマブ(Bmab)のFOLFOX/CAPOX療法+Bmabに対する非劣性が、 無増悪生存期間 (PFS) を指標として証明された。
PFS中央値
- IRIS+Bmab群 : 14.0ヵ月
(95%CI 12.4-15.5ヵ月)
- FOLFOX / CAPOX+Bmab群 : 10.8ヵ月
(95%CI 9.6-11.6ヵ月)
HR 0.84 (95%CI 0.70-1.02)、 p<0.0001
※非劣性マージンは0.25に設定 (HR1.25)
Post-Hoc解析では、 腫瘍占居部位が左側かつRAS野生型においてIRIS+Bmab群のPFSがより良好であったと報告されている。
HR 0.68 (95%CI 0.48-0.96)、 p=0.028
OS中央値
- IRIS+Bmab群 : 34.9ヵ月
(95%CI 31.9-42.4ヵ月)
- FOLFOX / CAPOX+Bmab群 : 33.6ヵ月
(95%CI 29.8-40.1ヵ月)
HR 0.86 (95%CI 0.66-1.13)、 p=0.28
TTF中央値
- IRIS+Bmab群 : 9.6ヵ月
(95%CI 8.2-11.0ヵ月)
- FOLFOX / CAPOX+Bmab群 : 7.7ヵ月
(95%CI 7.1-8.2ヵ月)
HR 0.71 (95%CI 0.59-0.85)、 p=0.0002
奏効率
- IRIS+Bmab群 : 66.4%
- FOLFOX / CAPOX+Bmab群 : 70.6%
p=0.34
疾患特異的QOL尺度
24週の観察期間を通して、 FACT-C TOIに差は認めなかったが、 FACT/GOG-NtxはIRIS+Bmab群で良好であった。
バイオマーカー解析
PFS、 OS共に、 RAS変異およびBRAF変異の有無による群間差は認めなかった。
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 65.7% (8.8%)
- 好中球数減少 62.8% (24.3%)
- 血小板減少症 31.0% (0.8%)
- 貧血 50.6% (5.0%)
- AST上昇 33.5% (2.1%)
- ALT上昇 35.1% (2.1%)
- 食欲不振 59.8% (6.7%)
- 悪心 56.9% (3.3%)
- 嘔吐 24.7% (2.1%)
- 下痢 62.3% (13.4%)
- 倦怠感 59.4% (3.8%)
注意すべき有害事象 (カッコ内はGrade3~4)
- タンパク尿 43.1% (2.5%)
- 脱毛症 59.8% (0%)
- 高血圧 31.8% (8.4%)
Ann Oncol. 2018 Mar 1;29(3):624-631⁶⁾より引用
(2) FIRIS試験⁸⁾
転移性直腸結腸癌患者の2次治療について、 IRIS (イリノテカン+ S-1) 療法のFOLFIRI (フルオロウラシル+レボホリナート+イリノテカン) に対する非劣性が、 無増悪生存期間 (PFS) を指標として証明された。
PFS中央値中間解析
- IRIS群 : 5.8ヵ月
- FOLFIRI群 : 5.1ヵ月
調整HR 1.077 (95%CI 0.879-1.319)、 p=0.039
※非劣性マージンは0.333に設定 (HR1.333)
長期解析
- IRIS群 : 5.8ヵ月
- FOLFIRI群 : 5.1ヵ月
調整HR 1.058 (95%CI 0.869-1.289)、 p=0.022
L-OHP前治療歴に交互作用が認められ、 L-OHP前治療歴がある患者はIRIS群が優れ、 L-OHP治療歴がない患者はFOLFIRI群が優れる傾向を認めた。
OS中央値 中間解析
- IRIS群 : 19.5ヵ月
- FOLFIRI群 : 18.2ヵ月
調整HR 0.909 (95%CI 0.699-1.181)
長期解析
- IRIS群 : 17.8ヵ月
- FOLFIRI群 : 17.4ヵ月
調整HR 0.900 (95%CI 0.728-1.112)、 p=0.0003
奏効率
- IRIS群 : 18.8%
- FOLFIRI群 : 16.7%
出典
- ヤクルト本社. カンプト®電子添文 (2022年12月改訂第1版) [最終閲覧 : 2024/7/4]
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2023年9月改訂 第3版) [最終閲覧 : 2024/7/4]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド (2023年10月27日 更新) [最終閲覧 : 2024/7/4]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/7/4]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2023年11月改訂) [最終閲覧 : 2024/7/4]
- S-1 and irinotecan plus bevacizumab versus mFOLFOX6 or CapeOX plus bevacizumab as first-line treatment in patients with metastatic colorectal cancer (TRICOLORE): a randomized, open-label, phase III, noninferiority trial. Ann Oncol. 2018 Mar 1;29(3):624-631. PMID: 29293874
- 金原出版株式会社.大腸癌治療ガイドライン医師用2024年版. 大腸癌研究会編.
- Irinotecan plus S-1 (IRIS) versus fluorouracil and folinic acid plus irinotecan (FOLFIRI) as second-line chemotherapy for metastatic colorectal cancer: a randomised phase 2/3 non-inferiority study (FIRIS study). Lancet Oncol. 2010 Sep;11(9):853-60. PMID: 20708966
最終更新日 : 2024年12月6日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
