本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
※2025/2/9時点、 隆起性皮膚線維肉腫に対して本邦適応外薬
薬剤情報
グリベック® (添付文書)
BCR-ABLチロシンキナーゼ阻害薬 イマチニブ
*ノバルティス ファーマの外部サイトへ遷移します
投与スケジュール ※本邦適応外
イマチニブは隆起性皮膚線維肉腫に対して本邦適応外薬となっているため、 ①日本臨床腫瘍学会より提出された未承認薬・適応外薬の要望における用法・用量²⁾³⁾と、 ②米国におけるFDA承認の用法・用量⁵⁾を引用する。
①日本臨床腫瘍学会: 未承認薬・適応外薬要望²⁾³⁾
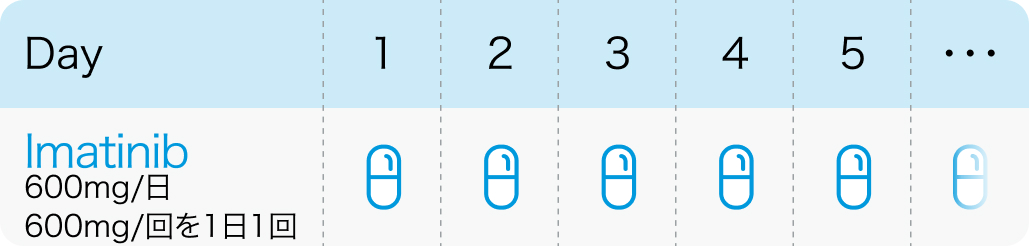
1日1回600mgを食後に経口投与する。 なお、 血液所見、 年齢・症状により適宜増減するが、 1日800mg (400mgを1日2回) まで増量できる。
厚生労働省. 第IV回 医療上の必要性の高い未承認薬・適応外薬の要望募集で提出された要望について(更新日:令和6年2月8日 ) |Ⅳ-75 イマチニブメシル酸塩 要望より引用
②米国FDAでの用法用量より引用⁵⁾
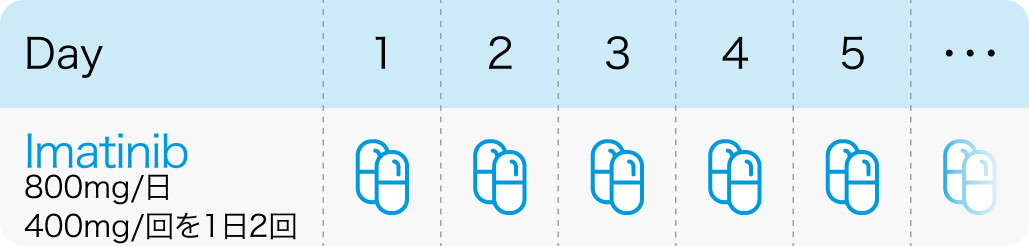
1日800mg (400mgを1日2回) を投与する。
GLEEVEC® (imatinib mesylate) tablets, for oral useInitial U.S. Approval: 2001より引用
エキスパートによるワンポイント
術前化学療法、 切除後再発・転移例に使用
imatinibは、 切除不能な隆起性皮膚線維肉腫 (DFSP) の治療で選択される
日本のガイドラインはないが、 米国のNational Comprehensive Cancer Network (NCCN) ガイドラインにおいて、 imatinibはDFSPに対して唯一推奨されているレジメンである⁴⁾。 NCCNガイドラインでは、 術前化学療法としてimatinibの投与が考慮されるべきと推奨されている。
切除不能なDFSPには、 腫瘍の局在や大きさのために、 腫瘍を取りきることで機能的・整容的に問題が生じる症例も含まれる。 また、 切除後再発・転移例においても、 切除不能な症例にimatinibの投与が考慮されるべきと推奨されている。
他にsunitinib、 sorafenib、 pazopanibなどのチロシンキナーゼ阻害薬や、 methotrexate、 vinblastine、 doxorubicin、 ifosfamideなどの化学療法の有効性が症例報告されているものの、 同ライン薬剤と直接比較した臨床研究はない。
本邦適応外だが、 用法および用量は・・・
米国では成人例に対するimatinibがアメリカ食品医薬品局 (FDA) により承認されており、 用量は800mg/day (400mg 1日2回)である⁵⁾。
なお、 日本臨床腫瘍学会による未承認薬・適応外薬要望²⁾³⁾では、 日本人用量として1日1回600mgを推奨、 1日800mg (400mgを1日2回) まで増量とされている。
CYP3A4誘導薬との併用が避けられない場合、 50%以上の減量が推奨される。 重度の肝障害がある場合は25%の減量が推奨される⁵⁾。
軽度以上の腎障害 (CrCl<59 mL/min)がある場合には≦600mg/日、 中等度の腎障害 (CrCl 20–39 mL/min) がある場合は≦400mg/日で開始する。 投与中に血球減少、 肝障害など、 重篤な副作用が見られた場合には、 検査値が正常化するまで休薬し、 その後減量して再開する⁵⁾。
(800mg/日→600mg/日→400mg/日)
副作用マネジメント
休薬、 減量だけで管理できることが多い
DFSPについて用量の異なる患者群で直接比較した臨床研究はないが、 消化管間質腫瘍 (GIST) においては、 400mg/日投与群と800mg/日 (400mg 1日2回) 投与群を比較し、 治療中止となる症例が800mg/日投与群で多かったものの、 ≧Grade3の副作用が1つ以上見られた患者のうち、 約2/3が減量せず継続することができたとされている⁶⁾。
監修 : 和田 昇悟先生 (国立がんセンター中央 皮膚腫瘍科 専攻医)
関連する臨床試験
①Imatinib Target Exploration Consortium Study B2225. Phase II, open-label study⁷⁾
局所浸潤を伴うDFSP8例に対しimatinib 800mg/dayを投与した。 腫瘍が縮小し、 手術可能と判断された症例は手術を施行した。 奏効率は90%だった。 ≧Grade3の有害事象は25%で認められた。
②Pooled Analysis of Two Phase II Clinical Trials: European Organisation for Research andTreatment of Cancer [EORTC] and Southwest Oncology Group [SWOG]⁸⁾
DFSPの局所浸潤例または転移例DFSP24例に対しimatinib 400-800mg/dayを投与し、 14-6週で手術可能と判断された症例は手術を施行した。 奏効率は38%、 病勢コントロール率は71%だった。
③Multicenter phase II DeCOG trial⁹⁾
局所浸潤を伴うDFSP14例 (初発例または局所再発例)に対しimatinib 600mg/dayを投与し、 12週で手術可能と判断された症例は手術を施行した。 その後3例では術後imatinib投与を継続した。 また、 手術不可と判断された症例には同用量で投与継続した。 奏効率は50%、 病勢コントロール率は86%だった。 ≧Grade3の有害事象は25%で認められた。
いずれの試験でも、 DFSP進行例に対するimatinibの有効性と安全性が確認されている。
出典
- ノバルティス ファーマ. グリベック®電子添文 (2023年1月改訂 (第4版) [最終閲覧 : 2025/2/9]
- 厚生労働省. 第IV回 医療上の必要性の高い未承認薬・適応外薬の要望募集で提出された要望について(更新日:令和6年2月8日 ) |Ⅳ-75 イマチニブメシル酸塩 要望[最終閲覧 : 2025/2/9]
- 厚生労働省. 第IV回 医療上の必要性の高い未承認薬・適応外薬の要望募集で提出された要望について(更新日:令和6年2月8日 ) |Ⅳ-75 イマチニブメシル酸塩 未承認薬・適応外薬の要望に対する企業見解 [最終閲覧 : 2025/2/9]
- National Comprehensive Cancer Network. Dermatofibrosarcoma protuberans (Version1.2024). Dermatofibrosarcoma Protuberans
- https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/021588s047lbl.pdf
- Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. Lancet. 2004;364(9440):1127-34. PMID: 15451219
- Molecular and clinical analysis of locally advanced dermatofibrosarcoma protuberans treated with imatinib: Imatinib Target Exploration Consortium Study B2225. J Clin Oncol. 2005 Feb 1;23(4):866-73. PMID: 15681532
- Imatinib mesylate in advanced dermatofibrosarcoma protuberans: pooled analysis of two phase II clinical trials. J Clin Oncol. 2010 Apr 1;28(10):1772-9. PMID: 20194851
- Neoadjuvant imatinib in advanced primary or locally recurrent dermatofibrosarcoma protuberans: a multicenter phase II DeCOG trial with long-term follow-up. Clin Cancer Res. 2014 Jan 15;20(2):499-510. PMID: 24173542
最終更新日 : 2025年2月9日
執筆医師 : 国立がん研究センター中央病院皮膚腫瘍科 和田昇悟先生
監修薬剤師 : 国立がん研究センター中央病院 腫瘍内科 宇田川 涼子先生
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
Imatinib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
※2025/2/9時点、 隆起性皮膚線維肉腫に対して本邦適応外薬
薬剤情報
グリベック® (添付文書)
BCR-ABLチロシンキナーゼ阻害薬 イマチニブ
*ノバルティス ファーマの外部サイトへ遷移します
投与スケジュール ※本邦適応外
イマチニブは隆起性皮膚線維肉腫に対して本邦適応外薬となっているため、 ①日本臨床腫瘍学会より提出された未承認薬・適応外薬の要望における用法・用量²⁾³⁾と、 ②米国におけるFDA承認の用法・用量⁵⁾を引用する。
①日本臨床腫瘍学会: 未承認薬・適応外薬要望²⁾³⁾

1日1回600mgを食後に経口投与する。 なお、 血液所見、 年齢・症状により適宜増減するが、 1日800mg (400mgを1日2回) まで増量できる。
厚生労働省. 第IV回 医療上の必要性の高い未承認薬・適応外薬の要望募集で提出された要望について(更新日:令和6年2月8日 ) |Ⅳ-75 イマチニブメシル酸塩 要望より引用
②米国FDAでの用法用量より引用⁵⁾

1日800mg (400mgを1日2回) を投与する。
GLEEVEC® (imatinib mesylate) tablets, for oral useInitial U.S. Approval: 2001より引用
エキスパートによるワンポイント
術前化学療法、 切除後再発・転移例に使用
imatinibは、 切除不能な隆起性皮膚線維肉腫 (DFSP) の治療で選択される
日本のガイドラインはないが、 米国のNational Comprehensive Cancer Network (NCCN) ガイドラインにおいて、 imatinibはDFSPに対して唯一推奨されているレジメンである⁴⁾。 NCCNガイドラインでは、 術前化学療法としてimatinibの投与が考慮されるべきと推奨されている。
切除不能なDFSPには、 腫瘍の局在や大きさのために、 腫瘍を取りきることで機能的・整容的に問題が生じる症例も含まれる。 また、 切除後再発・転移例においても、 切除不能な症例にimatinibの投与が考慮されるべきと推奨されている。
他にsunitinib、 sorafenib、 pazopanibなどのチロシンキナーゼ阻害薬や、 methotrexate、 vinblastine、 doxorubicin、 ifosfamideなどの化学療法の有効性が症例報告されているものの、 同ライン薬剤と直接比較した臨床研究はない。
本邦適応外だが、 用法および用量は・・・
米国では成人例に対するimatinibがアメリカ食品医薬品局 (FDA) により承認されており、 用量は800mg/day (400mg 1日2回)である⁵⁾。
なお、 日本臨床腫瘍学会による未承認薬・適応外薬要望²⁾³⁾では、 日本人用量として1日1回600mgを推奨、 1日800mg (400mgを1日2回) まで増量とされている。
CYP3A4誘導薬との併用が避けられない場合、 50%以上の減量が推奨される。 重度の肝障害がある場合は25%の減量が推奨される⁵⁾。
軽度以上の腎障害 (CrCl<59 mL/min)がある場合には≦600mg/日、 中等度の腎障害 (CrCl 20–39 mL/min) がある場合は≦400mg/日で開始する。 投与中に血球減少、 肝障害など、 重篤な副作用が見られた場合には、 検査値が正常化するまで休薬し、 その後減量して再開する⁵⁾。
(800mg/日→600mg/日→400mg/日)
副作用マネジメント
休薬、 減量だけで管理できることが多い
DFSPについて用量の異なる患者群で直接比較した臨床研究はないが、 消化管間質腫瘍 (GIST) においては、 400mg/日投与群と800mg/日 (400mg 1日2回) 投与群を比較し、 治療中止となる症例が800mg/日投与群で多かったものの、 ≧Grade3の副作用が1つ以上見られた患者のうち、 約2/3が減量せず継続することができたとされている⁶⁾。
監修 : 和田 昇悟先生 (国立がんセンター中央 皮膚腫瘍科 専攻医)
関連する臨床試験
①Imatinib Target Exploration Consortium Study B2225. Phase II, open-label study⁷⁾
局所浸潤を伴うDFSP8例に対しimatinib 800mg/dayを投与した。 腫瘍が縮小し、 手術可能と判断された症例は手術を施行した。 奏効率は90%だった。 ≧Grade3の有害事象は25%で認められた。
②Pooled Analysis of Two Phase II Clinical Trials: European Organisation for Research andTreatment of Cancer [EORTC] and Southwest Oncology Group [SWOG]⁸⁾
DFSPの局所浸潤例または転移例DFSP24例に対しimatinib 400-800mg/dayを投与し、 14-6週で手術可能と判断された症例は手術を施行した。 奏効率は38%、 病勢コントロール率は71%だった。
③Multicenter phase II DeCOG trial⁹⁾
局所浸潤を伴うDFSP14例 (初発例または局所再発例)に対しimatinib 600mg/dayを投与し、 12週で手術可能と判断された症例は手術を施行した。 その後3例では術後imatinib投与を継続した。 また、 手術不可と判断された症例には同用量で投与継続した。 奏効率は50%、 病勢コントロール率は86%だった。 ≧Grade3の有害事象は25%で認められた。
いずれの試験でも、 DFSP進行例に対するimatinibの有効性と安全性が確認されている。
出典
- ノバルティス ファーマ. グリベック®電子添文 (2023年1月改訂 (第4版) [最終閲覧 : 2025/2/9]
- 厚生労働省. 第IV回 医療上の必要性の高い未承認薬・適応外薬の要望募集で提出された要望について(更新日:令和6年2月8日 ) |Ⅳ-75 イマチニブメシル酸塩 要望[最終閲覧 : 2025/2/9]
- 厚生労働省. 第IV回 医療上の必要性の高い未承認薬・適応外薬の要望募集で提出された要望について(更新日:令和6年2月8日 ) |Ⅳ-75 イマチニブメシル酸塩 未承認薬・適応外薬の要望に対する企業見解 [最終閲覧 : 2025/2/9]
- National Comprehensive Cancer Network. Dermatofibrosarcoma protuberans (Version1.2024). Dermatofibrosarcoma Protuberans
- https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/021588s047lbl.pdf
- Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. Lancet. 2004;364(9440):1127-34. PMID: 15451219
- Molecular and clinical analysis of locally advanced dermatofibrosarcoma protuberans treated with imatinib: Imatinib Target Exploration Consortium Study B2225. J Clin Oncol. 2005 Feb 1;23(4):866-73. PMID: 15681532
- Imatinib mesylate in advanced dermatofibrosarcoma protuberans: pooled analysis of two phase II clinical trials. J Clin Oncol. 2010 Apr 1;28(10):1772-9. PMID: 20194851
- Neoadjuvant imatinib in advanced primary or locally recurrent dermatofibrosarcoma protuberans: a multicenter phase II DeCOG trial with long-term follow-up. Clin Cancer Res. 2014 Jan 15;20(2):499-510. PMID: 24173542
最終更新日 : 2025年2月9日
執筆医師 : 国立がん研究センター中央病院皮膚腫瘍科 和田昇悟先生
監修薬剤師 : 国立がん研究センター中央病院 腫瘍内科 宇田川 涼子先生
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。