本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- ポートラーザ® (添付文書¹⁾ / 適正使用情報²⁾*)
*日本化薬株式会社の外部サイトへ遷移します
- シスプラチン® (添付文書)
- ゲムシタビン® (添付文書)
投与スケジュール
【1コース】 21日間
【催吐性】 高度
【FN発症】低リスク*
*SQUIRE試験³⁾のFN発生率1.1%を基に編集部が分類
1~4コース : 化学療法併用期間

5コース以降 : 継続投与期間 (PDまで継続)

ネシツムマブ : 800mgを60分かけて、 1日目と8日目に点滴静注。 1~4コースは化学療法と併用し、 5コース以降は病勢進行または中止基準に達するまで単独で継続投与
ゲムシタビン (GEM) : 1~4コースの間に、 ネシツムマブ投与後に1250mg/m²を30分かけて、 1日目と8日目に点滴静注
シスプラチン (CDDP) : 1~4コースの間に、 ゲムシタビン投与後30分以上あけて、 75mg/m²を120分かけて1日目に点滴静注
Key Data|臨床試験結果
📊 SQUIRE試験
Lancet Oncol. 2015;16(7):763-74.
未治療のⅣ期非小細胞肺癌 (扁平上皮癌) 患者1,093例を対象とした、 多施設共同・非盲検・第III相無作為化比較試験。 ネシツムマブ+CDDP+GEM群と、 CDDP+GEM群に1対1の比率で割り付け、 主要評価項目はOSが設定された。
【有効性】ネシツムマブ併用群 (vs 非併用群)
- OS中央値 : 11.5ヵ月 (vs 9.9ヵ月)
- ハザード比0.84 (95%CI 0.74-0.96、 p=0.01)
- 1年OS : 48% (vs 43%)
- 2年OS : 20% (vs 17%)
- PFS中央値 : 5.7ヵ月 (vs 5.5ヵ月)
- 奏効率 : 31% (vs 29%)
- 病勢制御率 : 82% (vs 77%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
ポートラーザ®適正使用ガイド²⁾より抜粋
- 好中球減少症 42.0% (23.4%)
- 貧血 35.1% (8.7%)
- 血小板減少症 19.3% (9.7%)
- 悪心 48.3% (2.6%)
- 嘔吐 26.8% (2.6%)
- 下痢 15.6% (1.7%)
- 口内炎 10.0% (0.9%)
- 疲労 17.3% (2.4%)
- 動脈血栓塞栓関連事象 5.4% (3.9%)
- 静脈血栓塞栓関連事象 9.1% (5.0%)
- Infusion reaction 1.5% (0.4%)
- 血中クレアチニン増加 7.6% (0%)
- 低マグネシウム血症 29.6% (8.7%)
- 間質性肺疾患 0.2% (0.2%)
- 発疹 43.7% (1.3%)
- ざ瘡様皮膚炎 15.1% (1.3%)
- 皮膚乾燥 6.5% (0%)
- そう痒症 7.1% (0.2%)
- 皮膚亀裂 5.0% (0.4%)
- 爪囲炎 6.7% (0.4%)
- 手掌・足底発赤知覚不全症候群 1.7% (0.2%)
- 出血 17.5% (2.0%)
- 喀血 9.9% (1.3%)
- 鼻出血 7.4% (0%)
適格基準
SQUIRE試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0-2
- 好中球≧1,500/mm³
- Hgb≧9.5g/dL
- 血小板数≧10万/mm³
- 腎機能 : CrCl ≧50mL/min、 または血清クレアチニン≦1.2×ULN
- 肝機能 : T-Bil≦1.5×ULN、 AST/ALT≦2.5×ULN
用量レベル
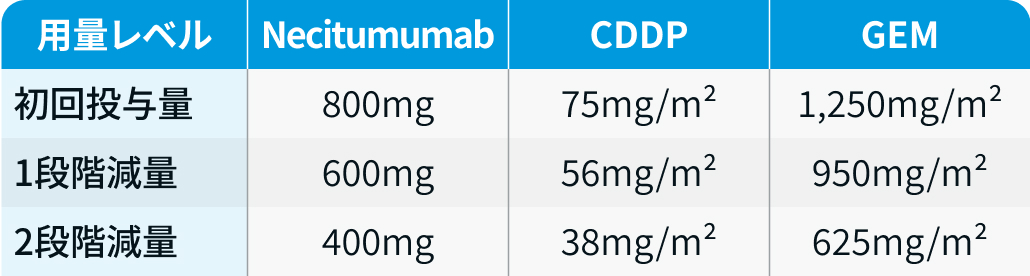
SQUIRE試験³⁾のプロトコルを基に編集部作成
Grade 3–4の有害事象が生じた場合、 ネシツムマブは最大6週まで休薬し、 600mg (必要に応じて400mg) で再開可。 3回目の減量が必要な場合は中止とする。 再増量は3週以上経過後に医師判断で可。
一方、 CDDP/GEMは減量後の増量は行わず、 3回目の減量が必要な場合は投与中止。
腎障害患者に対する用量調整
CDDP⁴⁾ :
- 重篤な腎障害例への投与は禁忌
- CrCl 46~60mL/minでは75%、 31~45mL/minでは50%に減量し、 CrCl≦30mL/minでは投与を推奨しない
- 別の報告 : CrCl 30~49mL/minでは75%、 10~29mL/minでは投与が必要な場合に75%、 CrCl<10mL/minでは投与が必要な場合に50%に減量
GEM :
- 尿中未変化体量排泄率は10%未満であり、 減量は不要と考えられる。
ジェムザール®インタビューフォームを基に編集部が判断
有害事象発現時の減量・休薬・中止基準
ネシツムマブ :
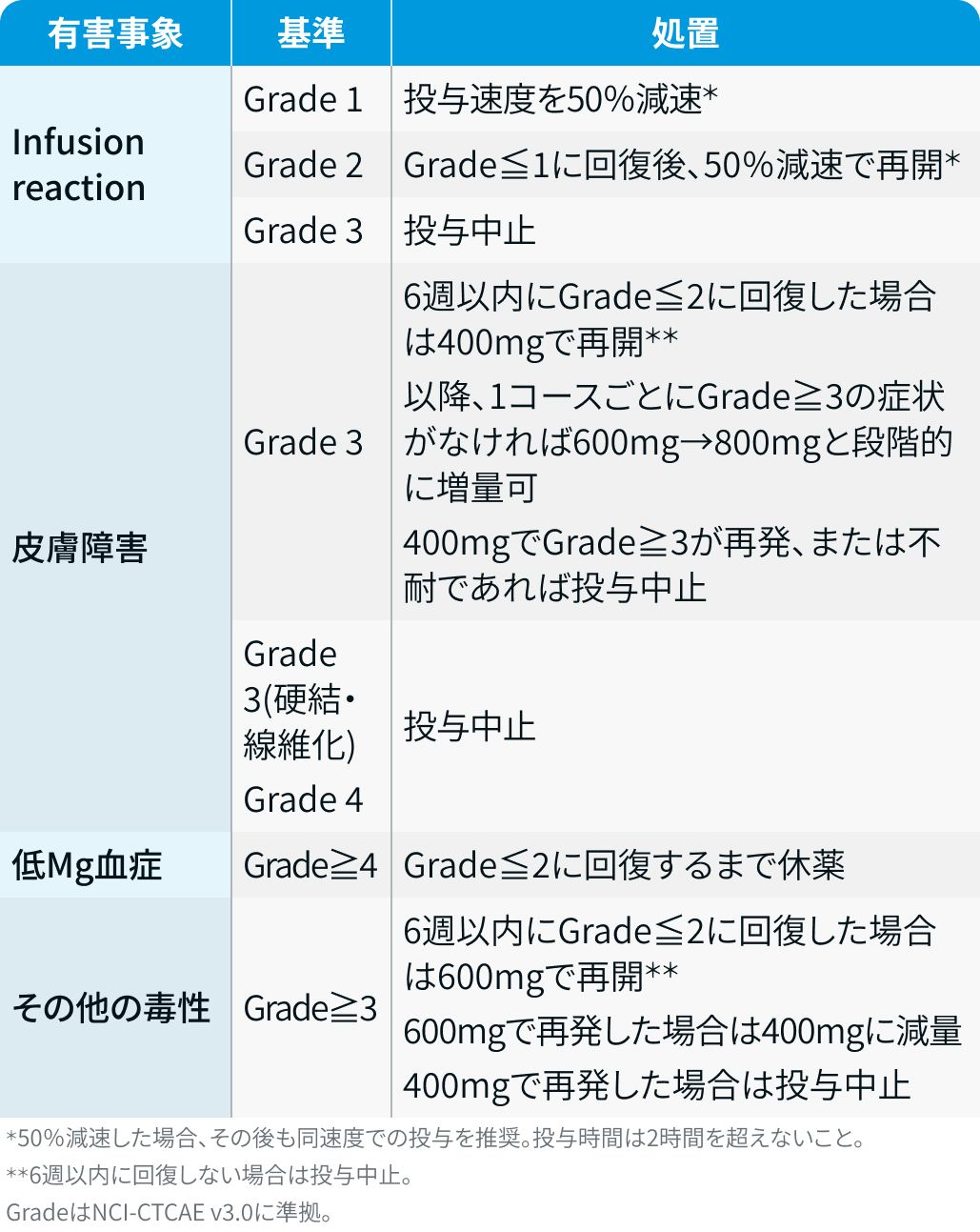
ポートラーザ®電子添文¹⁾を基に編集部作成
CDDP・GEM :
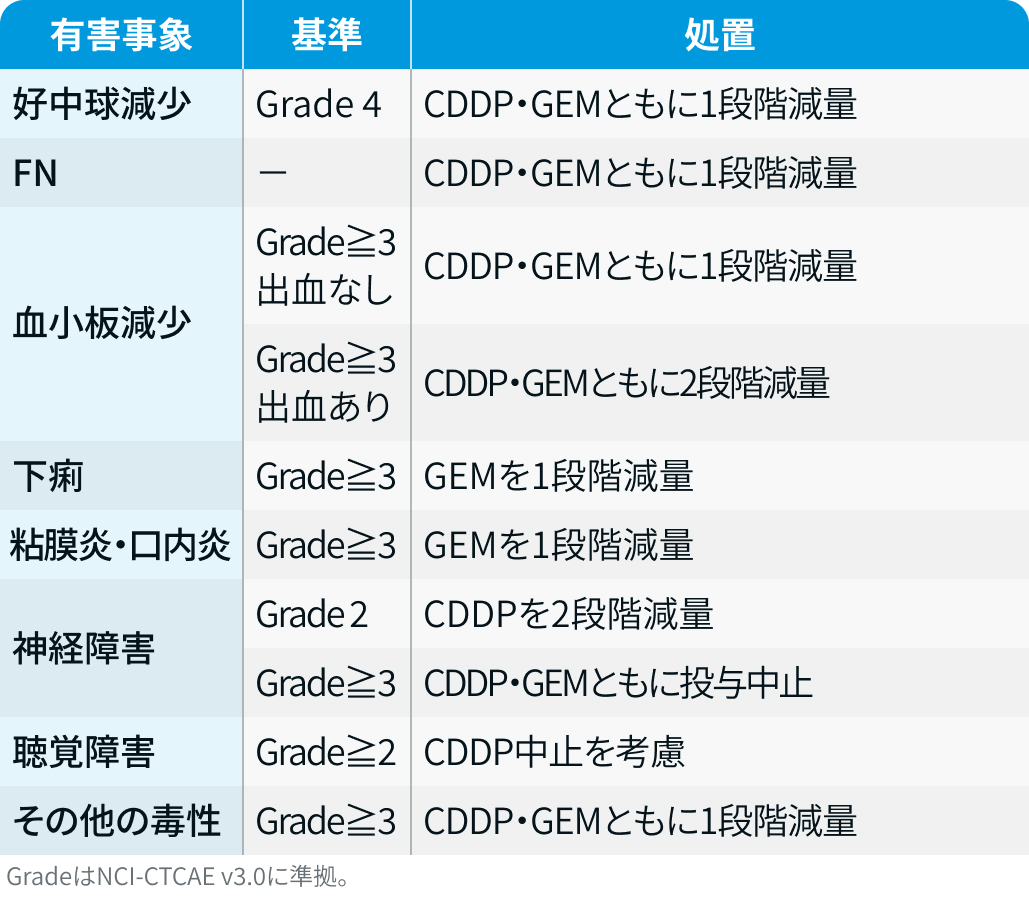
SQUIRE試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
作用機序の特徴
ネシツムマブは、 ヒト上皮成長因子受容体 (EGFR) に対する遺伝子組換え型ヒトIgG1モノクローナル抗体であり、 EGFRに結合してシグナル伝達を阻害し、 腫瘍増殖を抑制すると考えられており、 EGFRの発現有無にかかわらず使用可能である。
肺癌診療GLにおける本レジメンの推奨
ネシツムマブは、 CDDP+GEM以外の化学療法との併用における有効性・安全性は確立していない。 肺癌診療ガイドライン2024年版⁵⁾における本レジメンの位置づけは以下のとおりである。

レジメン適用時の注意事項
CDDPによる腎障害予防 : 十分な水分負荷と利尿管理を行い、 水分負荷に対する心機能の耐容性は事前に確認する。
低Mg血症 : 倦怠感・筋痙縮・振戦などを伴う低マグネシウム血症があらわれることがあるため、 投与前・投与中・投与後は血清中電解質 (マグネシウム・カルシウム・カリウム・リン) をモニタリングする。 異常が認められた場合は休薬等の対応を行い、 必要に応じてマグネシウム補充を実施する。
動脈血栓塞栓症・静脈血栓塞栓症 : 脳血管障害や虚血性心疾患などの動脈血栓塞栓症、 肺塞栓症・深部静脈血栓症などの静脈血栓塞栓症があらわれることがあるため、 異常が認められた場合はネシツムマブを中止し、 適切に対応する。 血栓塞栓症または既往のある患者では、 再発や悪化のリスクがあるため注意が必要。
RMP【重要な特定されたリスク】
ポートラーザ®医薬品リスク管理計画書 (RMP)
- 動脈血栓塞栓症
- 静脈血栓塞栓症
- Infusion Reaction
- 低マグネシウム血症
- 間質性肺疾患
- 重度の皮膚障害
出典
- 日本化薬株式会社. ポートラーザ点滴静注液800mg 電子添文 2023年6月改訂 第2版.
- 日本化薬株式会社. ポートラーザ点滴静注液800mg 適正使用ガイド 2024年6月作成
- Lancet Oncol. 2015;16(7):763-74.
- 日本腎臓学会、 日本癌治療学会、 日本臨床腫瘍学会、 日本腎臓病薬物療法学会編 : がん薬物療法時の腎障害診療ガイドライン2022. ライフサイエンス出版.
- 日本肺癌学会編 : 肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む. 2024年版 ver.1.1. 金原出版
最終更新日 : 2025年7月15日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修 : HOKUTO編集部監修医師
Necitumumab+CDDP+GEM
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- ポートラーザ® (添付文書¹⁾ / 適正使用情報²⁾*)
*日本化薬株式会社の外部サイトへ遷移します
- シスプラチン® (添付文書)
- ゲムシタビン® (添付文書)
投与スケジュール
【1コース】 21日間
【催吐性】 高度
【FN発症】低リスク*
*SQUIRE試験³⁾のFN発生率1.1%を基に編集部が分類
1~4コース : 化学療法併用期間

5コース以降 : 継続投与期間 (PDまで継続)

ネシツムマブ : 800mgを60分かけて、 1日目と8日目に点滴静注。 1~4コースは化学療法と併用し、 5コース以降は病勢進行または中止基準に達するまで単独で継続投与
ゲムシタビン (GEM) : 1~4コースの間に、 ネシツムマブ投与後に1250mg/m²を30分かけて、 1日目と8日目に点滴静注
シスプラチン (CDDP) : 1~4コースの間に、 ゲムシタビン投与後30分以上あけて、 75mg/m²を120分かけて1日目に点滴静注
Key Data|臨床試験結果
📊 SQUIRE試験
Lancet Oncol. 2015;16(7):763-74.
未治療のⅣ期非小細胞肺癌 (扁平上皮癌) 患者1,093例を対象とした、 多施設共同・非盲検・第III相無作為化比較試験。 ネシツムマブ+CDDP+GEM群と、 CDDP+GEM群に1対1の比率で割り付け、 主要評価項目はOSが設定された。
【有効性】ネシツムマブ併用群 (vs 非併用群)
- OS中央値 : 11.5ヵ月 (vs 9.9ヵ月)
- ハザード比0.84 (95%CI 0.74-0.96、 p=0.01)
- 1年OS : 48% (vs 43%)
- 2年OS : 20% (vs 17%)
- PFS中央値 : 5.7ヵ月 (vs 5.5ヵ月)
- 奏効率 : 31% (vs 29%)
- 病勢制御率 : 82% (vs 77%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
ポートラーザ®適正使用ガイド²⁾より抜粋
- 好中球減少症 42.0% (23.4%)
- 貧血 35.1% (8.7%)
- 血小板減少症 19.3% (9.7%)
- 悪心 48.3% (2.6%)
- 嘔吐 26.8% (2.6%)
- 下痢 15.6% (1.7%)
- 口内炎 10.0% (0.9%)
- 疲労 17.3% (2.4%)
- 動脈血栓塞栓関連事象 5.4% (3.9%)
- 静脈血栓塞栓関連事象 9.1% (5.0%)
- Infusion reaction 1.5% (0.4%)
- 血中クレアチニン増加 7.6% (0%)
- 低マグネシウム血症 29.6% (8.7%)
- 間質性肺疾患 0.2% (0.2%)
- 発疹 43.7% (1.3%)
- ざ瘡様皮膚炎 15.1% (1.3%)
- 皮膚乾燥 6.5% (0%)
- そう痒症 7.1% (0.2%)
- 皮膚亀裂 5.0% (0.4%)
- 爪囲炎 6.7% (0.4%)
- 手掌・足底発赤知覚不全症候群 1.7% (0.2%)
- 出血 17.5% (2.0%)
- 喀血 9.9% (1.3%)
- 鼻出血 7.4% (0%)
適格基準
SQUIRE試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0-2
- 好中球≧1,500/mm³
- Hgb≧9.5g/dL
- 血小板数≧10万/mm³
- 腎機能 : CrCl ≧50mL/min、 または血清クレアチニン≦1.2×ULN
- 肝機能 : T-Bil≦1.5×ULN、 AST/ALT≦2.5×ULN
用量レベル

SQUIRE試験³⁾のプロトコルを基に編集部作成
Grade 3–4の有害事象が生じた場合、 ネシツムマブは最大6週まで休薬し、 600mg (必要に応じて400mg) で再開可。 3回目の減量が必要な場合は中止とする。 再増量は3週以上経過後に医師判断で可。
一方、 CDDP/GEMは減量後の増量は行わず、 3回目の減量が必要な場合は投与中止。
腎障害患者に対する用量調整
CDDP⁴⁾ :
- 重篤な腎障害例への投与は禁忌
- CrCl 46~60mL/minでは75%、 31~45mL/minでは50%に減量し、 CrCl≦30mL/minでは投与を推奨しない
- 別の報告 : CrCl 30~49mL/minでは75%、 10~29mL/minでは投与が必要な場合に75%、 CrCl<10mL/minでは投与が必要な場合に50%に減量
GEM :
- 尿中未変化体量排泄率は10%未満であり、 減量は不要と考えられる。
ジェムザール®インタビューフォームを基に編集部が判断
有害事象発現時の減量・休薬・中止基準
ネシツムマブ :

ポートラーザ®電子添文¹⁾を基に編集部作成
CDDP・GEM :

SQUIRE試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
作用機序の特徴
ネシツムマブは、 ヒト上皮成長因子受容体 (EGFR) に対する遺伝子組換え型ヒトIgG1モノクローナル抗体であり、 EGFRに結合してシグナル伝達を阻害し、 腫瘍増殖を抑制すると考えられており、 EGFRの発現有無にかかわらず使用可能である。
肺癌診療GLにおける本レジメンの推奨
ネシツムマブは、 CDDP+GEM以外の化学療法との併用における有効性・安全性は確立していない。 肺癌診療ガイドライン2024年版⁵⁾における本レジメンの位置づけは以下のとおりである。

レジメン適用時の注意事項
CDDPによる腎障害予防 : 十分な水分負荷と利尿管理を行い、 水分負荷に対する心機能の耐容性は事前に確認する。
低Mg血症 : 倦怠感・筋痙縮・振戦などを伴う低マグネシウム血症があらわれることがあるため、 投与前・投与中・投与後は血清中電解質 (マグネシウム・カルシウム・カリウム・リン) をモニタリングする。 異常が認められた場合は休薬等の対応を行い、 必要に応じてマグネシウム補充を実施する。
動脈血栓塞栓症・静脈血栓塞栓症 : 脳血管障害や虚血性心疾患などの動脈血栓塞栓症、 肺塞栓症・深部静脈血栓症などの静脈血栓塞栓症があらわれることがあるため、 異常が認められた場合はネシツムマブを中止し、 適切に対応する。 血栓塞栓症または既往のある患者では、 再発や悪化のリスクがあるため注意が必要。
RMP【重要な特定されたリスク】
ポートラーザ®医薬品リスク管理計画書 (RMP)
- 動脈血栓塞栓症
- 静脈血栓塞栓症
- Infusion Reaction
- 低マグネシウム血症
- 間質性肺疾患
- 重度の皮膚障害
出典
- 日本化薬株式会社. ポートラーザ点滴静注液800mg 電子添文 2023年6月改訂 第2版.
- 日本化薬株式会社. ポートラーザ点滴静注液800mg 適正使用ガイド 2024年6月作成
- Lancet Oncol. 2015;16(7):763-74.
- 日本腎臓学会、 日本癌治療学会、 日本臨床腫瘍学会、 日本腎臓病薬物療法学会編 : がん薬物療法時の腎障害診療ガイドライン2022. ライフサイエンス出版.
- 日本肺癌学会編 : 肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む. 2024年版 ver.1.1. 金原出版
最終更新日 : 2025年7月15日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。