本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
PARP阻害薬 タラゾパリブ
*ファイザー株式会社の外部サイトへ遷移します
- イクスタンジ® (添付文書³⁾)
抗アンドロゲン薬 エンザルタミド
用法用量
電子添文¹⁾³⁾の用法および用量
BRCA変異陽性の遠隔転移去勢抵抗性前立腺癌
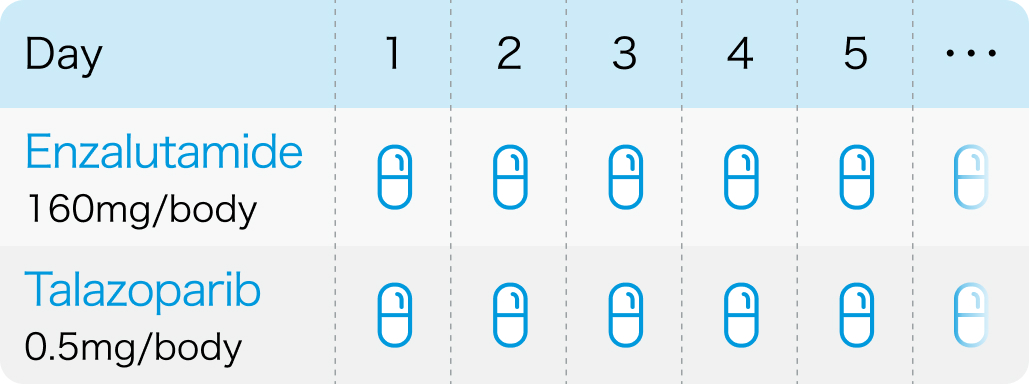
ターゼナ® 電子添文 (2024年1月作成 第1版)¹⁾、 イクスタンジ®電子添文 (2023年10月改訂 第2版)²⁾より作図
※前立腺癌適応は0.1mg、0.25mgカプセルのみ
0.1mgカプセルと0.25mgカプセルの生物学的同等性は示されていないため、 0.5mgを投与する際に0.1mgカプセルを使用しないこと。 ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より引用
※中等度腎機能障害のある患者 (eGFR 30~<60 mL/min/1.73m²) は、0.35mgを開始用量とする
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より引用
各プロトコル
投与開始基準
TALAPRO-2試験⁴⁾のプロトコル例
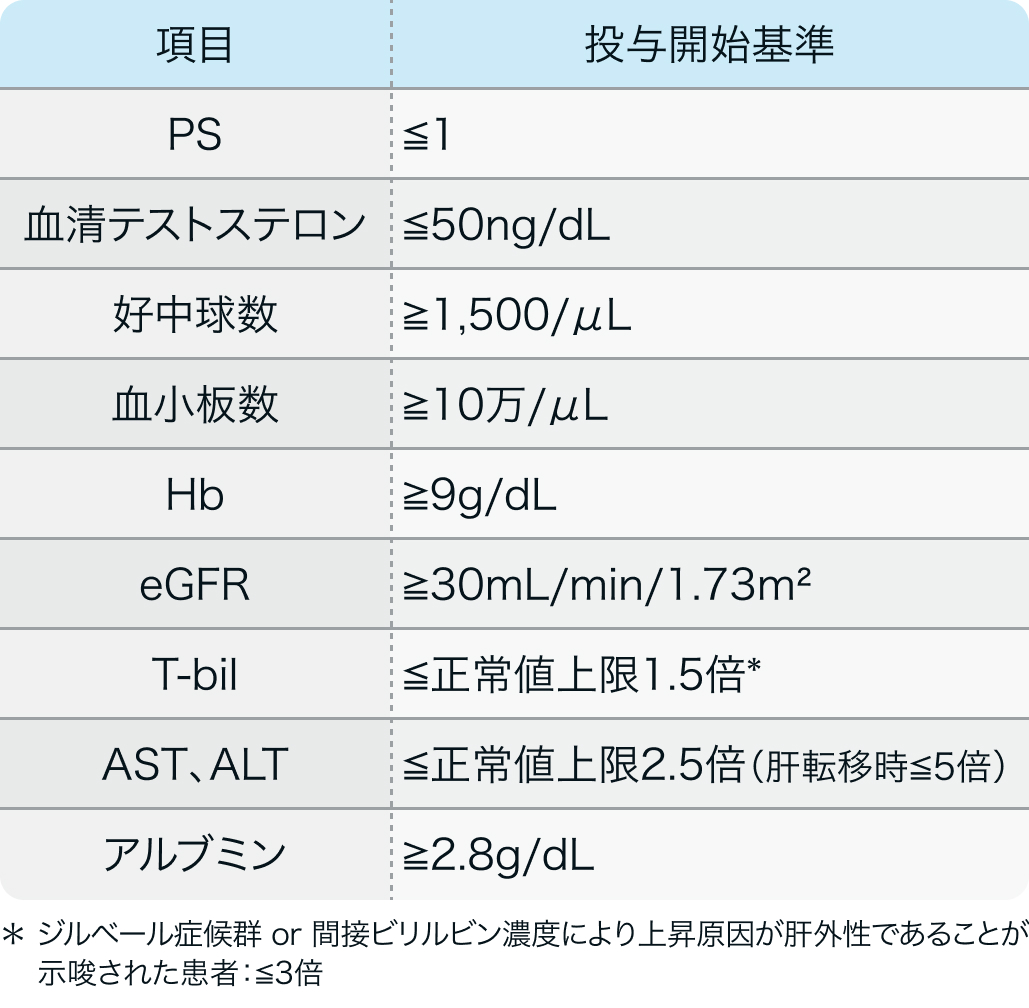
Lancet. 2023 Jul 22;402(10398):291-303²⁾より作図
減量・休薬・中止基準
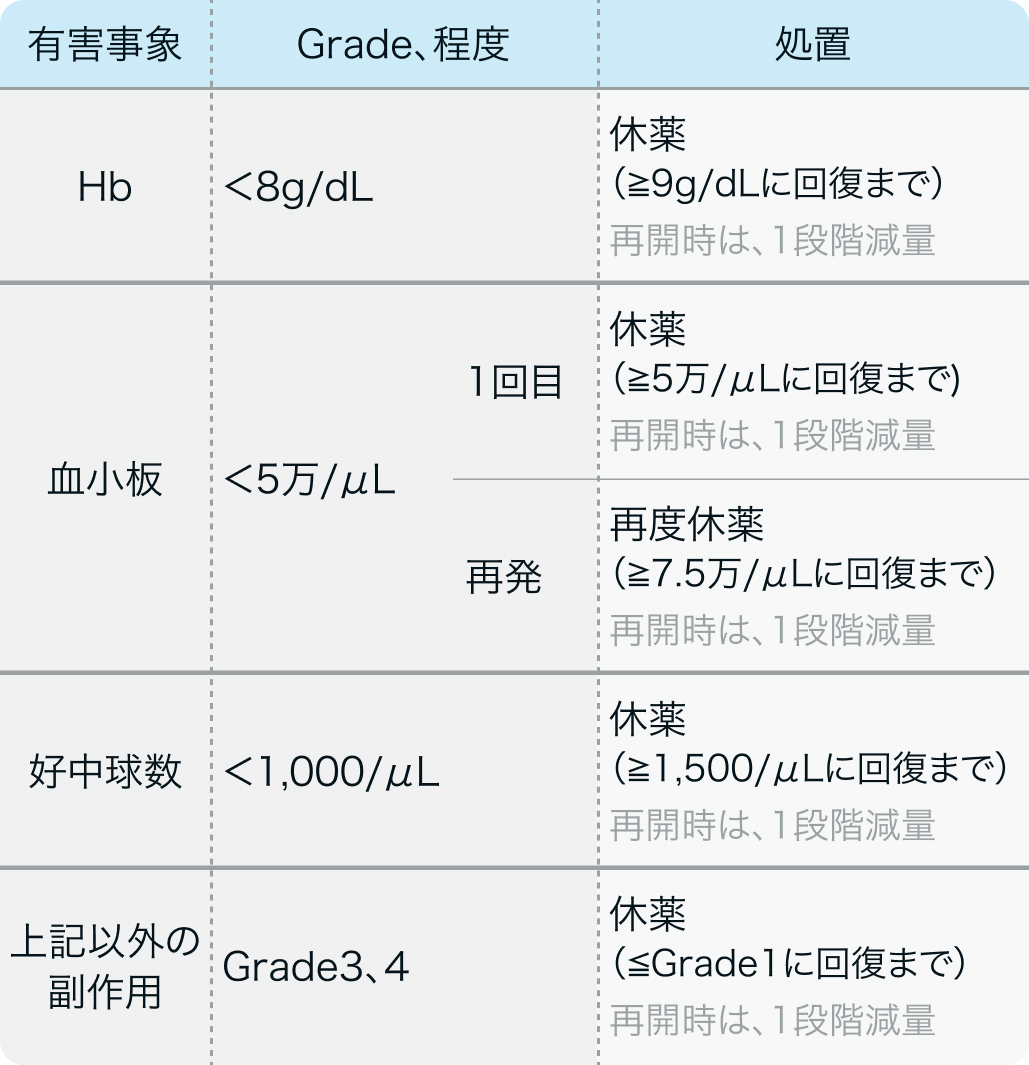
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
初回基準量と減量レベル
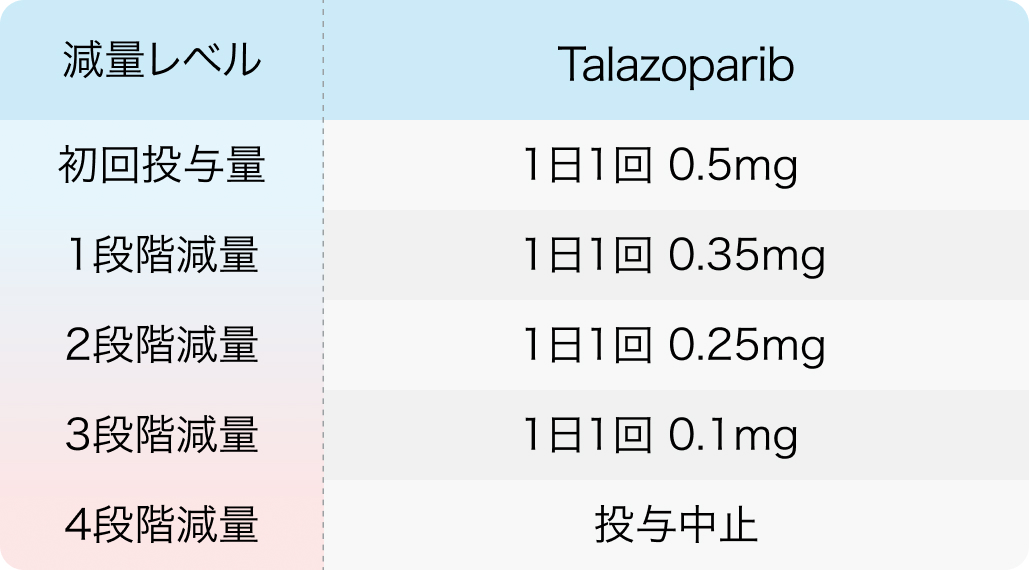
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
KeyData|臨床試験結果
TALAPRO-2試験⁴⁾
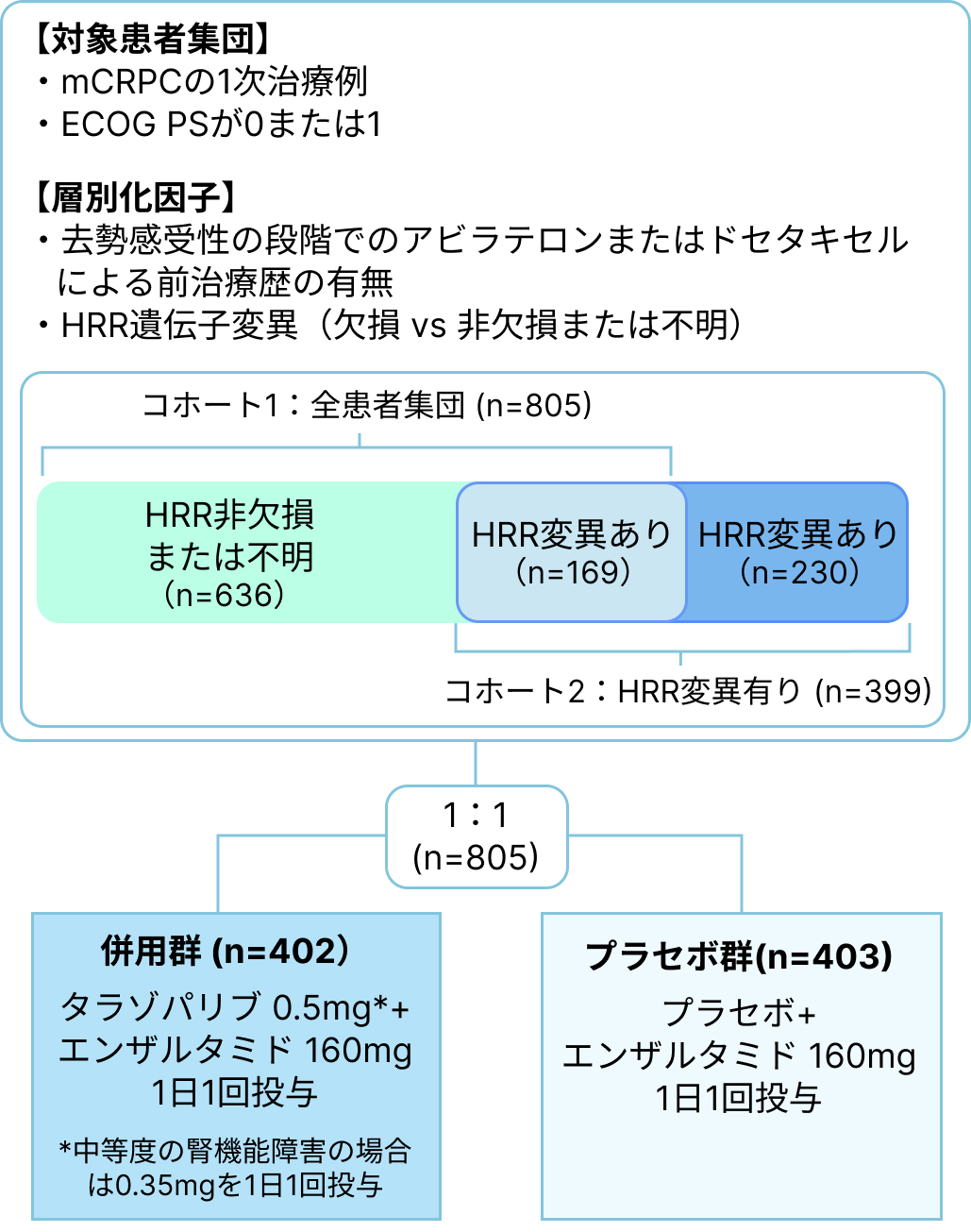
転移性去勢抵抗性前立腺癌 (mCRPC) に対する薬物療法歴のない*患者805例 (日本人116例を含む) を対象に、 タラゾパリブ+エンザルタミド併用 (TAL+ENZ) 投与 [タラゾパリブ 0.5mg 1日1回連続経口投与、 エンザルタミド 160mg 1日1回連続経口投与] とプラセボ+エンザルタミド併用 (PLA+ENZ) 投与の有効性を検討することを目的とした、 無作為化、 二重盲検、 プラセボ対照、 国際共同第Ⅲ相試験²⁾
*アンドロゲン除去療法及び第一世代抗アンドロゲン剤は許容された。 また、 転移性去勢感受性前立腺癌に対してアビラテロンまたはタキサン系抗悪性腫瘍剤は許容された。 なお、 両側精巣摘除術を受けていない患者は、 性腺刺激ホルモン放出ホルモン (GnRH) アゴニスト又はアンタゴニストによる去勢治療が継続された。
コホート1 rPFSサブグループ解析
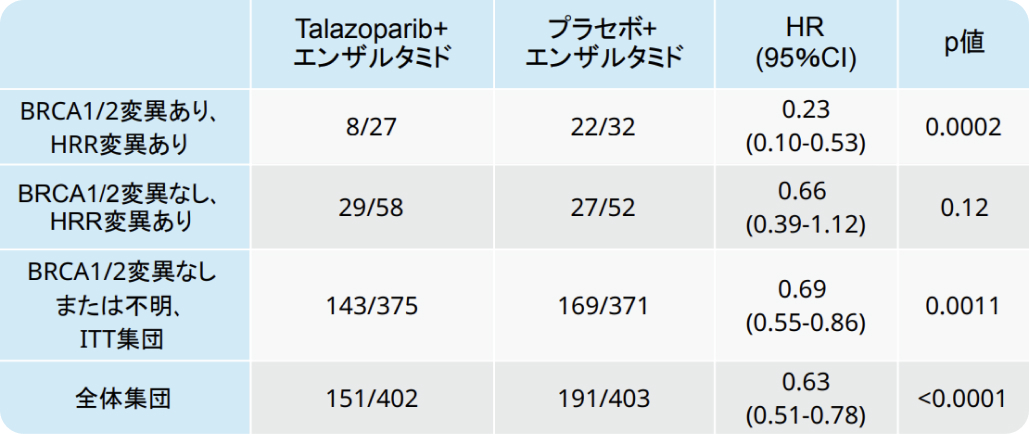
Lancet, 2023. 402(10398): p. 291-303を基に編集部作成
コホート2 rPSFサブグループ解析
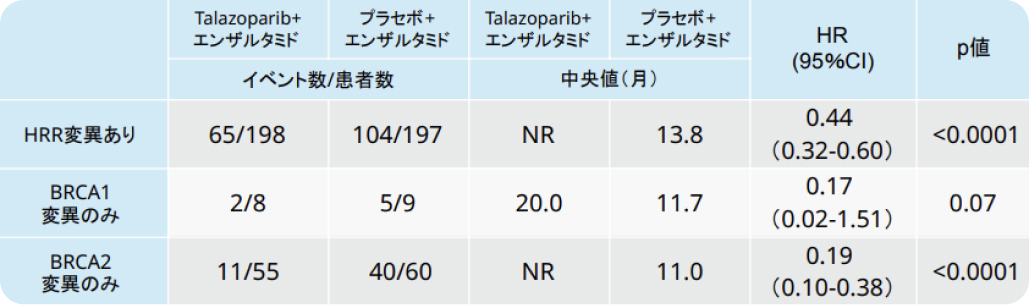
Nat Med, 2024. 30(1): p. 257-264を基に編集部作成
盲検下独立中央評価によるrPFSのKaplan-Meier曲線 (BRCA遺伝子変異陽性集団)
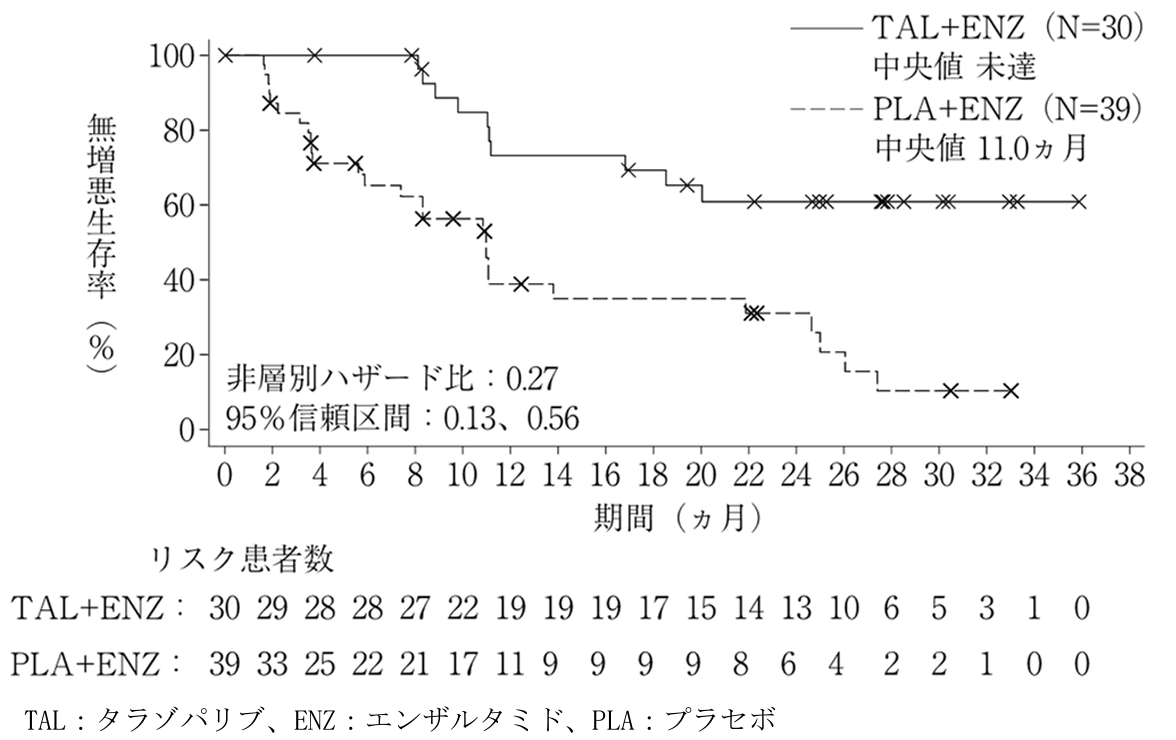
Lancet. 2023 Jul 22;402(10398):291-303.のデータに基づく結果を、 ターゼナ® 電子添文 2024年1月作成 (第1版)より引用
最終解析でOSを有意に延長
2024年10月10日に、 ファイザー社よりTALAPRO-2試験における全生存期間 (OS) の結果が報告され、 ENZ単独と比較して、 コホート1およびコホート2の最終OSに統計的に有意かつ臨床的に意義のある改善があったことが示された。 試験結果の詳細は今後学会で発表される予定。
出典
- ファイザー株式会社. ターゼナ®電子添文 (2024年1月改訂 第1版) [最終閲覧 : 2024/11/29]
- ファイザー株式会社. ターゼナ®適正使用ガイド BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌 (2024年4月作成 第2版) [最終閲覧 : 2024/11/29]
- アステラス製薬株式会社. イクスタンジ®電子添文 (2023年10月改訂 第2版) [最終閲覧 : 2024/11/29]
- Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet. 2023 Jul 22;402(10398):291-303. PMID: 37285865
最終更新日 : 2024年11月29日
監修医師 : HOKUTO編集部監修医師
Talazoparib+Enzalutamide
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
PARP阻害薬 タラゾパリブ
*ファイザー株式会社の外部サイトへ遷移します
- イクスタンジ® (添付文書³⁾)
抗アンドロゲン薬 エンザルタミド
用法用量
電子添文¹⁾³⁾の用法および用量
BRCA変異陽性の遠隔転移去勢抵抗性前立腺癌

ターゼナ® 電子添文 (2024年1月作成 第1版)¹⁾、 イクスタンジ®電子添文 (2023年10月改訂 第2版)²⁾より作図
※前立腺癌適応は0.1mg、0.25mgカプセルのみ
0.1mgカプセルと0.25mgカプセルの生物学的同等性は示されていないため、 0.5mgを投与する際に0.1mgカプセルを使用しないこと。 ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より引用
※中等度腎機能障害のある患者 (eGFR 30~<60 mL/min/1.73m²) は、0.35mgを開始用量とする
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より引用
各プロトコル
投与開始基準
TALAPRO-2試験⁴⁾のプロトコル例

Lancet. 2023 Jul 22;402(10398):291-303²⁾より作図
減量・休薬・中止基準

ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
初回基準量と減量レベル

ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
KeyData|臨床試験結果
TALAPRO-2試験⁴⁾

転移性去勢抵抗性前立腺癌 (mCRPC) に対する薬物療法歴のない*患者805例 (日本人116例を含む) を対象に、 タラゾパリブ+エンザルタミド併用 (TAL+ENZ) 投与 [タラゾパリブ 0.5mg 1日1回連続経口投与、 エンザルタミド 160mg 1日1回連続経口投与] とプラセボ+エンザルタミド併用 (PLA+ENZ) 投与の有効性を検討することを目的とした、 無作為化、 二重盲検、 プラセボ対照、 国際共同第Ⅲ相試験²⁾
*アンドロゲン除去療法及び第一世代抗アンドロゲン剤は許容された。 また、 転移性去勢感受性前立腺癌に対してアビラテロンまたはタキサン系抗悪性腫瘍剤は許容された。 なお、 両側精巣摘除術を受けていない患者は、 性腺刺激ホルモン放出ホルモン (GnRH) アゴニスト又はアンタゴニストによる去勢治療が継続された。
コホート1 rPFSサブグループ解析

Lancet, 2023. 402(10398): p. 291-303を基に編集部作成
コホート2 rPSFサブグループ解析

Nat Med, 2024. 30(1): p. 257-264を基に編集部作成
盲検下独立中央評価によるrPFSのKaplan-Meier曲線 (BRCA遺伝子変異陽性集団)

Lancet. 2023 Jul 22;402(10398):291-303.のデータに基づく結果を、 ターゼナ® 電子添文 2024年1月作成 (第1版)より引用
最終解析でOSを有意に延長
2024年10月10日に、 ファイザー社よりTALAPRO-2試験における全生存期間 (OS) の結果が報告され、 ENZ単独と比較して、 コホート1およびコホート2の最終OSに統計的に有意かつ臨床的に意義のある改善があったことが示された。 試験結果の詳細は今後学会で発表される予定。
出典
- ファイザー株式会社. ターゼナ®電子添文 (2024年1月改訂 第1版) [最終閲覧 : 2024/11/29]
- ファイザー株式会社. ターゼナ®適正使用ガイド BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌 (2024年4月作成 第2版) [最終閲覧 : 2024/11/29]
- アステラス製薬株式会社. イクスタンジ®電子添文 (2023年10月改訂 第2版) [最終閲覧 : 2024/11/29]
- Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet. 2023 Jul 22;402(10398):291-303. PMID: 37285865
最終更新日 : 2024年11月29日
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。