本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
血管新生阻害薬 スニチニブリンゴ酸塩カプセル
*ファイザー株式会社の外部サイトへ遷移します
投与スケジュール
RESTORE試験³⁾のプロトコル
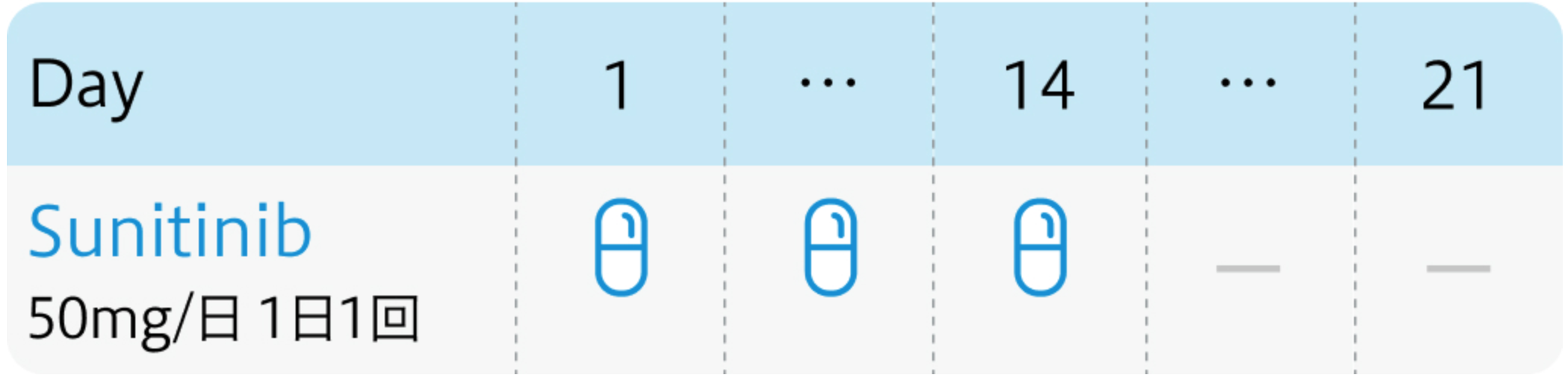
1サイクル6週間 (4週間投与、2週間休薬)

1日1回50mgを4週間連日経口投与し、 その後2週間休薬。 これを1サイクルとして繰り返す。
Ann Oncol. 2015 Nov;26(11):2300-5³⁾より作図
1サイクル3週間 (2週間投与、1週間休薬) ※保険適応外
なお、 1サイクル3週間のコースは適応外¹⁾だが、 RESTORE³⁾で有効性と安全性が検討された。
Ann Oncol. 2015 Nov;26(11):2300-5³⁾より作図
特徴と注意点
「4投2休」と「2投1休」のレジメンが存在
1日1回 50mg内服を4週行い2週休薬する「4投2休レジメン」が基本であるが、 「2投1休レジメン」は安全性が増し効果は劣らないという試験結果により、 「2投1休レジメン」もよく用いられる*。
*⚠適応外使用を推奨するものではありません
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
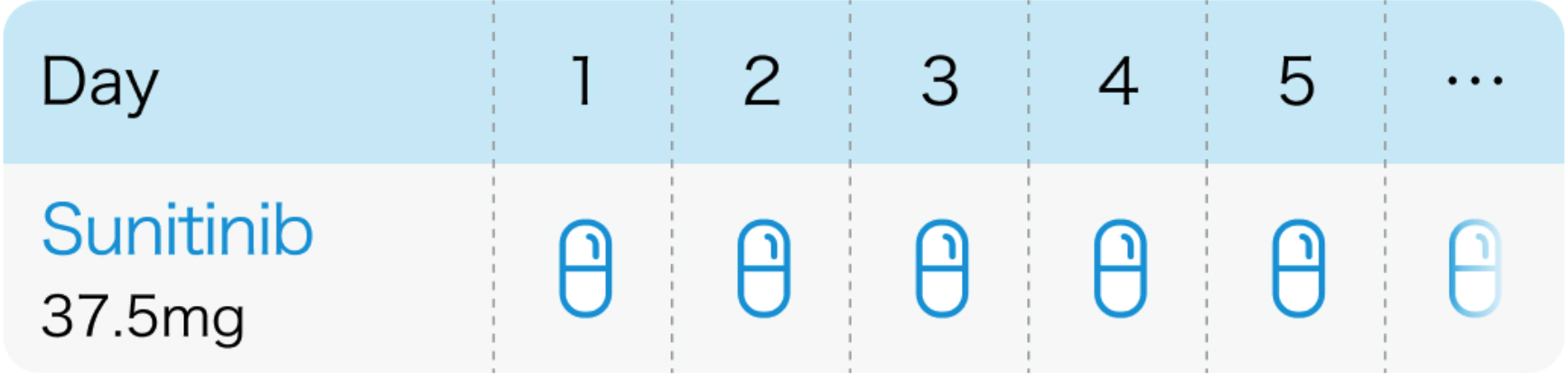
37.5mg連日投与のレジメンは選択しない
神経内分泌癌でのスニチニブ投与法は37.5mg連日投与 (休薬なし) のレジメンであるが、 腎がんにおいては37.5mg連日内服レジメンは、 50mg 4投2休レジメンより効果が劣ることが示されているため適用しないよう注意する。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
各プロトコル
投与開始基準
適正使用ガイド²⁾の基準
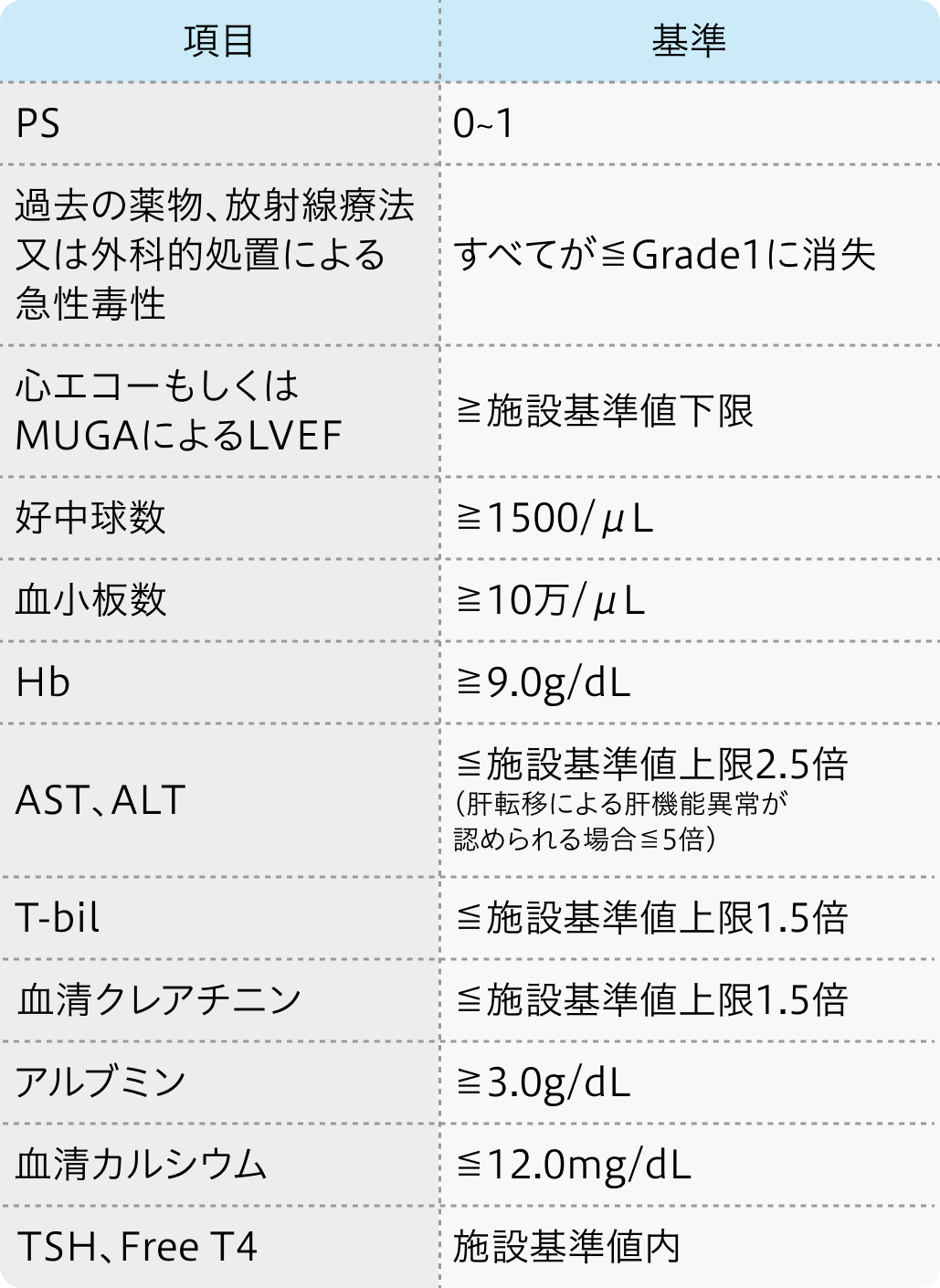
スーテント®適正使用ガイド (2023年8月改訂)²⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準
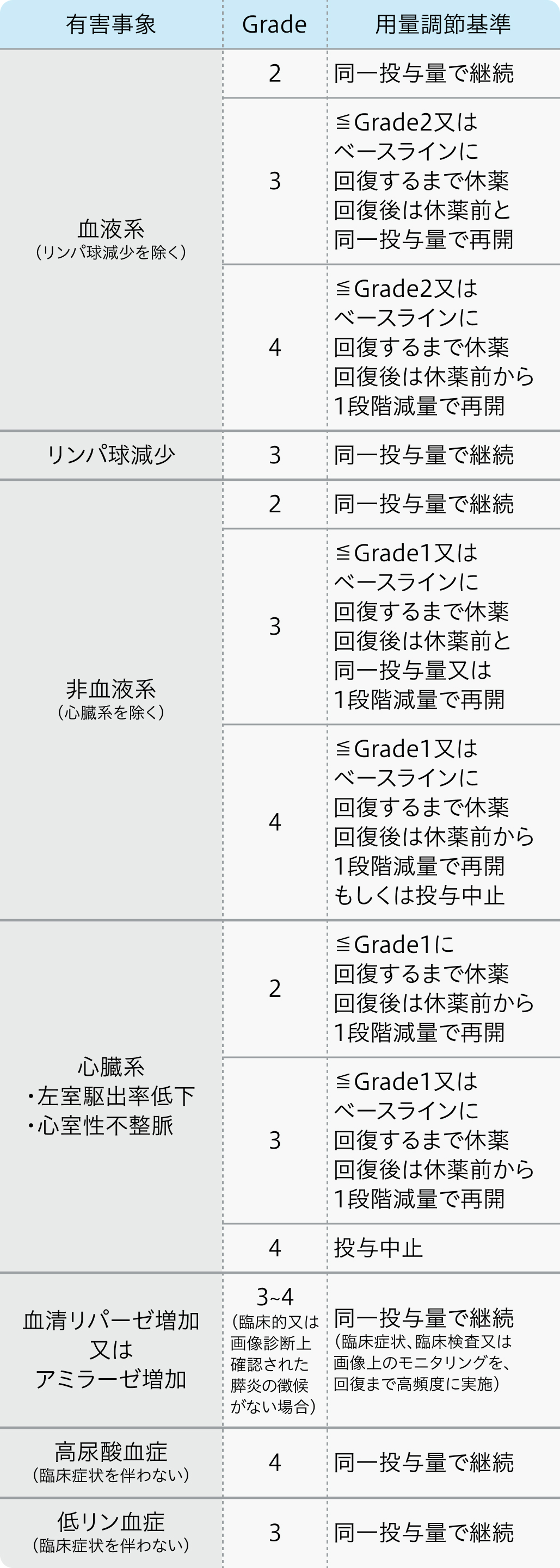
スーテント®電子添文 (2024年2月改訂 第2版)¹⁾より作図
初回基準量と減量レベル
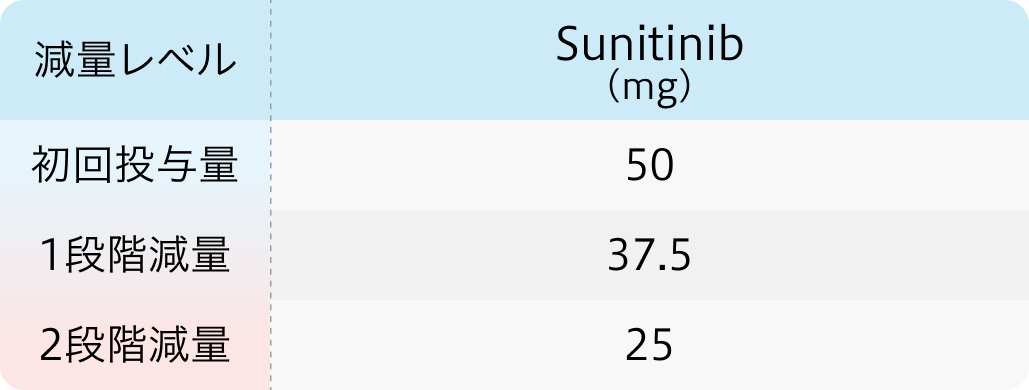
スーテント®電子添文 (2024年2月改訂 第2版)¹⁾より作図
KeyData|臨床試験結果
NCT00083889試験³⁾
N Engl J Med. 2007;356(2):115-24.
未治療の転移性の淡明細胞型腎細胞癌患者において、 スニチニブ投与の効果を、 インターフェロンα (IFN-α) を対照に検証した第Ⅲ相比較試験NCT00083889の結果より、 無増悪生存期間 (PFS) および奏効率 (ORR)、 患者報告アウトカムに対する有益性が示された。
PFS中央値
- スニチニブ群 : 11ヵ月 (95%CI 10-12)
- IFN-α群 : 5ヵ月 (95%CI 4-6)
HR 0.42 (95%CI 0.32-0.54)、 p<0.001 MSKCC基準の3カテゴリー (favorable、 intermediate、 poor) 全てで、 PFS中央値はスニチニブ群の方がIFN-α群よりも長かった。
OS中央値
初回報告時、 両群いずれも未到達だったものの、 スニチニブ群のIFN-α群に対するHRは0.65 (95% CI 0.45-0.9)、 P=0.02と改善傾向を認めた
ORR
- スニチニブ群 : 31% (95%CI 26-36)
- IFN-α群 : 6% (95%CI 4-9) p<0.001
主な有害事象 (カッコ内はGrade3~4)¹⁾
- 白血球減少症 20.8% (1.3%)
- 好中球減少 19.2% (3.2%)
- 貧血 18.9% (1.1%)
- 血小板減少症 17.3% (2.1%)
- リンパ球減少 16.0% (3.2%)
- 下痢14.1% (1.3%)
- 倦怠感 13.6% (1.9%)
- 吐き気 11.7% (0.8%)
- 嘔吐 6.4% (1.1%)
- 高血圧 6.4% (2.1%)
- 粘膜炎 5.3% (0.5%)
- 手足症候群 5.3% (1.3%)
- 発熱 1.9% (0.3%)
RESTORE試験⁴⁾
Ann Oncol. 2015 Nov;26(11):2300-5.
再発または転移を有する淡明細胞型腎細胞癌患者において、 スニチニブを2投1休レジメンで投与した場合の有効性と安全性を、 従来の4投1休レジメンを対照に検証した比較試験RESTOREの結果より、 2投1休レジメンは毒性が少なく、 有効性を損なうことなく6ヵ月後の無再発生存率 (FFS) が高いことが示された。
TTF中央値
- 2投1休群 : 7.6ヵ月 (95%CI 4.4-10.9)
- 4投2休群 : 6.0ヵ月 (95%CI 3.1-8.9)
HR 0.57 (95%CI 0.34-0.95)、p=0.029
ORR
- 2投1休群 : 47% (95%CI 32-63)
- 4投2休群 : 33% (95%CI 18-49)
TTP中央値
- 2投1休群 : 12.1ヵ月 (95%CI 4.0-25.3)
- 4投2休群 : 10.1ヵ月 (95%CI 7.5-12.7)
HR 0.75 (95%CI 0.44-1.27)
OS中央値
- 2投1休群 : 30.5ヵ月 (95%CI 18.9-42.0)
- 4投2休群 : 28.4ヵ月 (95%CI 11.3-45.4)
HR1.15 (95%CI 0.64-2.04)
主な有害事象 (カッコ内はGrade3~4)
4週間投与、 2週間休薬
- 血小板減少 77.8% (22.2%)
- 貧血 72.2% (8.3%)
- 白血球減少症 72.2% (2.8%)
- 好中球減少症 61.1% (27.8%)
- 口内炎 86.1% (11.1%)
- 倦怠感 83.3% (5.6%)
- 吐き気 25.0% (0%)
- 嘔吐 16.7% (0%)
- 下痢 13.9% (2.8%)
- 手足症候群 75.0% (36.1%)
- 高血圧 72.2% (33.3%)
- 甲状腺機能低下症 36.1% (0%)
- タンパク尿 11.1% (2.8%)
2週間投与、 1週間休薬
- 血小板減少 71.1% (23.7%)
- 貧血 71.1% (13.2%)
- 白血球減少症 50.0% (2.6%)
- 好中球減少症 36.8% (10.5%)
- 口内炎 71.1% (2.6%)
- 倦怠感 57.9% (2.6%)
- 下痢 36.8% (0%)
- 吐き気 31.6% (0%)
- 嘔吐 13.2% (0%)
注意すべき有害事象
- 手足症候群 68.4% (18.4%)
- 高血圧 55.3% (23.7%)
- タンパク尿 47.4% (13.2%)
- 甲状腺機能低下症 44.7% (0%)
出典
- ファイザー株式会社. スーテント®電子添文 (2024年2月改訂 第2版) [最終閲覧 : 2024/11/25]
- ファイザー株式会社. スーテント®適正使用ガイド (2023年8月改訂) [最終閲覧 : 2024/11/25]
- Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med. 2007 Jan 11;356(2):115-24. PMID: 17215529
- RandomizEd phase II trial of Sunitinib four weeks on and two weeks off versus Two weeks on and One week off in metastatic clear-cell type REnal cell carcinoma: RESTORE trial. Ann Oncol. 2015 Nov;26(11):2300-5. PMID: 26347107
最終更新日 : 2024年11月25日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
Sunitinib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
血管新生阻害薬 スニチニブリンゴ酸塩カプセル
*ファイザー株式会社の外部サイトへ遷移します
投与スケジュール
RESTORE試験³⁾のプロトコル
1サイクル6週間 (4週間投与、2週間休薬)

1日1回50mgを4週間連日経口投与し、 その後2週間休薬。 これを1サイクルとして繰り返す。
Ann Oncol. 2015 Nov;26(11):2300-5³⁾より作図
1サイクル3週間 (2週間投与、1週間休薬) ※保険適応外

なお、 1サイクル3週間のコースは適応外¹⁾だが、 RESTORE³⁾で有効性と安全性が検討された。
Ann Oncol. 2015 Nov;26(11):2300-5³⁾より作図
特徴と注意点
「4投2休」と「2投1休」のレジメンが存在
1日1回 50mg内服を4週行い2週休薬する「4投2休レジメン」が基本であるが、 「2投1休レジメン」は安全性が増し効果は劣らないという試験結果により、 「2投1休レジメン」もよく用いられる*。
*⚠適応外使用を推奨するものではありません
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
37.5mg連日投与のレジメンは選択しない
神経内分泌癌でのスニチニブ投与法は37.5mg連日投与 (休薬なし) のレジメンであるが、 腎がんにおいては37.5mg連日内服レジメンは、 50mg 4投2休レジメンより効果が劣ることが示されているため適用しないよう注意する。

監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
各プロトコル
投与開始基準
適正使用ガイド²⁾の基準

スーテント®適正使用ガイド (2023年8月改訂)²⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

スーテント®電子添文 (2024年2月改訂 第2版)¹⁾より作図
初回基準量と減量レベル

スーテント®電子添文 (2024年2月改訂 第2版)¹⁾より作図
KeyData|臨床試験結果
NCT00083889試験³⁾
N Engl J Med. 2007;356(2):115-24.
未治療の転移性の淡明細胞型腎細胞癌患者において、 スニチニブ投与の効果を、 インターフェロンα (IFN-α) を対照に検証した第Ⅲ相比較試験NCT00083889の結果より、 無増悪生存期間 (PFS) および奏効率 (ORR)、 患者報告アウトカムに対する有益性が示された。
PFS中央値
- スニチニブ群 : 11ヵ月 (95%CI 10-12)
- IFN-α群 : 5ヵ月 (95%CI 4-6)
HR 0.42 (95%CI 0.32-0.54)、 p<0.001 MSKCC基準の3カテゴリー (favorable、 intermediate、 poor) 全てで、 PFS中央値はスニチニブ群の方がIFN-α群よりも長かった。
OS中央値
初回報告時、 両群いずれも未到達だったものの、 スニチニブ群のIFN-α群に対するHRは0.65 (95% CI 0.45-0.9)、 P=0.02と改善傾向を認めた
ORR
- スニチニブ群 : 31% (95%CI 26-36)
- IFN-α群 : 6% (95%CI 4-9) p<0.001
主な有害事象 (カッコ内はGrade3~4)¹⁾
- 白血球減少症 20.8% (1.3%)
- 好中球減少 19.2% (3.2%)
- 貧血 18.9% (1.1%)
- 血小板減少症 17.3% (2.1%)
- リンパ球減少 16.0% (3.2%)
- 下痢14.1% (1.3%)
- 倦怠感 13.6% (1.9%)
- 吐き気 11.7% (0.8%)
- 嘔吐 6.4% (1.1%)
- 高血圧 6.4% (2.1%)
- 粘膜炎 5.3% (0.5%)
- 手足症候群 5.3% (1.3%)
- 発熱 1.9% (0.3%)
RESTORE試験⁴⁾
Ann Oncol. 2015 Nov;26(11):2300-5.
再発または転移を有する淡明細胞型腎細胞癌患者において、 スニチニブを2投1休レジメンで投与した場合の有効性と安全性を、 従来の4投1休レジメンを対照に検証した比較試験RESTOREの結果より、 2投1休レジメンは毒性が少なく、 有効性を損なうことなく6ヵ月後の無再発生存率 (FFS) が高いことが示された。
TTF中央値
- 2投1休群 : 7.6ヵ月 (95%CI 4.4-10.9)
- 4投2休群 : 6.0ヵ月 (95%CI 3.1-8.9)
HR 0.57 (95%CI 0.34-0.95)、p=0.029
ORR
- 2投1休群 : 47% (95%CI 32-63)
- 4投2休群 : 33% (95%CI 18-49)
TTP中央値
- 2投1休群 : 12.1ヵ月 (95%CI 4.0-25.3)
- 4投2休群 : 10.1ヵ月 (95%CI 7.5-12.7)
HR 0.75 (95%CI 0.44-1.27)
OS中央値
- 2投1休群 : 30.5ヵ月 (95%CI 18.9-42.0)
- 4投2休群 : 28.4ヵ月 (95%CI 11.3-45.4)
HR1.15 (95%CI 0.64-2.04)
主な有害事象 (カッコ内はGrade3~4)
4週間投与、 2週間休薬
- 血小板減少 77.8% (22.2%)
- 貧血 72.2% (8.3%)
- 白血球減少症 72.2% (2.8%)
- 好中球減少症 61.1% (27.8%)
- 口内炎 86.1% (11.1%)
- 倦怠感 83.3% (5.6%)
- 吐き気 25.0% (0%)
- 嘔吐 16.7% (0%)
- 下痢 13.9% (2.8%)
- 手足症候群 75.0% (36.1%)
- 高血圧 72.2% (33.3%)
- 甲状腺機能低下症 36.1% (0%)
- タンパク尿 11.1% (2.8%)
2週間投与、 1週間休薬
- 血小板減少 71.1% (23.7%)
- 貧血 71.1% (13.2%)
- 白血球減少症 50.0% (2.6%)
- 好中球減少症 36.8% (10.5%)
- 口内炎 71.1% (2.6%)
- 倦怠感 57.9% (2.6%)
- 下痢 36.8% (0%)
- 吐き気 31.6% (0%)
- 嘔吐 13.2% (0%)
注意すべき有害事象
- 手足症候群 68.4% (18.4%)
- 高血圧 55.3% (23.7%)
- タンパク尿 47.4% (13.2%)
- 甲状腺機能低下症 44.7% (0%)
出典
- ファイザー株式会社. スーテント®電子添文 (2024年2月改訂 第2版) [最終閲覧 : 2024/11/25]
- ファイザー株式会社. スーテント®適正使用ガイド (2023年8月改訂) [最終閲覧 : 2024/11/25]
- Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med. 2007 Jan 11;356(2):115-24. PMID: 17215529
- RandomizEd phase II trial of Sunitinib four weeks on and two weeks off versus Two weeks on and One week off in metastatic clear-cell type REnal cell carcinoma: RESTORE trial. Ann Oncol. 2015 Nov;26(11):2300-5. PMID: 26347107
最終更新日 : 2024年11月25日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。