本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
アルキル化薬 ストレプトゾシン注射用
*ノーベルファーマ株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量
<5日間連日投与法>
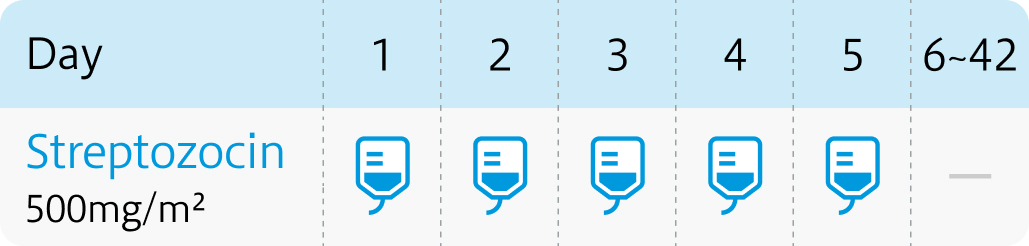
通常、 成人には1回500mg/m²を1日1回5日間連日点滴静脈内投与し、 37日間休薬。 これを1サイクルとして投与を繰り返す。
腎毒性を軽減するために輸液を行い、 尿量確保に注意する。 1回量を30分~2時間かけて点滴静脈内投与する。
ザノサー®電子添文 (2023年7月改訂 第1版) より作図
<1週間間隔投与法>
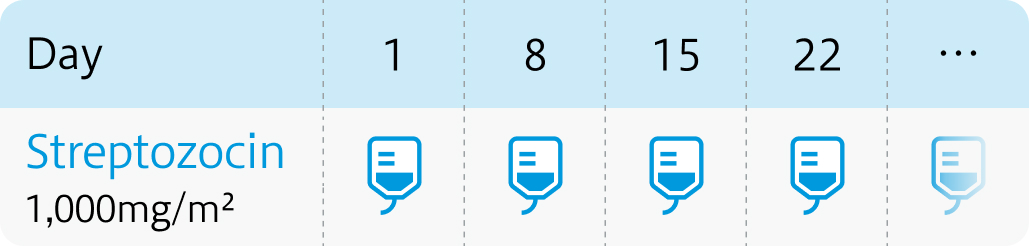
通常、 成人には1回1,000mg/m²を1週間ごとに1日1回点滴静脈内投与。 1週間間隔投与法において、 12週目までの忍容性が良好な場合、 1回1,250mg/m²に増量可。 さらに18週目までの忍容性が認められる場合、 最大1回1,500mg/m²まで増量可。
腎毒性を軽減するために輸液を行い、 尿量確保に注意する。 1回量を30分~2時間かけて点滴静脈内投与する。
ザノサー®電子添文 (2023年7月改訂 第1版) より作図
各プロトコル
投与開始基準
適正使用ガイド²⁾の記載例
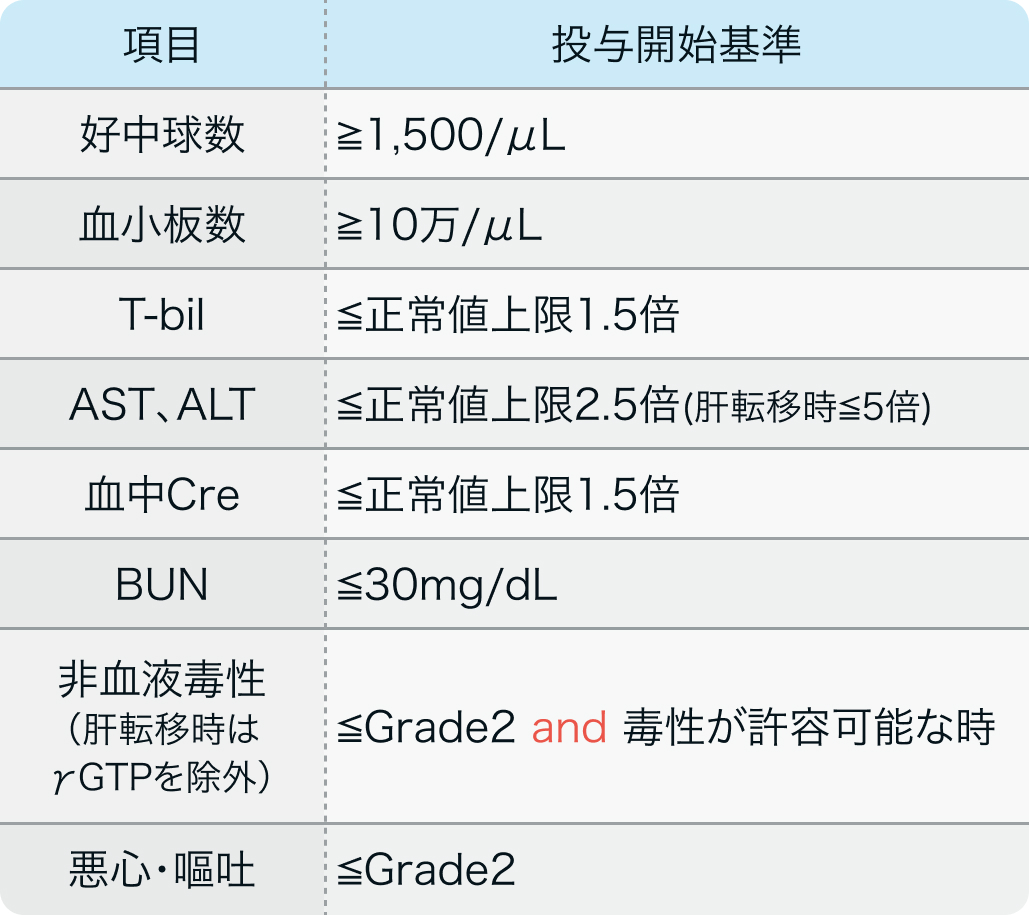
ザノサー®適正使用ガイド (2023年7月作成) より作図
減量・休薬・中止基準
電子添文¹⁾の記載例
<5日間連日投与法>
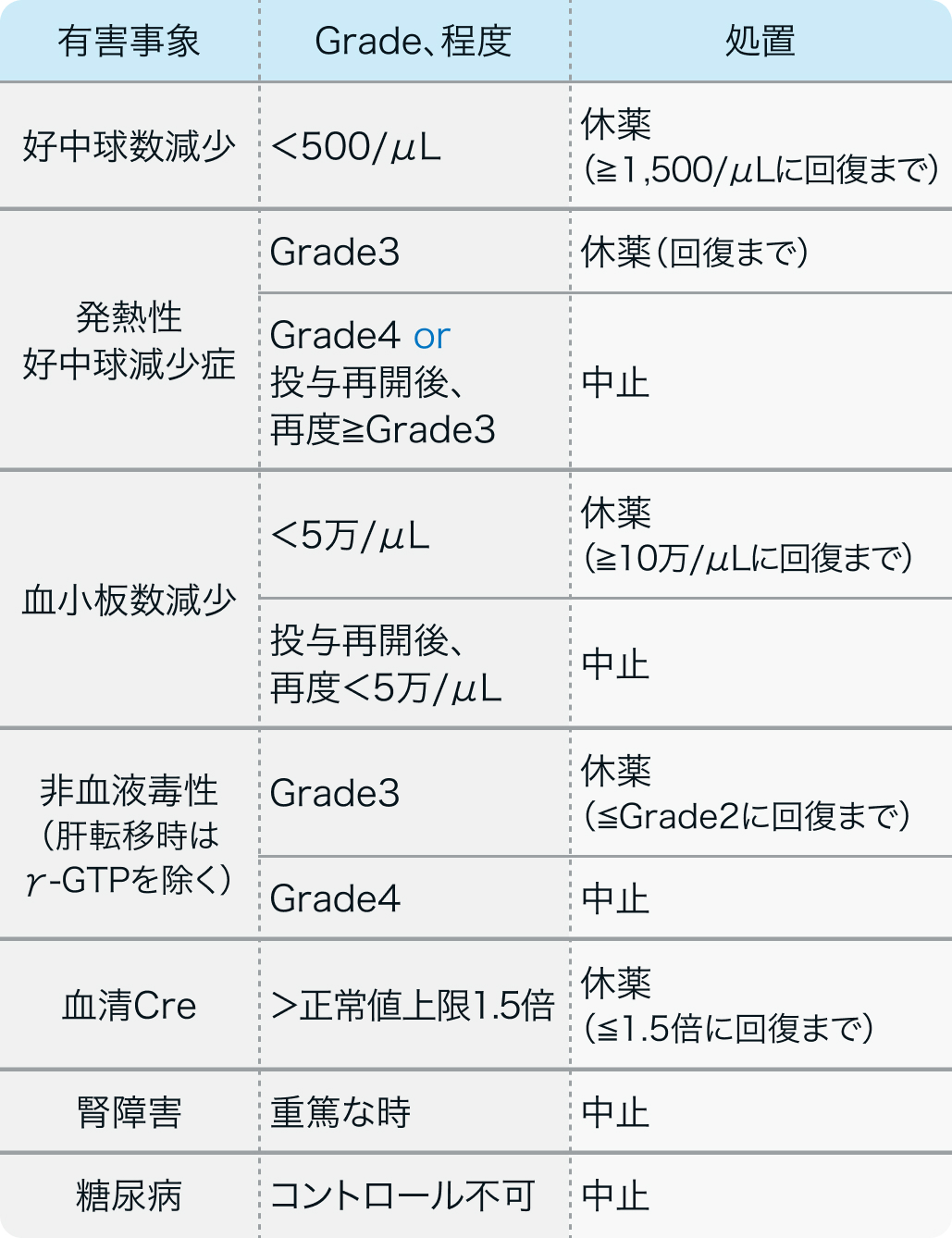
ザノサー®電子添文 (2023年7月改訂 第1版) より作図
<1週間間隔投与法>
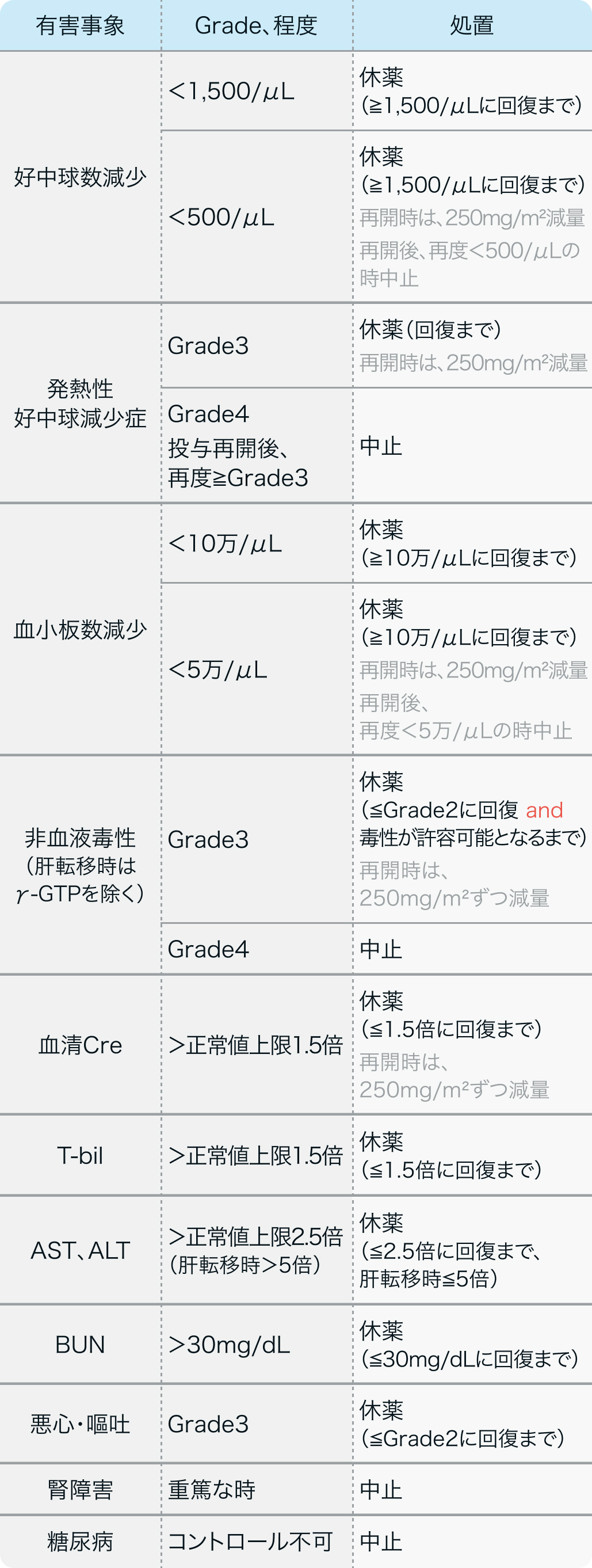
ザノサー®電子添文 (2023年7月改訂 第1版) より作図
主な有害事象
試験詳細については「臨床試験」の項目を参照ください。
全体での主な有害事象 (カッコ内はGrade3~4)
- 悪心 21.1% (0%)
- 食欲減退 23.3% (2.2 %)
- 倦怠感 28.9% (0%)
- 便秘 30.0% (0%)
- 血液学的副作用 11.1% (0%)
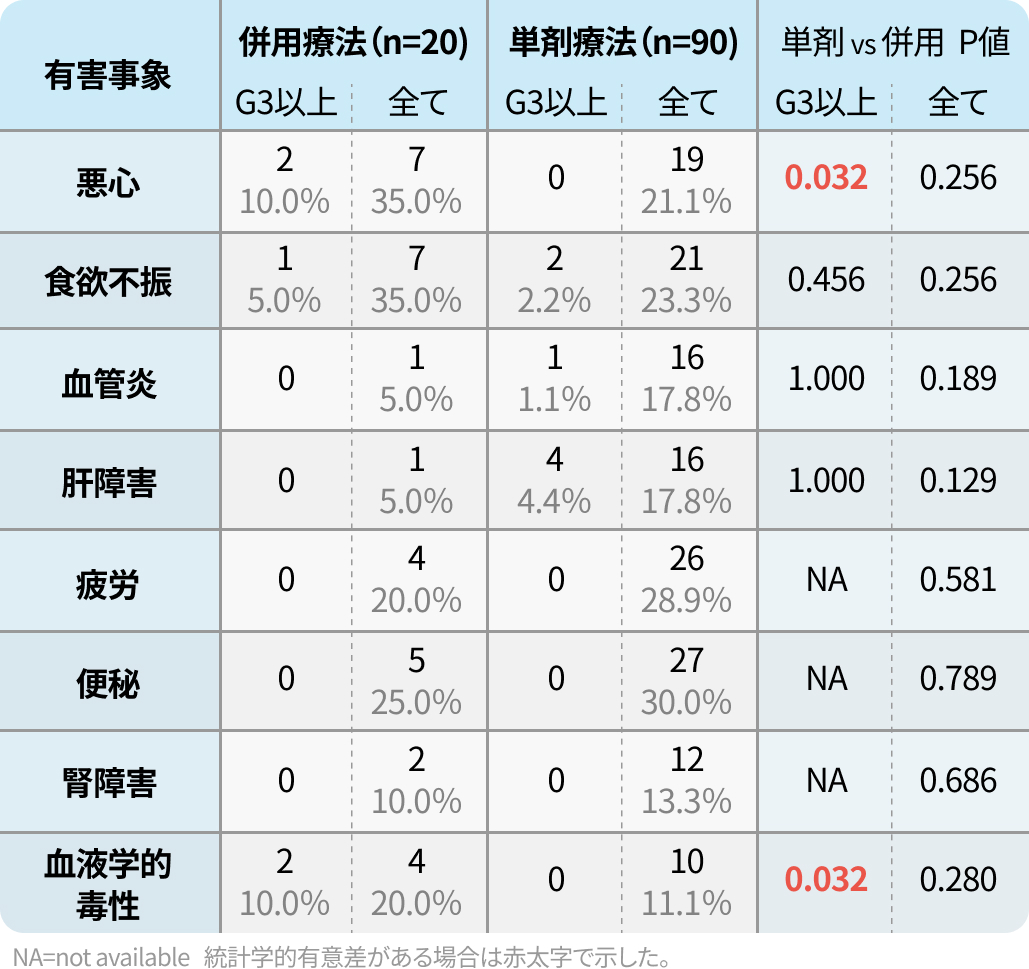
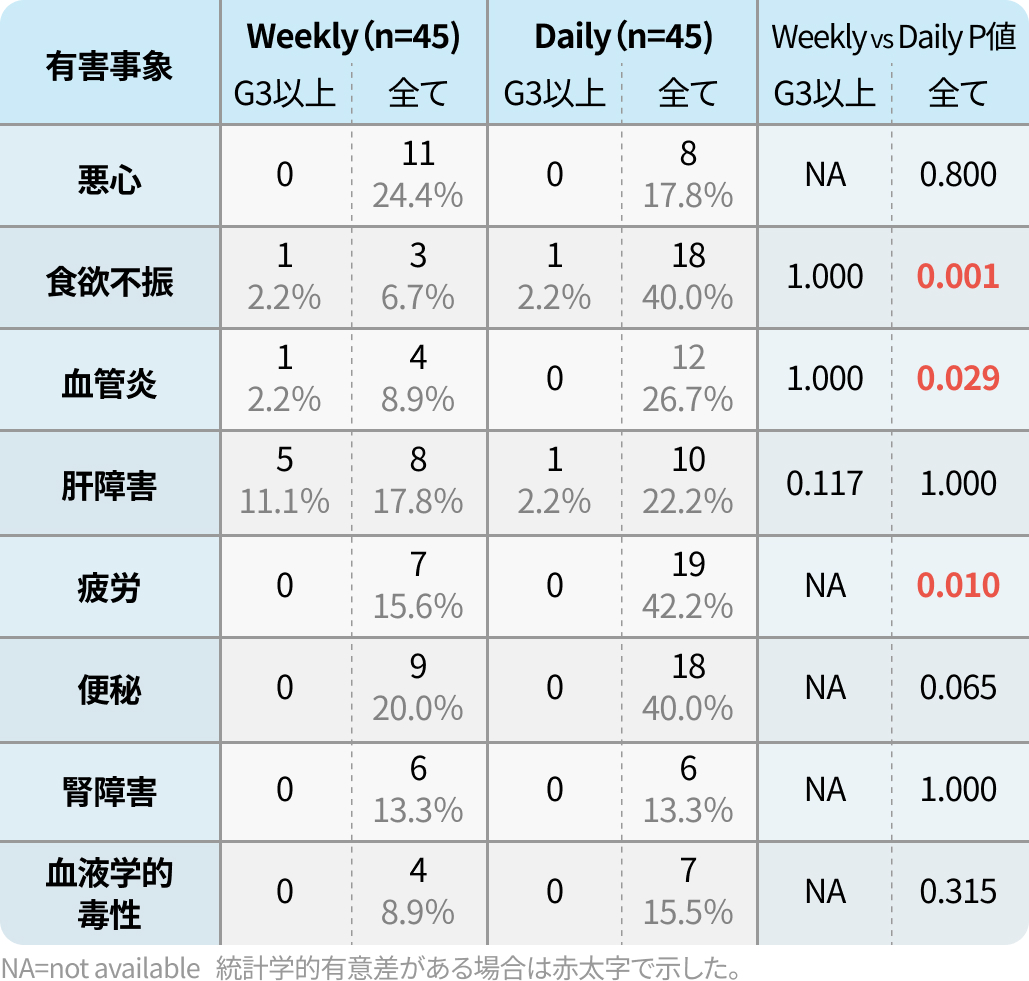
※Daily併用療法のレジメン
day1、day22にドキソルビシン(DXR)
またはday1~5に5-FU 400mg/m²を併用投与
※Weekly併用療法のレジメン
day1からS-1 80mg/m²を隔日に併用投与
ソマトスタチンアナログは併用薬として扱わなかった。 治療期間中に何人かの被験者はレジメンや併用薬剤を変更したが、 その場合には、 最適な結果に至る前に長く投与した方法を主な投与方法とした。 なお、ザノサー®点滴静注用1g は、 他の抗悪性腫瘍剤との併用は『併用注意』となっております。
特徴と注意点
- ストレプトゾシンはアルキル化剤のニトロソウレア系に属する抗がん薬で、 グルコーストランスポーターを介して細胞内に取り込まれ、 DNAをアルキル化し、 DNAの合成を阻害することで腫瘍増殖を抑制する。
- ストレプトゾシンは海外では古くから使われており、 いくつかのランダム化比較試験が行われているが、 いずれも古いものであり、 十分なエビデンスがあるとは言いがたい。 また、 ほとんどの報告が5-FU等との併用であり、 単剤の報告は少ない。
- 日本ではストレプトゾシン単剤 (daily投与またはweekly投与) の第I/II相試験⁴⁾で有効性と安全性が評価され、 2015年に使用可能となった。
- 膵・消化管神経内分泌腫瘍診療ガイドライン第2版³⁾では、 膵NETに対してはグレードB、 消化管NETに対してはソマトスタチンアナログやエベロリムスの適応とならない場合の選択肢 (グレードC) に位置づけられている。
- 有害事象として、 悪心、 疲労などがあげられる。 また、 注意を有する副作用として耐糖能障害、 腎機能障害、 肝機能障害などがある。 催吐性リスク分類では高度リスクに分類されるため、 十分な制吐療法が必要である。 また、 腎機能障害の予防として投与前後にハイドレーションを行い、 尿量を確保する。 国内第I/II相試験¹⁾の際には、 投与前後でそれぞれ1,000~2,000mLの輸液が投与されていた。
臨床試験 : 本邦多施設共同研究⁴⁾
本研究は、 進行膵神経内分泌腫瘍に対するSTZのWeeklyレジメンおよび単剤療法の効果の評価、 効果予測因子の探索を目的として実施された。 対象は日本国内の25施設で、 進行膵神経内分泌腫瘍に対してSTZを投与した患者110例で、 臨床データをレトロスペクティブに収集し (2015年2月~2017年3月)、 治療効果や安全性、 無増悪生存期間 (PFS)、 効果予測因子などを分析した
ザノサー®点滴静注用1g は、 他の抗悪性腫瘍剤との併用は『併用注意』となっております。
Cancer Chemother Pharmacol. 2018 Oct;82(4):661-668. PMID: 30054710
奏効率
全症例の結果は以下のとおりであった
・ ORR : 21.8%
OPR : objective response rate
・ DCR : 70.0%
DCR : disease control rate
・ PFS : 9.8ヵ月 [95%CI 5.9-13.3]
Daily・Weeklyレジメンで有意差を認めなかった
・ DailyレジメンのOPR : 22.0%
・ WeeklyレジメンのORR : 21.6%
(P=1.000、 Fisher’s exact test)
併用・単剤療法で有意差を認めなかった
・ 併用療法のORR : 25.0%
・ 単剤療法のORR : 21.1%
(P=0.766、 Fisher’s exact test)
腫瘍分類別は NET-G2で最も高い効果であった
・ NET-G2のOPR : 23.0%
・ NET-G1+G2のORR : 22.7%
・ NET-G3のORR : 18.2%
奏効率と効果予測因子
腫瘍縮小効果の唯一の関連因子として、 単変量・多変量解析ともにKi-67指数>5%が挙げられた
・ Ki-67指数>5%のOPR : 31.3%
・ Ki-67指数≦5%のOPR : 9.3%
(P=0.017、 ロジスティック回帰分析)
出典
- ノーベルファーマ株式会社. ザノサー®電子添文 (2023年7月改訂 第1版) [最終閲覧 : 2025/1/4]
- ノーベルファーマ株式会社. ザノサー®適正使用ガイド (2023年7月作成) [最終閲覧 : 2025/1/4]
- 膵・消化管NEN診療ガイドライン第二版. 日本神経内分泌腫瘍研究会
- Multi-center clinical evaluation of streptozocin-based chemotherapy for advanced pancreatic neuroendocrine tumors in Japan: focus on weekly regimens and monotherapy. Cancer Chemother Pharmacol. 2018 Oct;82(4):661-668. PMID: 30054710
最終更新日 : 2025年1月4日
執筆医 : 香川大学医学部附属病院 腫瘍内科 講師 奥山浩之先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
Streptozocin
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
アルキル化薬 ストレプトゾシン注射用
*ノーベルファーマ株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量
<5日間連日投与法>

通常、 成人には1回500mg/m²を1日1回5日間連日点滴静脈内投与し、 37日間休薬。 これを1サイクルとして投与を繰り返す。
腎毒性を軽減するために輸液を行い、 尿量確保に注意する。 1回量を30分~2時間かけて点滴静脈内投与する。
ザノサー®電子添文 (2023年7月改訂 第1版) より作図
<1週間間隔投与法>

通常、 成人には1回1,000mg/m²を1週間ごとに1日1回点滴静脈内投与。 1週間間隔投与法において、 12週目までの忍容性が良好な場合、 1回1,250mg/m²に増量可。 さらに18週目までの忍容性が認められる場合、 最大1回1,500mg/m²まで増量可。
腎毒性を軽減するために輸液を行い、 尿量確保に注意する。 1回量を30分~2時間かけて点滴静脈内投与する。
ザノサー®電子添文 (2023年7月改訂 第1版) より作図
各プロトコル
投与開始基準
適正使用ガイド²⁾の記載例

ザノサー®適正使用ガイド (2023年7月作成) より作図
減量・休薬・中止基準
電子添文¹⁾の記載例
<5日間連日投与法>

ザノサー®電子添文 (2023年7月改訂 第1版) より作図
<1週間間隔投与法>

ザノサー®電子添文 (2023年7月改訂 第1版) より作図
主な有害事象
試験詳細については「臨床試験」の項目を参照ください。
全体での主な有害事象 (カッコ内はGrade3~4)
- 悪心 21.1% (0%)
- 食欲減退 23.3% (2.2 %)
- 倦怠感 28.9% (0%)
- 便秘 30.0% (0%)
- 血液学的副作用 11.1% (0%)


※Daily併用療法のレジメン
day1、day22にドキソルビシン(DXR)
またはday1~5に5-FU 400mg/m²を併用投与
※Weekly併用療法のレジメン
day1からS-1 80mg/m²を隔日に併用投与
ソマトスタチンアナログは併用薬として扱わなかった。 治療期間中に何人かの被験者はレジメンや併用薬剤を変更したが、 その場合には、 最適な結果に至る前に長く投与した方法を主な投与方法とした。 なお、ザノサー®点滴静注用1g は、 他の抗悪性腫瘍剤との併用は『併用注意』となっております。
特徴と注意点
- ストレプトゾシンはアルキル化剤のニトロソウレア系に属する抗がん薬で、 グルコーストランスポーターを介して細胞内に取り込まれ、 DNAをアルキル化し、 DNAの合成を阻害することで腫瘍増殖を抑制する。
- ストレプトゾシンは海外では古くから使われており、 いくつかのランダム化比較試験が行われているが、 いずれも古いものであり、 十分なエビデンスがあるとは言いがたい。 また、 ほとんどの報告が5-FU等との併用であり、 単剤の報告は少ない。
- 日本ではストレプトゾシン単剤 (daily投与またはweekly投与) の第I/II相試験⁴⁾で有効性と安全性が評価され、 2015年に使用可能となった。
- 膵・消化管神経内分泌腫瘍診療ガイドライン第2版³⁾では、 膵NETに対してはグレードB、 消化管NETに対してはソマトスタチンアナログやエベロリムスの適応とならない場合の選択肢 (グレードC) に位置づけられている。
- 有害事象として、 悪心、 疲労などがあげられる。 また、 注意を有する副作用として耐糖能障害、 腎機能障害、 肝機能障害などがある。 催吐性リスク分類では高度リスクに分類されるため、 十分な制吐療法が必要である。 また、 腎機能障害の予防として投与前後にハイドレーションを行い、 尿量を確保する。 国内第I/II相試験¹⁾の際には、 投与前後でそれぞれ1,000~2,000mLの輸液が投与されていた。
臨床試験 : 本邦多施設共同研究⁴⁾
本研究は、 進行膵神経内分泌腫瘍に対するSTZのWeeklyレジメンおよび単剤療法の効果の評価、 効果予測因子の探索を目的として実施された。 対象は日本国内の25施設で、 進行膵神経内分泌腫瘍に対してSTZを投与した患者110例で、 臨床データをレトロスペクティブに収集し (2015年2月~2017年3月)、 治療効果や安全性、 無増悪生存期間 (PFS)、 効果予測因子などを分析した
ザノサー®点滴静注用1g は、 他の抗悪性腫瘍剤との併用は『併用注意』となっております。
Cancer Chemother Pharmacol. 2018 Oct;82(4):661-668. PMID: 30054710
奏効率
全症例の結果は以下のとおりであった
・ ORR : 21.8%
OPR : objective response rate
・ DCR : 70.0%
DCR : disease control rate
・ PFS : 9.8ヵ月 [95%CI 5.9-13.3]
Daily・Weeklyレジメンで有意差を認めなかった
・ DailyレジメンのOPR : 22.0%
・ WeeklyレジメンのORR : 21.6%
(P=1.000、 Fisher’s exact test)
併用・単剤療法で有意差を認めなかった
・ 併用療法のORR : 25.0%
・ 単剤療法のORR : 21.1%
(P=0.766、 Fisher’s exact test)
腫瘍分類別は NET-G2で最も高い効果であった
・ NET-G2のOPR : 23.0%
・ NET-G1+G2のORR : 22.7%
・ NET-G3のORR : 18.2%
奏効率と効果予測因子
腫瘍縮小効果の唯一の関連因子として、 単変量・多変量解析ともにKi-67指数>5%が挙げられた
・ Ki-67指数>5%のOPR : 31.3%
・ Ki-67指数≦5%のOPR : 9.3%
(P=0.017、 ロジスティック回帰分析)
出典
- ノーベルファーマ株式会社. ザノサー®電子添文 (2023年7月改訂 第1版) [最終閲覧 : 2025/1/4]
- ノーベルファーマ株式会社. ザノサー®適正使用ガイド (2023年7月作成) [最終閲覧 : 2025/1/4]
- 膵・消化管NEN診療ガイドライン第二版. 日本神経内分泌腫瘍研究会
- Multi-center clinical evaluation of streptozocin-based chemotherapy for advanced pancreatic neuroendocrine tumors in Japan: focus on weekly regimens and monotherapy. Cancer Chemother Pharmacol. 2018 Oct;82(4):661-668. PMID: 30054710
最終更新日 : 2025年1月4日
執筆医 : 香川大学医学部附属病院 腫瘍内科 講師 奥山浩之先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。