Lenvatinib:レンバチニブ(レンビマ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| ≧60kg 12mg/日 分1経口 | 連日服用 | Day1 |
| <60kg 8mg/日 分1経口 | 連日服用 | Day1 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
用法用量
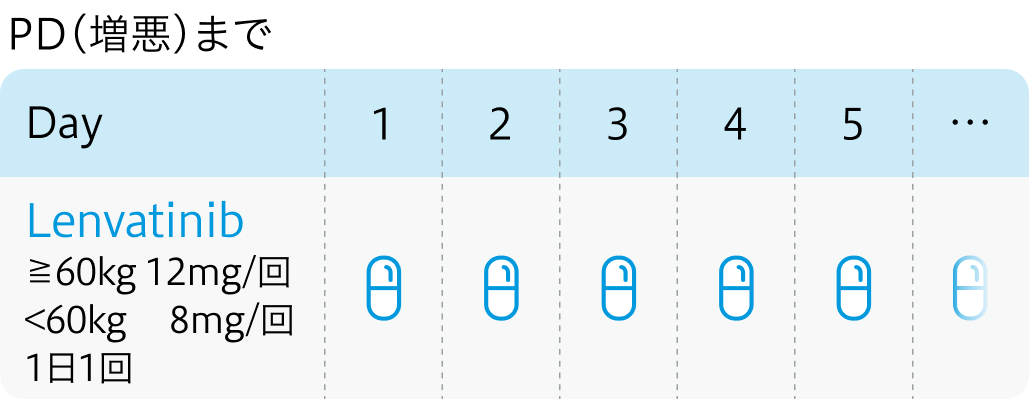
投与開始基準¹⁾
20歳以上の組織・細胞診断、 もしくはMRI等の画像診断により典型的な肝細胞癌と診断されたPSが0、 1でChild-Pugh score≦6の患者
減量・休薬・中止基準
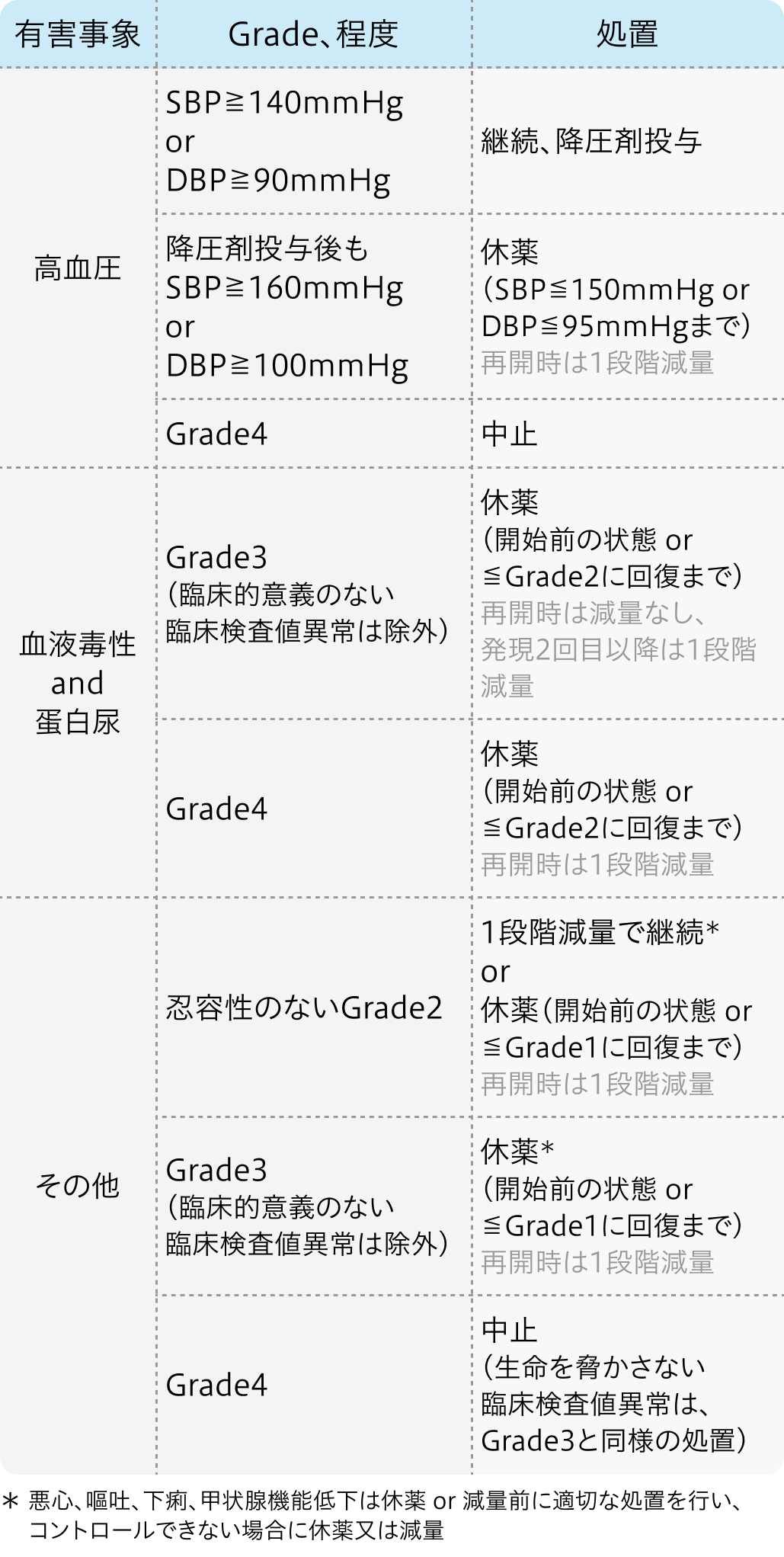
初回基準量と減量レベル
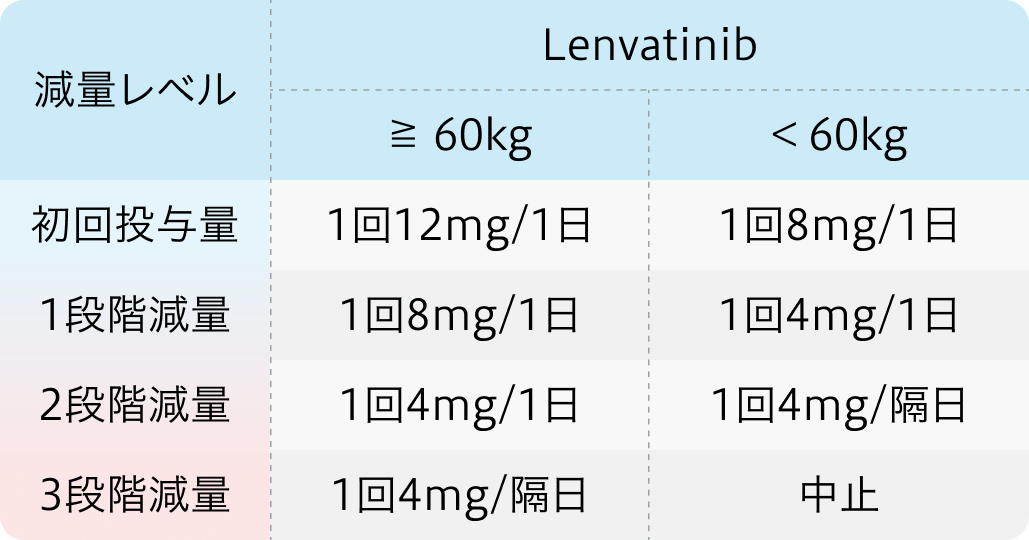
主な有害事象
TACTICSーL試験¹⁾
有害事象データを一部引用
主な有害事象
甲状腺機能低下症 (58.1%)
高血圧 (53.2%)
食欲減退 (50.0%)
疲労 (48.4%)
上手に使うためのワンポイント
継続投与のためのポイント
高血圧、食欲減退、甲状腺機能低下症などの有害事象のマネジメントが重要
TACTICS-L試験について¹⁾
TACTICS-L試験はTACEとレンバチニブ併用療法の有効性と安全性について検討することを目的とされた。 奏効率88.7%と良好な成績が得られ、 安全性については、 レンバチニブ特有の有害事象は認めたがTACE併用による新たな有害事象の報告はなかった。
初回TACEの14~21日前にレンバチニブを開始し、 TACEの前後2日間は投与が中断された。 レンバチニブ、 TACEの有害事象によっては、 スケジュール通りに治療を実施できない可能性もあり、 病状に応じた治療スケジュールの調整が必要である。
特徴と注意点
TACEにレンバチニブを併用することで、 レンバチニブによる治療効果の他に、 drug deliveryの改善、 TACE後の低酸素誘導因子の抑制により治療効果を高めることが特徴とされている。 TACE単独では効果が期待できない病態 (TACE不適) に対しても良好な治療成績が期待されている。
関連する臨床試験
TACTICSーL試験¹⁾
uHCC患者におけるTACEとレンバチニブの併用の安全性と有効性を評価することを目的とした第Ⅱ相試験。 主要評価項目は無増悪生存期間 (PFS)、 副次評価項目は治療不能な進行までの時間 (TTUP)、 奏効率 (ORR) 、 全生存期間 (OS) 、 安全性とされた。
Journal of Clinical Oncology 40, no. 4_suppl (February 01, 2022) 417-417.
出典
最終更新日:2023年6月23日
執筆医:神奈川県立がんセンター 消化器内科 福島 泰斗先生
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
TACE+Lenvatinib
Lenvatinib:レンバチニブ(レンビマ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| ≧60kg 12mg/日 分1経口 | 連日服用 | Day1 |
| <60kg 8mg/日 分1経口 | 連日服用 | Day1 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
用法用量

投与開始基準¹⁾
20歳以上の組織・細胞診断、 もしくはMRI等の画像診断により典型的な肝細胞癌と診断されたPSが0、 1でChild-Pugh score≦6の患者
減量・休薬・中止基準

初回基準量と減量レベル

主な有害事象
TACTICSーL試験¹⁾
有害事象データを一部引用
主な有害事象
甲状腺機能低下症 (58.1%)
高血圧 (53.2%)
食欲減退 (50.0%)
疲労 (48.4%)
上手に使うためのワンポイント
継続投与のためのポイント
高血圧、食欲減退、甲状腺機能低下症などの有害事象のマネジメントが重要
TACTICS-L試験について¹⁾
TACTICS-L試験はTACEとレンバチニブ併用療法の有効性と安全性について検討することを目的とされた。 奏効率88.7%と良好な成績が得られ、 安全性については、 レンバチニブ特有の有害事象は認めたがTACE併用による新たな有害事象の報告はなかった。
初回TACEの14~21日前にレンバチニブを開始し、 TACEの前後2日間は投与が中断された。 レンバチニブ、 TACEの有害事象によっては、 スケジュール通りに治療を実施できない可能性もあり、 病状に応じた治療スケジュールの調整が必要である。
特徴と注意点
TACEにレンバチニブを併用することで、 レンバチニブによる治療効果の他に、 drug deliveryの改善、 TACE後の低酸素誘導因子の抑制により治療効果を高めることが特徴とされている。 TACE単独では効果が期待できない病態 (TACE不適) に対しても良好な治療成績が期待されている。
関連する臨床試験
TACTICSーL試験¹⁾
uHCC患者におけるTACEとレンバチニブの併用の安全性と有効性を評価することを目的とした第Ⅱ相試験。 主要評価項目は無増悪生存期間 (PFS)、 副次評価項目は治療不能な進行までの時間 (TTUP)、 奏効率 (ORR) 、 全生存期間 (OS) 、 安全性とされた。
Journal of Clinical Oncology 40, no. 4_suppl (February 01, 2022) 417-417.
出典
最終更新日:2023年6月23日
執筆医:神奈川県立がんセンター 消化器内科 福島 泰斗先生
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
