本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ダカルバジン (添付文書¹⁾)
抗悪性腫瘍薬 > アルキル化薬
用法用量
国際的には「1000mg/m² 1回投与」が標準治療
※適応外、承認外使用を推奨するものではありません。
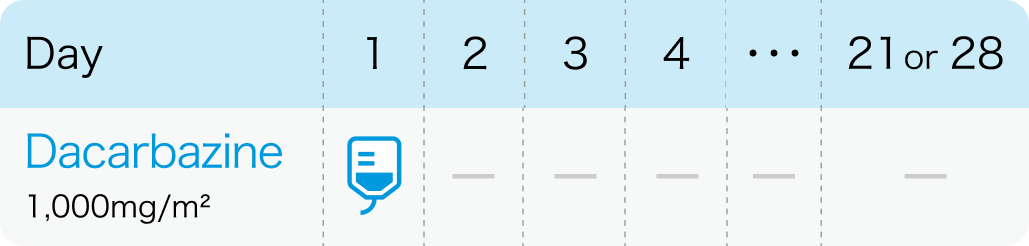
添付文書記載は下記のとおり100~200mg 5日間投与となっているが、国際的には1000mg/m² 1回 3~4週間隔投与が標準治療である。 なお、 全身状態を考慮し、 20%程度減量することがある。
監修 : 国立がん研究センター中央 皮膚腫瘍科長 山崎直也先生
電子添文¹⁾、国内第II相試験の用法および用量
100~200mgを5日間投与し、以後約4週間休薬
ダカルバジン®電子添文 (2023年8月改訂 第1版)¹⁾引用
投与開始基準
国際第Ⅲ相試験³⁾のプロトコル

New Engl J Med. 2015 Jan 22;372(4):320-30³⁾より作図
主な有害事象
国際第Ⅲ相試験³⁾の結果
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 14.6% (1.0%)
- そう痒症 5.4% (0%)
- 悪心 41.5% (0%)
- 下痢 15.6% (0.5%)
- 発疹 2.9% (0%)
- 白斑 0.5% (0%)
- 便秘 12.2% (0%)
- 無力症 12.2% (0.5%)
- 嘔吐 21.0% (0.5%)
- 好中球数減少 11.2% (4.4%)
- 血小板数減少 10.2% (4.9%)
New Engl J Med. 2015 Jan 22;372(4):320-30³⁾より引用
エキスパートによるワンポイント
ニボルマブ承認まで唯一の全身薬物療法
悪性黒色腫の治療薬として、 2014年にニボルマブが承認されるまで30年以上にわたって唯一の全身薬物療法薬として広く使われてきた。
ダカルバジンの投与方法と減量基準
本邦添付文書の記載だが...
国内第II相試験²⁾の結果に従い、 成人にはダカルバジンとして、 1回100-200mgを5日間連日静脈内投与し、 以後4週間休薬する。 これを1コースとし繰り返し投与する。 なお年齢、 症状により適宜増減する。

減量基準はなく、 ホルモン補充療法でコントロール可能な内分泌関連の免疫関連有害事象を除き、 Grade3以上またはGradeに関わらず致死的になり得る場合には中止する。
国際的には1000mg/m² 1回投与
ただし、 国際的には1000mg/m² 1回 3~4週間隔投与が標準治療であり、 最近は日本でもこの方法で行われることがほとんどである。 全身状態を考慮して20%程度減量することがある。

臨床試験の結果
1980年代に悪性黒色腫を対象に、 ダカルバジンの単独投与レジメン (1回100-200mg/dayを5日間連日静脈内投与し、 3-5週程度の間隔で反復投与する) を評価する国内第II相試験が行われた²⁾。 悪性黒色腫52名に対し、 当時の効果判定基準で全体の奏効割合は24.2%であった。
近年開発が行われている免疫チェックポイント阻害薬、 分子標的薬の第III相試験の多くでダカルバジンが対照群として用いられている。 その投与法は薬物治療の前治療歴のない患者に対してダカルバジン1000mg/m²を3週間隔投与するものであり奏効割合は5-14%、 無増悪期間の中央値は1.6-2.7ヵ月であった³⁾⁴⁾⁵⁾。
主な副作用とその対策
主な副作用には、 悪心・嘔吐・食欲不振、 全身倦怠感、 骨髄抑制、 肝機能障害、 血管痛、 光線過敏省などが挙げられる。
悪心・嘔吐について
悪心・嘔吐は投与当日の急性嘔吐が主体であり、 5-HT₃受容体拮抗薬やステロイド内服薬または静脈内への前投与で予防できることが多い。
骨髄抑制について
骨髄抑制は多くがGrade 0-2にとどまる。 ただし、 高齢者や放射線治療併用例などは注意が必要である。
血管痛について
血管痛はダカルバジンの光分解物質によって生じるため投与にあたっては遮光を徹底する。
出典
- サンドファーマ株式会社. ダカルバジン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/04/03]
- 悪性黒色腫に対するdacarbazine(DTIC)の第II相試験. 癌と化学療法 13 (5) 1940-1945, 1986
- Nivolumab in previously untreated melanoma without BRAF mutation. Engl J Med. 2015 Jan 22;372(4):320-30. PMID: 25399552
- Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014 Mar;15(3):323-32. PMID: 24508103
- Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet. 2012 Jul 28;380(9839):358-65. PMID: 22735384
最終更新日 : 2024年7月29日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
DTIC単剤
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ダカルバジン (添付文書¹⁾)
抗悪性腫瘍薬 > アルキル化薬
用法用量
国際的には「1000mg/m² 1回投与」が標準治療
※適応外、承認外使用を推奨するものではありません。

添付文書記載は下記のとおり100~200mg 5日間投与となっているが、国際的には1000mg/m² 1回 3~4週間隔投与が標準治療である。 なお、 全身状態を考慮し、 20%程度減量することがある。
監修 : 国立がん研究センター中央 皮膚腫瘍科長 山崎直也先生
電子添文¹⁾、国内第II相試験の用法および用量
100~200mgを5日間投与し、以後約4週間休薬
ダカルバジン®電子添文 (2023年8月改訂 第1版)¹⁾引用
投与開始基準
国際第Ⅲ相試験³⁾のプロトコル

New Engl J Med. 2015 Jan 22;372(4):320-30³⁾より作図
主な有害事象
国際第Ⅲ相試験³⁾の結果
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 14.6% (1.0%)
- そう痒症 5.4% (0%)
- 悪心 41.5% (0%)
- 下痢 15.6% (0.5%)
- 発疹 2.9% (0%)
- 白斑 0.5% (0%)
- 便秘 12.2% (0%)
- 無力症 12.2% (0.5%)
- 嘔吐 21.0% (0.5%)
- 好中球数減少 11.2% (4.4%)
- 血小板数減少 10.2% (4.9%)
New Engl J Med. 2015 Jan 22;372(4):320-30³⁾より引用
エキスパートによるワンポイント
ニボルマブ承認まで唯一の全身薬物療法
悪性黒色腫の治療薬として、 2014年にニボルマブが承認されるまで30年以上にわたって唯一の全身薬物療法薬として広く使われてきた。
ダカルバジンの投与方法と減量基準
本邦添付文書の記載だが...
国内第II相試験²⁾の結果に従い、 成人にはダカルバジンとして、 1回100-200mgを5日間連日静脈内投与し、 以後4週間休薬する。 これを1コースとし繰り返し投与する。 なお年齢、 症状により適宜増減する。

減量基準はなく、 ホルモン補充療法でコントロール可能な内分泌関連の免疫関連有害事象を除き、 Grade3以上またはGradeに関わらず致死的になり得る場合には中止する。
国際的には1000mg/m² 1回投与
ただし、 国際的には1000mg/m² 1回 3~4週間隔投与が標準治療であり、 最近は日本でもこの方法で行われることがほとんどである。 全身状態を考慮して20%程度減量することがある。

臨床試験の結果
1980年代に悪性黒色腫を対象に、 ダカルバジンの単独投与レジメン (1回100-200mg/dayを5日間連日静脈内投与し、 3-5週程度の間隔で反復投与する) を評価する国内第II相試験が行われた²⁾。 悪性黒色腫52名に対し、 当時の効果判定基準で全体の奏効割合は24.2%であった。
近年開発が行われている免疫チェックポイント阻害薬、 分子標的薬の第III相試験の多くでダカルバジンが対照群として用いられている。 その投与法は薬物治療の前治療歴のない患者に対してダカルバジン1000mg/m²を3週間隔投与するものであり奏効割合は5-14%、 無増悪期間の中央値は1.6-2.7ヵ月であった³⁾⁴⁾⁵⁾。
主な副作用とその対策
主な副作用には、 悪心・嘔吐・食欲不振、 全身倦怠感、 骨髄抑制、 肝機能障害、 血管痛、 光線過敏省などが挙げられる。
悪心・嘔吐について
悪心・嘔吐は投与当日の急性嘔吐が主体であり、 5-HT₃受容体拮抗薬やステロイド内服薬または静脈内への前投与で予防できることが多い。
骨髄抑制について
骨髄抑制は多くがGrade 0-2にとどまる。 ただし、 高齢者や放射線治療併用例などは注意が必要である。
血管痛について
血管痛はダカルバジンの光分解物質によって生じるため投与にあたっては遮光を徹底する。
出典
- サンドファーマ株式会社. ダカルバジン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/04/03]
- 悪性黒色腫に対するdacarbazine(DTIC)の第II相試験. 癌と化学療法 13 (5) 1940-1945, 1986
- Nivolumab in previously untreated melanoma without BRAF mutation. Engl J Med. 2015 Jan 22;372(4):320-30. PMID: 25399552
- Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014 Mar;15(3):323-32. PMID: 24508103
- Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet. 2012 Jul 28;380(9839):358-65. PMID: 22735384
最終更新日 : 2024年7月29日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。