本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 軽度催吐性
*日本イーライリリーの外部サイトへ遷移します
>> GEM + BVはこちら
用法用量
国際第III相試験³⁾のプロトコル
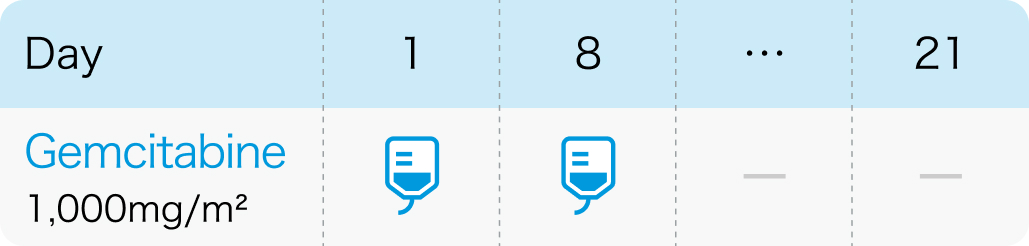
J Clin Oncol. 2007 Jul 1;25(19):2811-8³⁾より作図
電子添文¹⁾の用法および用量
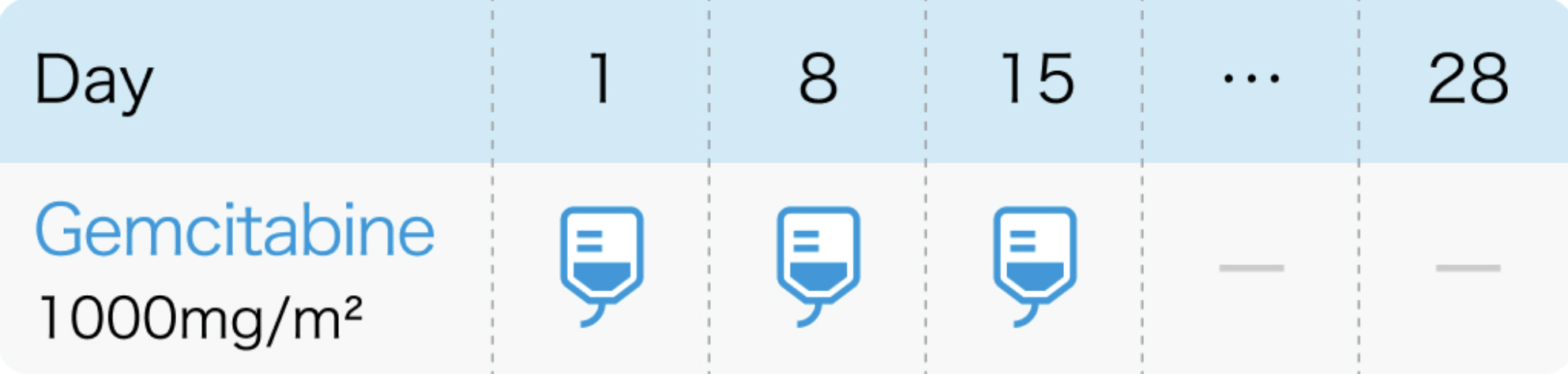
ジェムザール®電子添文 (2021年8月改訂 第1版)¹⁾より作図
1回1000mg/m²を30分かけて点滴静注し、 週1回投与を3週連続し、 4週目は休薬
ジェムザール®電子添文 (2021年8月改訂 第1版)¹⁾より引用
投与開始基準
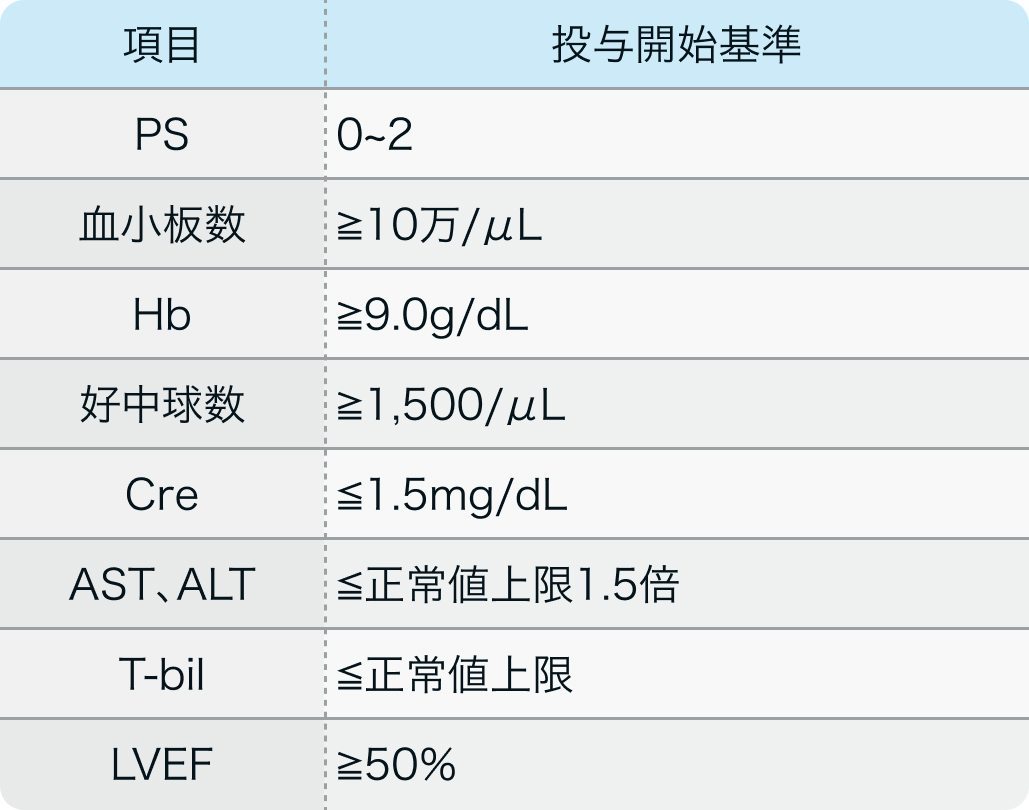
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生 提供
KeyData|臨床試験結果
国際第III相試験³⁾
対象: プラチナ抵抗性卵巣癌患者195例
方法: GEM群 vs PLD群
【有効性】GEM群
- ORR 6.1%
- mPFS 3.6ヵ月
- mOS 12.7ヵ月
【安全性】主な有害事象 (カッコ内 Grade3~4)
- 下痢 5.1% (1.0%)
- 便秘 25.3% (3.0%)
- 倦怠感 36.4% (11.1%)
- 悪心/嘔吐 28.3% (12.1%)
- 粘膜炎 3.0% (1.0%)
- 好中球数減少 38.4%*
- 血小板数減少 6.1%*
- 貧血 3.0%*
- 発熱性好中球数減少 4.0%*
*Grade3~4のみの値
J Clin Oncol. 2007 Jul 1;25(19):2811-8³⁾より引用
エキスパートによるワンポイント
プラチナ抵抗性再発卵巣がんの選択肢
プラチナ抵抗性再発卵巣がん患者に対するリポソーマルドキソルビシン (PLD)と比較したこのランダム化比較試験では、 RR (奏効率) は、 6.1% (GEM)、 8.3% (PLD)、 PFS (無増悪生存期間) は、 3.6ヵ月 (GEM)、 3.1ヵ月 (PLD)と有意差はありませんでした。
副作用と治療選択における患者との協議
GEMの副作用は、 骨髄毒性が主なものであり、 非血液毒性は比較的マイルドで、 外来投与しやすいです。 プラチナ抵抗性再発卵巣がんに対する、 レジメンは、 PLDをはじめ複数存在しますが、 どのレジメンが最もよいのかは、 結論が得られていません。
また、 BSC (Best supportive care)との比較も行われていませんので、 プラチナ抵抗性再発卵巣がんに対して、 化学療法を行うことのベネフィットも示されていないとも言えます。
プラチナ抵抗性再発卵巣がん患者さんに、 どのレジメンを使用するかは、 副作用のプロファイル、 投与スケジュールなどを考慮して、 患者さんと相談しながら、 考えていくのがよいと思います。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- 日本イーライリリー. ジェムザール®電子添文 (2021年8月改訂 第1版) [最終閲覧 : 2024/03/19]
- 日本イーライリリー. ジェムザール®適正使用ガイド (2021年10月作成) [最終閲覧 : 2024/03/19]
- Randomized phase III trial of gemcitabine compared with pegylated liposomal doxorubicin in patients with platinum-resistant ovarian cancer. J Clin Oncol. 2007 Jul 1;25(19):2811-8. PMID: 17602086
最終更新日 : 2024年7月23日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
Gemcitabine
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 軽度催吐性
*日本イーライリリーの外部サイトへ遷移します
>> GEM + BVはこちら
用法用量
国際第III相試験³⁾のプロトコル

J Clin Oncol. 2007 Jul 1;25(19):2811-8³⁾より作図
電子添文¹⁾の用法および用量

ジェムザール®電子添文 (2021年8月改訂 第1版)¹⁾より作図
1回1000mg/m²を30分かけて点滴静注し、 週1回投与を3週連続し、 4週目は休薬
ジェムザール®電子添文 (2021年8月改訂 第1版)¹⁾より引用
投与開始基準

日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生 提供
KeyData|臨床試験結果
国際第III相試験³⁾
対象: プラチナ抵抗性卵巣癌患者195例
方法: GEM群 vs PLD群
【有効性】GEM群
- ORR 6.1%
- mPFS 3.6ヵ月
- mOS 12.7ヵ月
【安全性】主な有害事象 (カッコ内 Grade3~4)
- 下痢 5.1% (1.0%)
- 便秘 25.3% (3.0%)
- 倦怠感 36.4% (11.1%)
- 悪心/嘔吐 28.3% (12.1%)
- 粘膜炎 3.0% (1.0%)
- 好中球数減少 38.4%*
- 血小板数減少 6.1%*
- 貧血 3.0%*
- 発熱性好中球数減少 4.0%*
*Grade3~4のみの値
J Clin Oncol. 2007 Jul 1;25(19):2811-8³⁾より引用
エキスパートによるワンポイント
プラチナ抵抗性再発卵巣がんの選択肢
プラチナ抵抗性再発卵巣がん患者に対するリポソーマルドキソルビシン (PLD)と比較したこのランダム化比較試験では、 RR (奏効率) は、 6.1% (GEM)、 8.3% (PLD)、 PFS (無増悪生存期間) は、 3.6ヵ月 (GEM)、 3.1ヵ月 (PLD)と有意差はありませんでした。
副作用と治療選択における患者との協議
GEMの副作用は、 骨髄毒性が主なものであり、 非血液毒性は比較的マイルドで、 外来投与しやすいです。 プラチナ抵抗性再発卵巣がんに対する、 レジメンは、 PLDをはじめ複数存在しますが、 どのレジメンが最もよいのかは、 結論が得られていません。
また、 BSC (Best supportive care)との比較も行われていませんので、 プラチナ抵抗性再発卵巣がんに対して、 化学療法を行うことのベネフィットも示されていないとも言えます。
プラチナ抵抗性再発卵巣がん患者さんに、 どのレジメンを使用するかは、 副作用のプロファイル、 投与スケジュールなどを考慮して、 患者さんと相談しながら、 考えていくのがよいと思います。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- 日本イーライリリー. ジェムザール®電子添文 (2021年8月改訂 第1版) [最終閲覧 : 2024/03/19]
- 日本イーライリリー. ジェムザール®適正使用ガイド (2021年10月作成) [最終閲覧 : 2024/03/19]
- Randomized phase III trial of gemcitabine compared with pegylated liposomal doxorubicin in patients with platinum-resistant ovarian cancer. J Clin Oncol. 2007 Jul 1;25(19):2811-8. PMID: 17602086
最終更新日 : 2024年7月23日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。