本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヌクレオチド除去修復機構阻害薬 トラベクテジン
*大鵬薬品工業株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
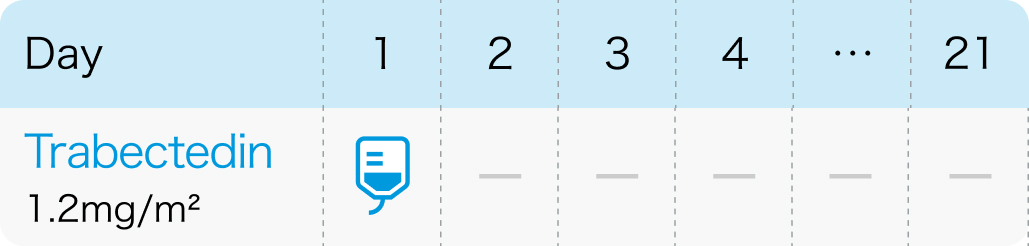
1回1.2mg/m² (体表面積) を24時間かけて点滴静注し、 少なくとも20日間休薬¹⁾
他の抗悪性腫瘍剤との併用について、 有効性および安全性は確立していない¹⁾
薬液が漏出した場合、 重度の組織障害を起こすおそれがあるので、 中心静脈から投与すること¹⁾
ヨンデリス®電子添文 (2024年6月改訂第2版)¹⁾より作図、 引用
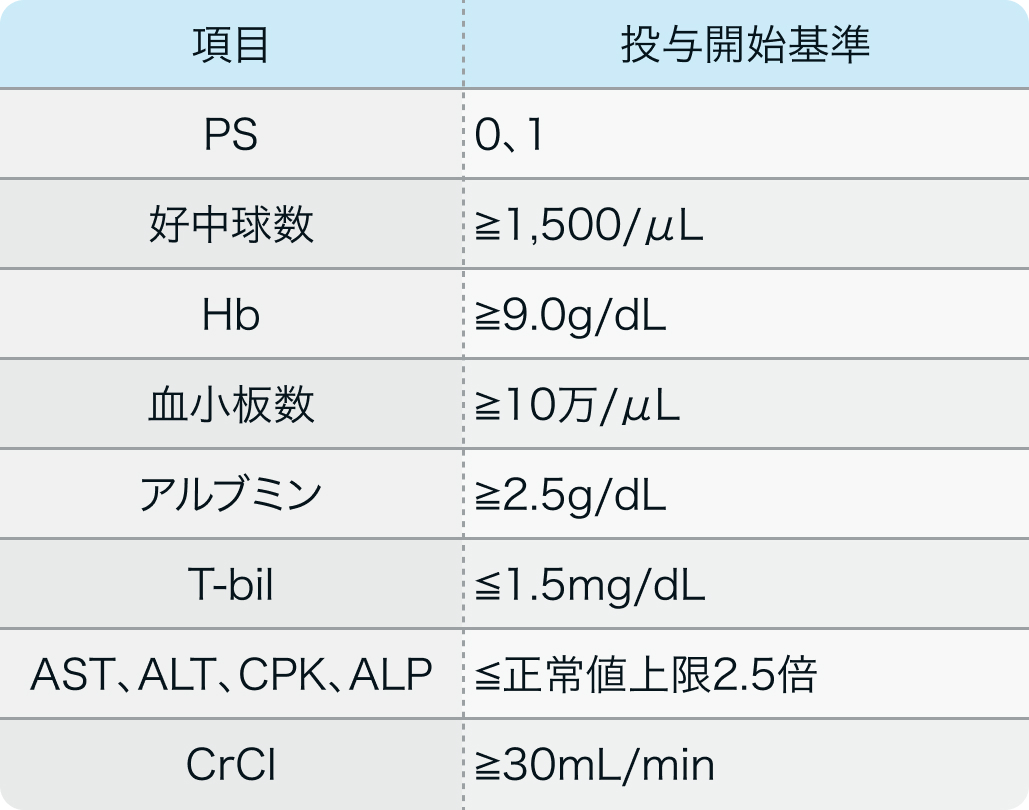
投与開始基準
国内第Ⅱ相試験³⁾のプロトコル
Lancet Oncol. 2015 Apr;16(4):406-16³⁾より作図
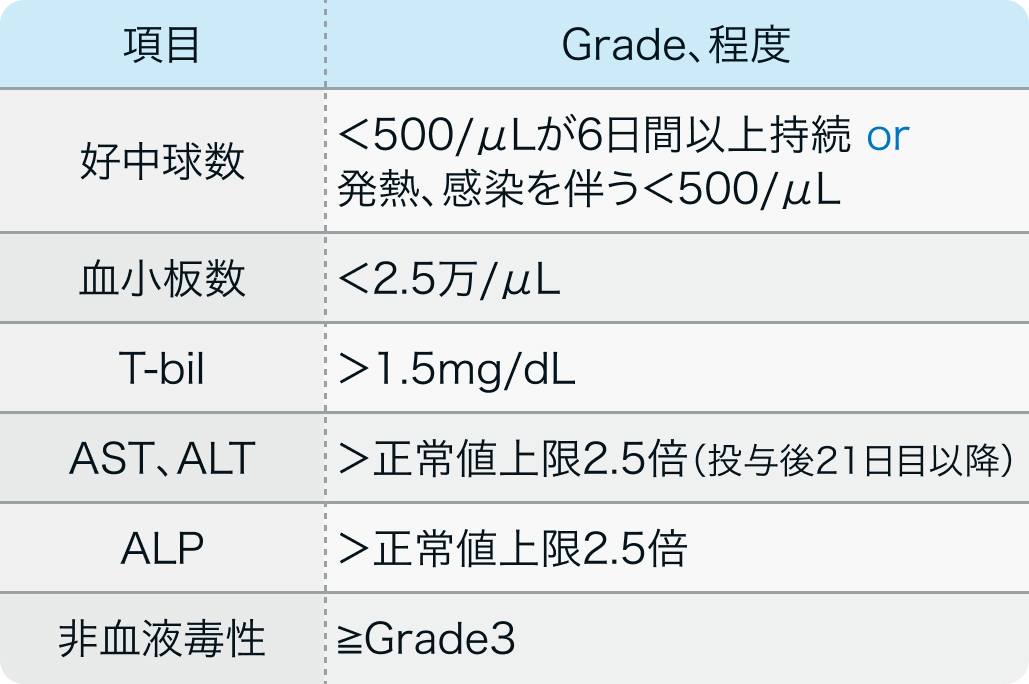
減量基準
電子添文¹⁾の減量基準
1段階ごとに減量、 最低投与量は0.8mg/m²
ヨンデリス®電子添文 (2024年6月改訂第2版)¹⁾より作図
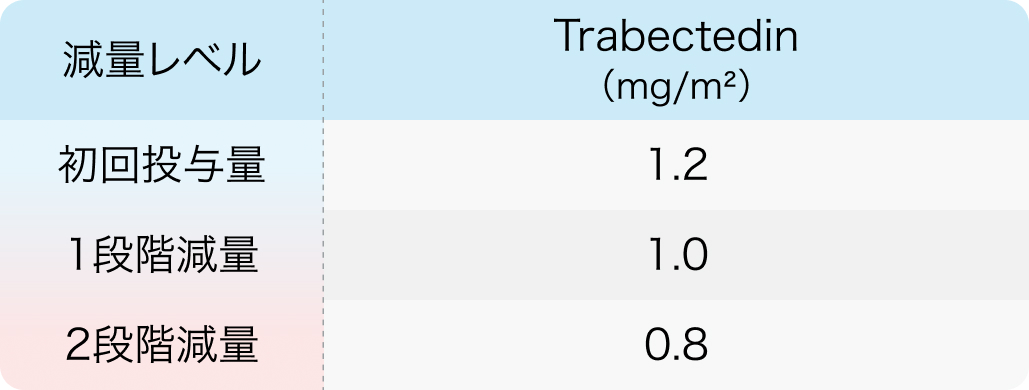
初回基準量と減量レベル
ヨンデリス®電子添文 (2024年6月改訂第2版)¹⁾より作図
主な有害事象
国内第Ⅱ相試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 悪心 88.9% (8.3%)
- 食欲減退 58.3% (8.3%)
- 便秘 58.3% (0%)
- 倦怠感 44.4% (0%)
- 嘔吐 41.7% (0%)
- 貧血 30.6% (19.4%)
- 筋肉痛 27.8% (0%)
- 発熱 25.0% (0%)
- 下痢 22.2% (2.8%)
- 疲労 19.4% (2.8%)
- 頭痛 16.7% (0%)
- 口内炎 16.7 % (0%)
- 不眠症 13.9% (0%)
- 発熱性好中球減少症 13.9% (13.9%)
- 末梢浮腫 13.9% (0%)
- 味覚異常 13.9% (0%)
- 咽頭炎 11.1% (0%)
- インプラント部位の痛み 11.1% (0%)
- 腫瘍痛 8.3% (2.8%)
- 高血糖 8.3% (8.3%)
- 腸閉塞 2.8% (0%)
- 呼吸困難 2.8% (2.8%)
- 食中毒 2.8% (2.8%)
- 亜腸閉塞 2.8% (2.8%)
- 肺炎 2.8% (2.8%)
- 低カリウム血症 2.8% (2.8%)
- 横紋筋融解症 2.8% (2.8%)
- 低酸素症 2.8% (2.8%)
- 好中球数減少 83.3% (66.7%)
- ALT増加 66.7% (61.1%)
- 白血球数減少 55.6% (55.6%)
- AST増加 47.2% (41.7%)
- 血小板数減少 36.1% (16.7%)
- γグルタミルトランスフェラーゼ増加 27.8% (25.0%)
- リンパ球数減少 22.2% (22.2 %)
- クレアチンホスホキナーゼ増加 16.7% (5.6%)
- ビリルビン増加 11.1% (0%)
- ALP増加 8.3% (5.6%)
- QT延長 5.6% (2.8%)
- コレステロール増加 2.8% (2.8%)
Lancet Oncol. 2015 Apr;16(4):406-16³⁾より引用
エキスパートによるワンポイント
2次治療以降の選択肢に
化学療法後に病勢進行が認められた進行または再発悪性軟部腫瘍患者を対象にしたベストサポーティブケアに対する国内第Ⅱ相試験³⁾において、 優越性を示して2015年に保険適用となった。
パクリタキセル使用後の2次治療の候補としては、 他にドセタキセル、 エリブリン、 パゾパニブ等があるが、 これらの比較試験は存在せず患者の状態や既往歴、 合併症および薬剤の特性などから治療薬を選択する。 なお、 化学療法未治療例における有効性及び安全性は確立しておらず1次治療としては推奨されない。
0.2mg/m²ずつ減量
トラベクテジン1回1.2mg/m² (体表面積) を24時間かけて中心静脈からの点滴投与する。 少なくとも20日休薬し、 これを1サイクルとして繰り返す。
Grade3以上の副作用が90%以上にみられるため、 投与開始や減量については電子添文に従って判断する。 減量は0.2mg/m²ずつ行い、 0.8mg/m²を最低投与量とする。
静脈炎等の副作用に注意
末梢静脈からの投与では高頻度に静脈炎を認めたことや、 薬液が血管外に漏出すると漏出部の組織障害、 壊死を起こすことも知られている。 また副作用として横紋筋融解や心機能障害も報告されている。
血液毒性、 肝機能障害、 腎機能障害、 クレアチンホスホキナーゼ増加などを確認してから投与開始する。
血液検査でクレアチニンホスホキナーゼの値や筋肉痛などの症状の有無、 心エコーなどでの心機能の確認も必要である。
無増悪生存期間を改善
国内第Ⅱ相試験³⁾は既治療の悪性軟部腫瘍患者に対してベストサポーティブケアとのランダム化比較試験であり、 37人のトラベクテジン投与患者において無増悪生存期間中央値が5.6ヵ月と、 36人のベストサポーティブケアでは同0.9ヵ月に対して有意な改善を認めた。 ただし、 この試験には血管肉腫患者は含まれておらず、 血管肉腫に対する有効性と安全性は今後の検証が必要である。
有害事象としては悪心、 食欲低下、 好中球減少、 ALT上昇が高頻度で見られた。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
出典
- 大鵬薬品工業株式会社. ヨンデリス®電子添文 (2024年6月改訂第2版) [最終閲覧 : 2024/07/1]
- 大鵬薬品工業株式会社. ヨンデリス®適正使用ガイド [最終閲覧 : 2024/04/17]
- Trabectedin monotherapy after standard chemotherapy versus best supportive care in patients with advanced, translocation-related sarcoma: a randomised, open-label, phase 2 study. Lancet Oncol. 2015 Apr;16(4):406-16. PMID: 25795406
最終更新日 : 2024年7月1日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
Trabectedin
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヌクレオチド除去修復機構阻害薬 トラベクテジン
*大鵬薬品工業株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量

1回1.2mg/m² (体表面積) を24時間かけて点滴静注し、 少なくとも20日間休薬¹⁾
他の抗悪性腫瘍剤との併用について、 有効性および安全性は確立していない¹⁾
薬液が漏出した場合、 重度の組織障害を起こすおそれがあるので、 中心静脈から投与すること¹⁾
ヨンデリス®電子添文 (2024年6月改訂第2版)¹⁾より作図、 引用
投与開始基準
国内第Ⅱ相試験³⁾のプロトコル

Lancet Oncol. 2015 Apr;16(4):406-16³⁾より作図
減量基準
電子添文¹⁾の減量基準
1段階ごとに減量、 最低投与量は0.8mg/m²

ヨンデリス®電子添文 (2024年6月改訂第2版)¹⁾より作図
初回基準量と減量レベル

ヨンデリス®電子添文 (2024年6月改訂第2版)¹⁾より作図
主な有害事象
国内第Ⅱ相試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 悪心 88.9% (8.3%)
- 食欲減退 58.3% (8.3%)
- 便秘 58.3% (0%)
- 倦怠感 44.4% (0%)
- 嘔吐 41.7% (0%)
- 貧血 30.6% (19.4%)
- 筋肉痛 27.8% (0%)
- 発熱 25.0% (0%)
- 下痢 22.2% (2.8%)
- 疲労 19.4% (2.8%)
- 頭痛 16.7% (0%)
- 口内炎 16.7 % (0%)
- 不眠症 13.9% (0%)
- 発熱性好中球減少症 13.9% (13.9%)
- 末梢浮腫 13.9% (0%)
- 味覚異常 13.9% (0%)
- 咽頭炎 11.1% (0%)
- インプラント部位の痛み 11.1% (0%)
- 腫瘍痛 8.3% (2.8%)
- 高血糖 8.3% (8.3%)
- 腸閉塞 2.8% (0%)
- 呼吸困難 2.8% (2.8%)
- 食中毒 2.8% (2.8%)
- 亜腸閉塞 2.8% (2.8%)
- 肺炎 2.8% (2.8%)
- 低カリウム血症 2.8% (2.8%)
- 横紋筋融解症 2.8% (2.8%)
- 低酸素症 2.8% (2.8%)
- 好中球数減少 83.3% (66.7%)
- ALT増加 66.7% (61.1%)
- 白血球数減少 55.6% (55.6%)
- AST増加 47.2% (41.7%)
- 血小板数減少 36.1% (16.7%)
- γグルタミルトランスフェラーゼ増加 27.8% (25.0%)
- リンパ球数減少 22.2% (22.2 %)
- クレアチンホスホキナーゼ増加 16.7% (5.6%)
- ビリルビン増加 11.1% (0%)
- ALP増加 8.3% (5.6%)
- QT延長 5.6% (2.8%)
- コレステロール増加 2.8% (2.8%)
Lancet Oncol. 2015 Apr;16(4):406-16³⁾より引用
エキスパートによるワンポイント
2次治療以降の選択肢に
化学療法後に病勢進行が認められた進行または再発悪性軟部腫瘍患者を対象にしたベストサポーティブケアに対する国内第Ⅱ相試験³⁾において、 優越性を示して2015年に保険適用となった。
パクリタキセル使用後の2次治療の候補としては、 他にドセタキセル、 エリブリン、 パゾパニブ等があるが、 これらの比較試験は存在せず患者の状態や既往歴、 合併症および薬剤の特性などから治療薬を選択する。 なお、 化学療法未治療例における有効性及び安全性は確立しておらず1次治療としては推奨されない。
0.2mg/m²ずつ減量
トラベクテジン1回1.2mg/m² (体表面積) を24時間かけて中心静脈からの点滴投与する。 少なくとも20日休薬し、 これを1サイクルとして繰り返す。
Grade3以上の副作用が90%以上にみられるため、 投与開始や減量については電子添文に従って判断する。 減量は0.2mg/m²ずつ行い、 0.8mg/m²を最低投与量とする。
静脈炎等の副作用に注意
末梢静脈からの投与では高頻度に静脈炎を認めたことや、 薬液が血管外に漏出すると漏出部の組織障害、 壊死を起こすことも知られている。 また副作用として横紋筋融解や心機能障害も報告されている。
血液毒性、 肝機能障害、 腎機能障害、 クレアチンホスホキナーゼ増加などを確認してから投与開始する。
血液検査でクレアチニンホスホキナーゼの値や筋肉痛などの症状の有無、 心エコーなどでの心機能の確認も必要である。
無増悪生存期間を改善
国内第Ⅱ相試験³⁾は既治療の悪性軟部腫瘍患者に対してベストサポーティブケアとのランダム化比較試験であり、 37人のトラベクテジン投与患者において無増悪生存期間中央値が5.6ヵ月と、 36人のベストサポーティブケアでは同0.9ヵ月に対して有意な改善を認めた。 ただし、 この試験には血管肉腫患者は含まれておらず、 血管肉腫に対する有効性と安全性は今後の検証が必要である。
有害事象としては悪心、 食欲低下、 好中球減少、 ALT上昇が高頻度で見られた。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
出典
- 大鵬薬品工業株式会社. ヨンデリス®電子添文 (2024年6月改訂第2版) [最終閲覧 : 2024/07/1]
- 大鵬薬品工業株式会社. ヨンデリス®適正使用ガイド [最終閲覧 : 2024/04/17]
- Trabectedin monotherapy after standard chemotherapy versus best supportive care in patients with advanced, translocation-related sarcoma: a randomised, open-label, phase 2 study. Lancet Oncol. 2015 Apr;16(4):406-16. PMID: 25795406
最終更新日 : 2024年7月1日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。