L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 130mg/m² 点滴 | 1~ | Day1 |
Tmab:Trastuzumab(ハーセプチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1 | Day1 |
| 6mg/kg 点滴 | 2~ | Day1 |
S-1:Tegafur/Gimeracil/Oteracil(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/日 経口 分2朝夕食後 | 1~ | Day1夕~15朝 |
その他
| 1コース21日間。 |
| S-1+L-OHPをSOX療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*大鵬薬品工業株式会社の外部サイトへ遷移します
*中外製薬の外部サイトへ遷移します
用法用量
KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾のプロトコル
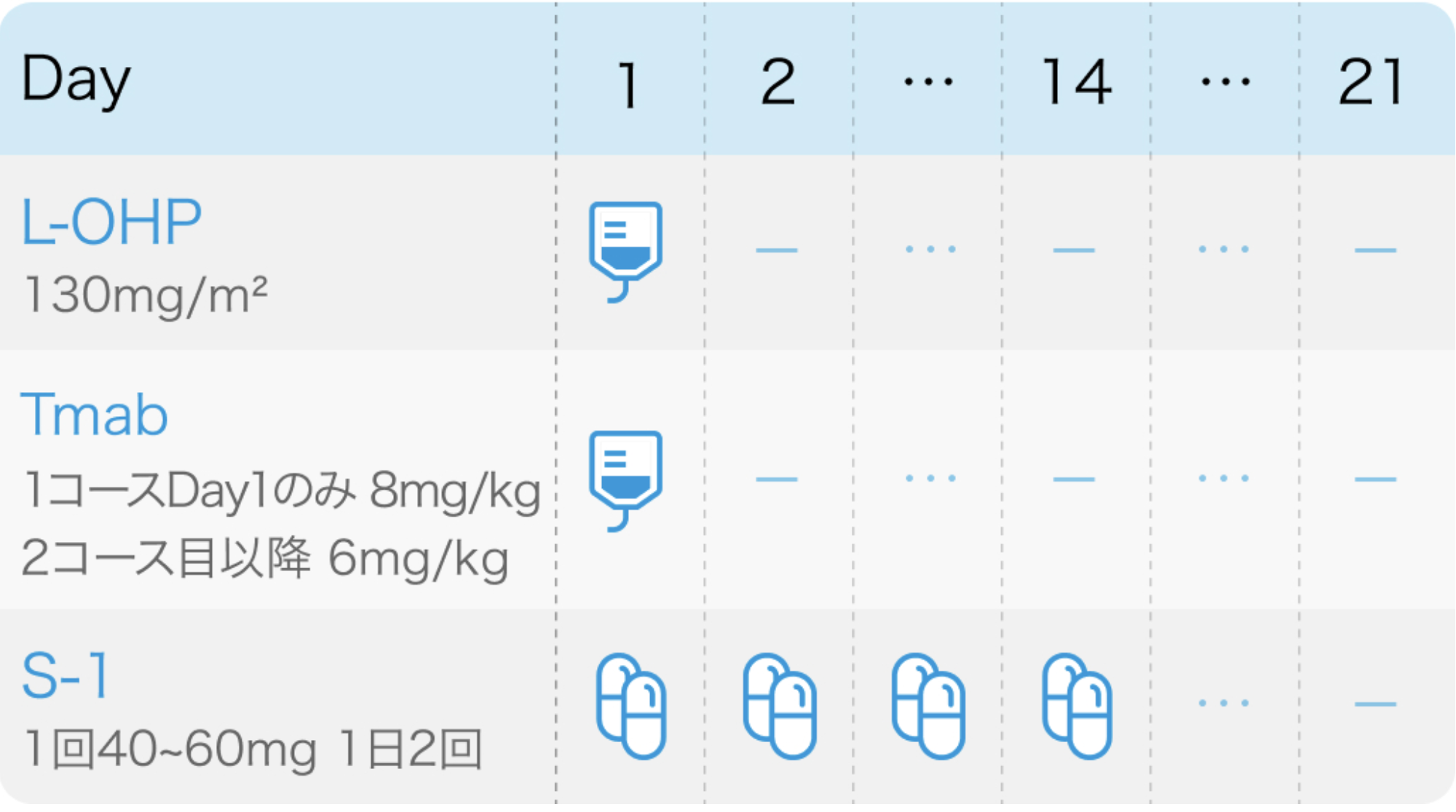
Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
前投薬
制吐薬はオキサリプラチンがMECに該当するため、 基本は5-HT3拮抗薬+デキサメタゾン
アプレピタント (またはホスアプレピタント・ホスネツピタント) 併用も選択肢。 特に若年や女性など悪心・嘔吐リスク因子をもつ患者には積極使用を検討
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
投与開始基準
KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾のプロトコル
SOX療法

Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
T-mab

Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
減量・中止基準
KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾のプロトコル
SOX療法
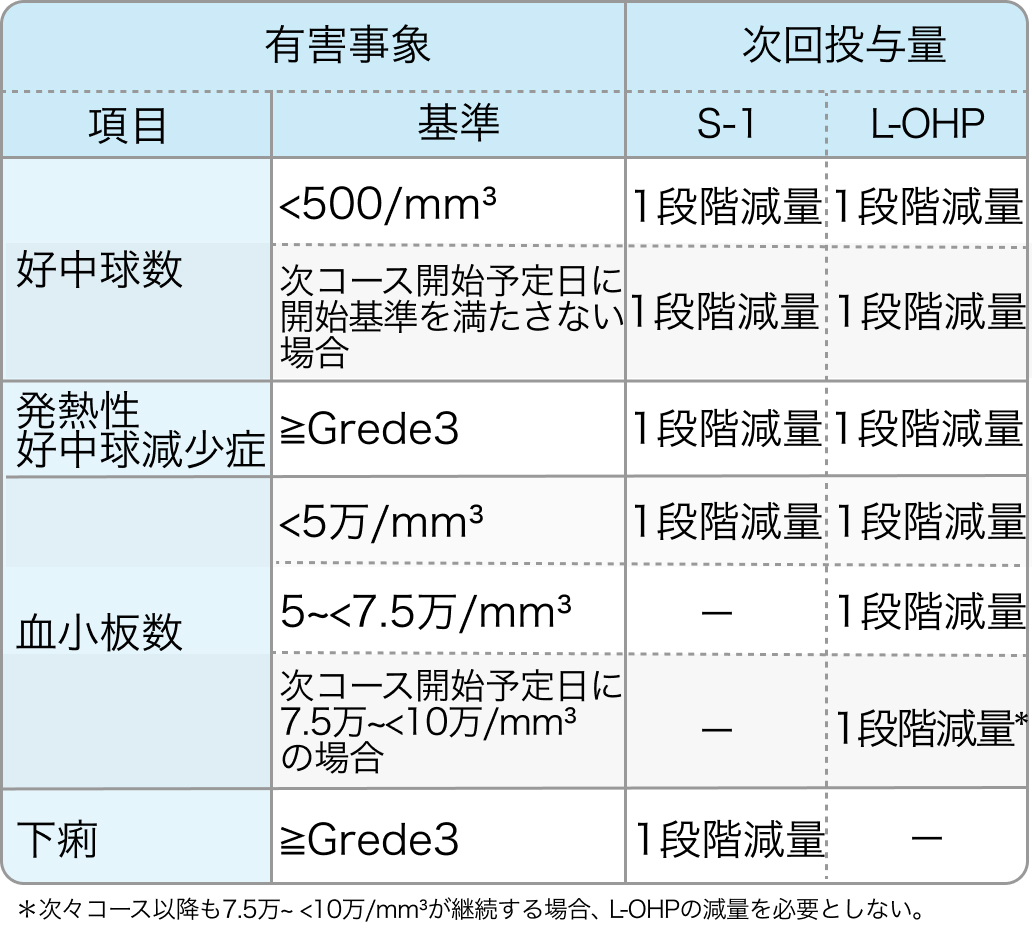
Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
初回基準量と減量レベル
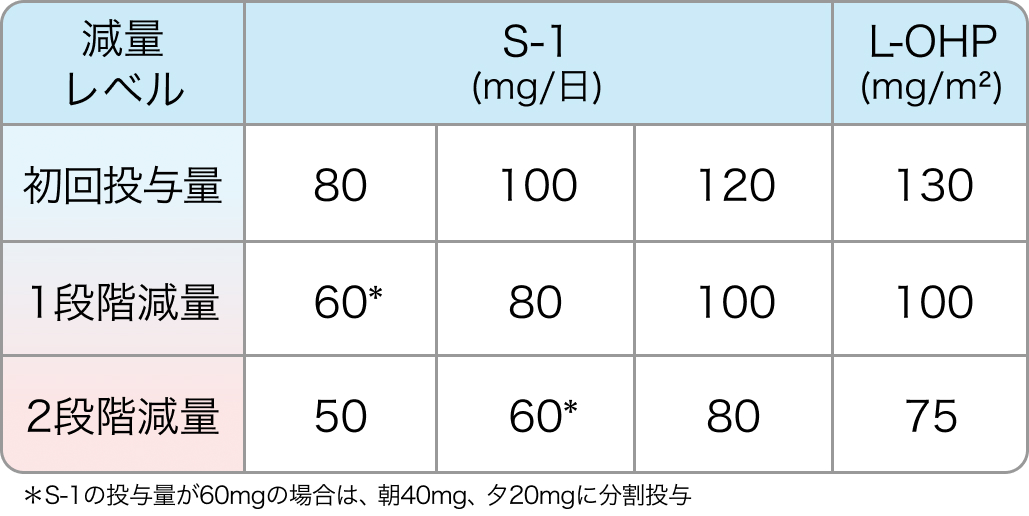
Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
T-mab
動悸、 息切れ、 頻脈がある場合は回復を待って投与。
Tmabの投与をskipもしくは中止する場合もS-1、 L-OHPの投与継続は可能。 L-OHPの投与も中止されている場合はS-1単独投与。
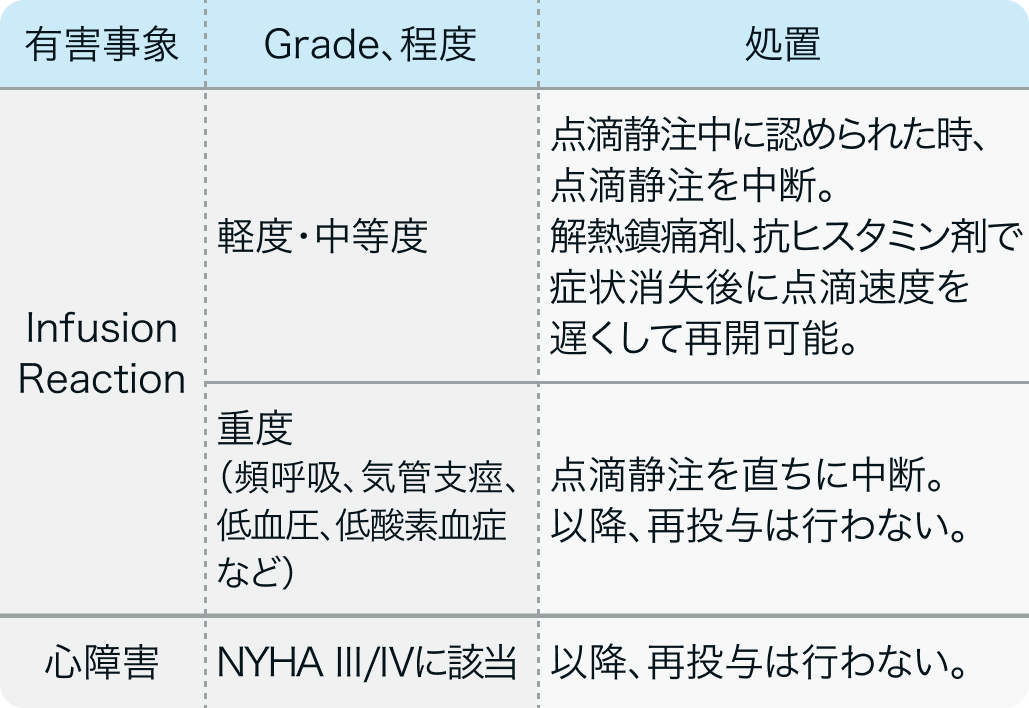
Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
参考 : 🔢 NYHA心機能分類
主な有害事象
KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 46.2% (2.6%)
- 好中球数減少 74.4% (10.3%)
- 貧血 97.4% (12.8%)
- 血小板減少 94.9% (19.9%)
- AST上昇 92.3% (5.1%)
- 悪心 59.0% (7.7%)
- 食欲不振 82.1% (17.9%)
- 倦怠感 61.5% (5.1%)
- 下痢 51.3% (7.7%)
- 口内炎 48.7% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 末梢性感覚ニューロパチー 82.1% (5.1%)
Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より引用
上手に使うためのワンポイント
2コース目以降の好中球数の目安
患者個々のリスク評価のうえ、 2コース目以降の開始基準として好中球1200/μL前後での投与は考慮されうる。
オキサリプラチンの減量・中止について
オキサリプラチン130mg/m²で開始の場合、 2コース目以降、 開始予定日の血小板の数値によりオキサリプラチン減量が考慮される。 また、 ToGA試験において、 シスプラチンは6コースまでがプロトコール治療であった⁷⁾。 一方、 SOX+T-mabの国内2試験プロトコールでは、 オキサリプラチンは計画中止の設定ではなかった⁶⁾⁸⁾。 しかしながら患者のQOLや、 次治療への移行を考慮してオキサリプラチンの中止を検討すべきである。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
ガイドラインでの扱い
HER2陽性胃癌1次治療において 「推奨される化学療法レジメン」 である⁹⁾。
HER2陽性胃癌1次治療の選択肢
HER2陽性胃癌におけるT-mabの有用性を検証したToGA試験で用いられたBackbone chemotherapyは、 カペシタビンもしくは5-FU+シスプラチン (XP/FP) だった⁷⁾。 HER2statusに関わらず実施された臨床試験において、 シスプラチンに対するオキサリプラチンの非劣性が証明されていることから¹⁰⁾、 XP/FPに限定されずフッ化ピリミジン+プラチナ+T-mabがHER2陽性胃癌1次治療の選択肢となっている¹¹⁾。
オキサリプラチンの投与量
国内で実施されたSOX+T-mabの2つの臨床試験ではオキサリプラチン130mg/m²が用いられた⁶⁾⁸⁾。 一方、 SP療法に対するSOX療法の非劣性を証明したG-SOX試験ではオキサリプラチンの用量は100mg/m²である¹²⁾。 CAPOXとSOXの違いはあるが、 国内での報告によると、 高齢者ではFitでもオキサリプラチン130mg/m²では毒性が強いため100mg/m²へ減量が必要な患者もいることが示唆されている¹³⁾。 患者状況にあわせて適宜、 初回開始用量の減量を考慮する必要がある。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験①|KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾
HER2陽性の切除不能進行・再発胃癌において、 トラスツズマブ+S-1+オキサリプラチンの併用療法 (T-SOX130療法) の効果を検証した単群コホートの第Ⅱ相試験KSCC/HGCSG/CCOG/PerSeUS 1501Bの結果より、 T-SOX130療法の良好な忍容性と、 有望性が示された。
追跡期間中央値
22.4ヵ月
RR
CR 9例、 PR 23例、 SD 2例
奏効率 (ORR)
82.1%
(95%CI 70.0-90.0%)
病勢コントロール率
87.2%
(95%CI 73.3-94.4%)
OS中央値
27.6ヵ月
(95%CI 15.6ヵ月-NR)
OS率 (1年時、 2年時)
74.4%、 57.9%
PFS中央値
7.0ヵ月
(95%CI 5.5-14.1ヵ月)
TTF中央値
5.7ヵ月
(95%CI 4.6-7.0ヵ月)
関連する臨床試験②|ToGA試験⁷⁾
化学療法未治療の進行胃・胃食道接合部癌患者において、 トラスツズマブ+化学療法の併用の効果を、 化学療法単独を対照に検証した第Ⅲ相ランダム化比較試験ToGAの結果より、 HER2陽性患者の全生存期間 (OS) に対する有効性が示された。
OS中央値
- トラスツズマブ+化学療法群 : 13.8ヵ月
(95%CI 12-16ヵ月)
- 化学療法単独群 : 11.1ヵ月
(95%CI 10-13ヵ月)
HR 0.74 (95%CI 0.60-0.91)、 p=0.0046
HER2高発現患者
- トラスツズマブ+化学療法群 : 16.0ヵ月
- 化学療法単独群 : 11.8ヵ月
HR 0.65 (95%CI 0.51-0.83)
HER2低発現患者
- トラスツズマブ+化学療法群 : 10.0ヵ月
- 化学療法単独群 : 8.7ヵ月
HR 1.07 (95%CI 0.70-1.62)
OSのサブグループ解析
トラスツズマブ使用の有無と、 HER2高発現・低発現の2つのグループ間に有意な相互作用を認めた (p=0.036)。
PFS中央値
- トラスツズマブ+化学療法群 : 6.7ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 5.5ヵ月
(95%CI 5-6ヵ月)
HR 0.71 (95%CI 0.59-0.85)、 p=0.0002
TTP中央値
- トラスツズマブ+化学療法群 : 7.1ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 5.6ヵ月
(95%CI 5-6ヵ月)
HR 0.70 (95%CI 0.58-0.85)、 p=0.0003
ORR
- トラスツズマブ+化学療法群 : 47%
- 化学療法単独群 : 35%
DOR中央値
- トラスツズマブ+化学療法群 : 6.9ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 4.8ヵ月
(95%CI 4-6ヵ月)
HR 0.54 (95%CI 0.40-0.73)、 p<0.0001
関連する臨床試験③|HIGHSOX試験⁸⁾
HER2陽性の切除不能胃・食道胃接合部癌患者において、 トラスツズマブとSOX療法 (S-1+オキサリプラチン) の併用効果を検証した単群コホートの第Ⅱ相試験HIGHSOXの結果より、 併用療法の良好な忍容性と有効性が示された。
追跡期間中央値
15.6ヵ月
ORR
70.7%
(95%CI 59.0-80.6%)
病勢コントロール率
93.3%
(95%CI 85.1-97.8%)
OS中央値
18.1ヵ月
(95%CI 15.6-26.5ヵ月)
OS率 (1年時、 2年時)
77.2%、 43.0%
PFS中央値
8.8ヵ月
(95%CI 7.4-12.2ヵ月)
PFS率 (6ヵ月時、 1年時)
68.5%、 39.5%
HER2発現量によるサブグループ解析
IHC3+ (55例)
- OS中央値 : 20.5ヵ月
- ORR : 70.9%
IHC2+/ISH陽性 (20例)
- OS中央値 : 16.9ヵ月
- ORR : 70.0%
IHC3+ vs IHC2+/ISH陽性
HR 0.734 (95%CI 0.366-1.475)
オキサリプラチンの相対用量強度 (RDI) によるサブグループ解析
RDI>75%
- ORR : 91.7%
- OS : 17.7ヵ月
- PFS : 9.8ヵ月
RDI 50-75%
- ORR : 72.7%
- OS : 18.1ヵ月
- PFS : 8.8ヵ月
RDI<50%
- ORR : 51.7%
- OS : 20.5ヵ月
- PFS : 8.7ヵ月
出典
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2023年9月改訂 第3版) [最終閲覧:2024/7/29]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド (2023年10月27日 更新) [最終閲覧 : 2024/04/01]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/7/18]
- 日本化薬. ハーセプチン®電子添文 (2022年12月改訂 第5版) [最終閲覧 : 2024/7/29]
- 日本化薬. ハーセプチン®適正使用ガイド (2023年12月改訂) [最終閲覧 : 2024/7/29]
- Multicenter phase II study of SOX plus trastuzumab for patients with HER2+ metastatic or recurrent gastric cancer: KSCC/HGCSG/CCOG/PerSeUS 1501B. Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223. PMID: 31768696
- Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010 Aug 28;376(9742):687-97. PMID: 20728210
- Multicenter phase II study of trastuzumab with S-1 plus oxaliplatin for chemotherapy-naïve, HER2-positive advanced gastric cancer. Gastric Cancer. 2019 Nov;22(6):1238-1246. PMID: 31102009
- Japanese Gastric Cancer Treatment Guidelines 2021 (6th edition). Gastric Cancer. 2023 Jan;26(1):1-25. doi: 10.1007/s10120-022-01331-8. Epub 2022 Nov 7. PMID: 36342574
- Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2008 Jan 3;358(1):36-46. PMID: 18172173
- Gastric Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022 Feb;20(2):167-192. PMID: 35130500
- Phase III study comparing oxaliplatin plus S-1 with cisplatin plus S-1 in chemotherapy-naïve patients with advanced gastric cancer. Ann Oncol. 2015 Jan;26(1):141-148.PMID: 25316259
- Initial Safety Analysis of CapeOx for Elderly Patients With Advanced Gastric Cancer Patients: A Phase II Trial. Anticancer Res . 2022 May;42(5):2683-2687. PMID: 35489762
最終更新日 : 2024年9月11日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
SOX + T-mab
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 130mg/m² 点滴 | 1~ | Day1 |
Tmab:Trastuzumab(ハーセプチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1 | Day1 |
| 6mg/kg 点滴 | 2~ | Day1 |
S-1:Tegafur/Gimeracil/Oteracil(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/日 経口 分2朝夕食後 | 1~ | Day1夕~15朝 |
その他
| 1コース21日間。 |
| S-1+L-OHPをSOX療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*大鵬薬品工業株式会社の外部サイトへ遷移します
*中外製薬の外部サイトへ遷移します
用法用量
KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾のプロトコル

Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
前投薬
制吐薬はオキサリプラチンがMECに該当するため、 基本は5-HT3拮抗薬+デキサメタゾン
アプレピタント (またはホスアプレピタント・ホスネツピタント) 併用も選択肢。 特に若年や女性など悪心・嘔吐リスク因子をもつ患者には積極使用を検討
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
投与開始基準
KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾のプロトコル
SOX療法

Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
T-mab

Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
減量・中止基準
KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾のプロトコル
SOX療法

Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
初回基準量と減量レベル

Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
T-mab
動悸、 息切れ、 頻脈がある場合は回復を待って投与。
Tmabの投与をskipもしくは中止する場合もS-1、 L-OHPの投与継続は可能。 L-OHPの投与も中止されている場合はS-1単独投与。

Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より作図
参考 : 🔢 NYHA心機能分類
主な有害事象
KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 46.2% (2.6%)
- 好中球数減少 74.4% (10.3%)
- 貧血 97.4% (12.8%)
- 血小板減少 94.9% (19.9%)
- AST上昇 92.3% (5.1%)
- 悪心 59.0% (7.7%)
- 食欲不振 82.1% (17.9%)
- 倦怠感 61.5% (5.1%)
- 下痢 51.3% (7.7%)
- 口内炎 48.7% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 末梢性感覚ニューロパチー 82.1% (5.1%)
Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223⁶⁾より引用
上手に使うためのワンポイント
2コース目以降の好中球数の目安
患者個々のリスク評価のうえ、 2コース目以降の開始基準として好中球1200/μL前後での投与は考慮されうる。
オキサリプラチンの減量・中止について
オキサリプラチン130mg/m²で開始の場合、 2コース目以降、 開始予定日の血小板の数値によりオキサリプラチン減量が考慮される。 また、 ToGA試験において、 シスプラチンは6コースまでがプロトコール治療であった⁷⁾。 一方、 SOX+T-mabの国内2試験プロトコールでは、 オキサリプラチンは計画中止の設定ではなかった⁶⁾⁸⁾。 しかしながら患者のQOLや、 次治療への移行を考慮してオキサリプラチンの中止を検討すべきである。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
ガイドラインでの扱い
HER2陽性胃癌1次治療において 「推奨される化学療法レジメン」 である⁹⁾。
HER2陽性胃癌1次治療の選択肢
HER2陽性胃癌におけるT-mabの有用性を検証したToGA試験で用いられたBackbone chemotherapyは、 カペシタビンもしくは5-FU+シスプラチン (XP/FP) だった⁷⁾。 HER2statusに関わらず実施された臨床試験において、 シスプラチンに対するオキサリプラチンの非劣性が証明されていることから¹⁰⁾、 XP/FPに限定されずフッ化ピリミジン+プラチナ+T-mabがHER2陽性胃癌1次治療の選択肢となっている¹¹⁾。
オキサリプラチンの投与量
国内で実施されたSOX+T-mabの2つの臨床試験ではオキサリプラチン130mg/m²が用いられた⁶⁾⁸⁾。 一方、 SP療法に対するSOX療法の非劣性を証明したG-SOX試験ではオキサリプラチンの用量は100mg/m²である¹²⁾。 CAPOXとSOXの違いはあるが、 国内での報告によると、 高齢者ではFitでもオキサリプラチン130mg/m²では毒性が強いため100mg/m²へ減量が必要な患者もいることが示唆されている¹³⁾。 患者状況にあわせて適宜、 初回開始用量の減量を考慮する必要がある。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験①|KSCC/HGCSG/CCOG/PerSeUS 1501B試験⁶⁾
HER2陽性の切除不能進行・再発胃癌において、 トラスツズマブ+S-1+オキサリプラチンの併用療法 (T-SOX130療法) の効果を検証した単群コホートの第Ⅱ相試験KSCC/HGCSG/CCOG/PerSeUS 1501Bの結果より、 T-SOX130療法の良好な忍容性と、 有望性が示された。
追跡期間中央値
22.4ヵ月
RR
CR 9例、 PR 23例、 SD 2例
奏効率 (ORR)
82.1%
(95%CI 70.0-90.0%)
病勢コントロール率
87.2%
(95%CI 73.3-94.4%)
OS中央値
27.6ヵ月
(95%CI 15.6ヵ月-NR)
OS率 (1年時、 2年時)
74.4%、 57.9%
PFS中央値
7.0ヵ月
(95%CI 5.5-14.1ヵ月)
TTF中央値
5.7ヵ月
(95%CI 4.6-7.0ヵ月)
関連する臨床試験②|ToGA試験⁷⁾
化学療法未治療の進行胃・胃食道接合部癌患者において、 トラスツズマブ+化学療法の併用の効果を、 化学療法単独を対照に検証した第Ⅲ相ランダム化比較試験ToGAの結果より、 HER2陽性患者の全生存期間 (OS) に対する有効性が示された。
OS中央値
- トラスツズマブ+化学療法群 : 13.8ヵ月
(95%CI 12-16ヵ月)
- 化学療法単独群 : 11.1ヵ月
(95%CI 10-13ヵ月)
HR 0.74 (95%CI 0.60-0.91)、 p=0.0046
HER2高発現患者
- トラスツズマブ+化学療法群 : 16.0ヵ月
- 化学療法単独群 : 11.8ヵ月
HR 0.65 (95%CI 0.51-0.83)
HER2低発現患者
- トラスツズマブ+化学療法群 : 10.0ヵ月
- 化学療法単独群 : 8.7ヵ月
HR 1.07 (95%CI 0.70-1.62)
OSのサブグループ解析
トラスツズマブ使用の有無と、 HER2高発現・低発現の2つのグループ間に有意な相互作用を認めた (p=0.036)。
PFS中央値
- トラスツズマブ+化学療法群 : 6.7ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 5.5ヵ月
(95%CI 5-6ヵ月)
HR 0.71 (95%CI 0.59-0.85)、 p=0.0002
TTP中央値
- トラスツズマブ+化学療法群 : 7.1ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 5.6ヵ月
(95%CI 5-6ヵ月)
HR 0.70 (95%CI 0.58-0.85)、 p=0.0003
ORR
- トラスツズマブ+化学療法群 : 47%
- 化学療法単独群 : 35%
DOR中央値
- トラスツズマブ+化学療法群 : 6.9ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 4.8ヵ月
(95%CI 4-6ヵ月)
HR 0.54 (95%CI 0.40-0.73)、 p<0.0001
関連する臨床試験③|HIGHSOX試験⁸⁾
HER2陽性の切除不能胃・食道胃接合部癌患者において、 トラスツズマブとSOX療法 (S-1+オキサリプラチン) の併用効果を検証した単群コホートの第Ⅱ相試験HIGHSOXの結果より、 併用療法の良好な忍容性と有効性が示された。
追跡期間中央値
15.6ヵ月
ORR
70.7%
(95%CI 59.0-80.6%)
病勢コントロール率
93.3%
(95%CI 85.1-97.8%)
OS中央値
18.1ヵ月
(95%CI 15.6-26.5ヵ月)
OS率 (1年時、 2年時)
77.2%、 43.0%
PFS中央値
8.8ヵ月
(95%CI 7.4-12.2ヵ月)
PFS率 (6ヵ月時、 1年時)
68.5%、 39.5%
HER2発現量によるサブグループ解析
IHC3+ (55例)
- OS中央値 : 20.5ヵ月
- ORR : 70.9%
IHC2+/ISH陽性 (20例)
- OS中央値 : 16.9ヵ月
- ORR : 70.0%
IHC3+ vs IHC2+/ISH陽性
HR 0.734 (95%CI 0.366-1.475)
オキサリプラチンの相対用量強度 (RDI) によるサブグループ解析
RDI>75%
- ORR : 91.7%
- OS : 17.7ヵ月
- PFS : 9.8ヵ月
RDI 50-75%
- ORR : 72.7%
- OS : 18.1ヵ月
- PFS : 8.8ヵ月
RDI<50%
- ORR : 51.7%
- OS : 20.5ヵ月
- PFS : 8.7ヵ月
出典
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2023年9月改訂 第3版) [最終閲覧:2024/7/29]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド (2023年10月27日 更新) [最終閲覧 : 2024/04/01]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/7/18]
- 日本化薬. ハーセプチン®電子添文 (2022年12月改訂 第5版) [最終閲覧 : 2024/7/29]
- 日本化薬. ハーセプチン®適正使用ガイド (2023年12月改訂) [最終閲覧 : 2024/7/29]
- Multicenter phase II study of SOX plus trastuzumab for patients with HER2+ metastatic or recurrent gastric cancer: KSCC/HGCSG/CCOG/PerSeUS 1501B. Cancer Chemother Pharmacol. 2020 Jan;85(1):217-223. PMID: 31768696
- Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010 Aug 28;376(9742):687-97. PMID: 20728210
- Multicenter phase II study of trastuzumab with S-1 plus oxaliplatin for chemotherapy-naïve, HER2-positive advanced gastric cancer. Gastric Cancer. 2019 Nov;22(6):1238-1246. PMID: 31102009
- Japanese Gastric Cancer Treatment Guidelines 2021 (6th edition). Gastric Cancer. 2023 Jan;26(1):1-25. doi: 10.1007/s10120-022-01331-8. Epub 2022 Nov 7. PMID: 36342574
- Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2008 Jan 3;358(1):36-46. PMID: 18172173
- Gastric Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022 Feb;20(2):167-192. PMID: 35130500
- Phase III study comparing oxaliplatin plus S-1 with cisplatin plus S-1 in chemotherapy-naïve patients with advanced gastric cancer. Ann Oncol. 2015 Jan;26(1):141-148.PMID: 25316259
- Initial Safety Analysis of CapeOx for Elderly Patients With Advanced Gastric Cancer Patients: A Phase II Trial. Anticancer Res . 2022 May;42(5):2683-2687. PMID: 35489762
最終更新日 : 2024年9月11日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
