Talquetamab (A法):トアルクエタマブ(タービー®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 0.01mg/kg (漸増用量1) 皮下投与 | 漸増期 | Day1 |
| 0.06mg/kg (漸増用量2) 皮下投与 | 漸増期 | 漸増用量1から2〜4日空ける |
| 0.4mg/kg (治療用量) 皮下投与 | 漸増期 | 漸増用量2から2〜4日空ける |
| 0.4mg/kg (治療用量) 皮下投与 | 継続投与期 | 治療用量到達後、週に1回繰り返す |
Talquetamab (B法):トアルクエタマブ(タービー®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 0.01mg/kg (漸増用量1) 皮下投与 | 漸増期 | Day1 |
| 0.06mg/kg (漸増用量2) 皮下投与 | 漸増期 | 漸増用量1から2〜4日空ける |
| 0.4mg/kg (漸増用量3) 皮下投与 | 漸増期 | 漸増用量2から2〜4日空ける |
| 0.8mg/kg (治療用量) 皮下投与 | 漸増期 | 漸増用量3から2〜4日空ける |
| 0.8mg/kg (治療用量) 皮下投与 | 継続投与期 | 治療用量到達後、2週に1回繰り返す |
前投薬
| 用量漸増期には、 副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤を各投与の1~3時間前に投与。 |
その他
| 用量漸増期は、 投与後48時間の入院管理を行う。 |
| 用量漸増期の各投与間隔は最大で7日まで延長可能。 |
| 用量漸増期は2–4日ごとに投与 (例:4月1日投与 → 次は4月3–5日のいずれか)。 |
2024年11月20日に、 「再発又は難治性の多発性骨髄腫 (標準的な治療が困難な場合に限る) 」 を対象として製造販売承認を申請。 2025年6月24日に正式承認された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗GPRC5D・抗CD3二重特異性抗体 トアルクエタマブ
*ヤンセンファーマ株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】21日間
【催吐性】 最小度*
【FN発症】低リスク**
*NCCN Guidelines Version 2.2025 Antiemesis
**MonumenTAL-1試験のFN発生率1.5%²⁾を基に編集部が分類
A法およびB法のいずれかを選択する。 投与間隔および維持投与量が異なるため、 選択にあたっては注意が必要である。
A法 :
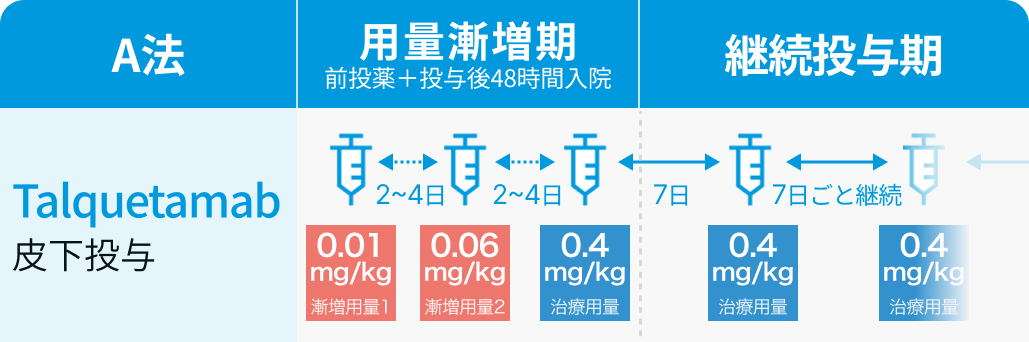
1日目に0.01mg/kgを皮下投与し、 2~4日間隔で0.06mg/kg、 0.4mg/kgを順に投与した後、 0.4mg/kgを毎週皮下投与
B法 :
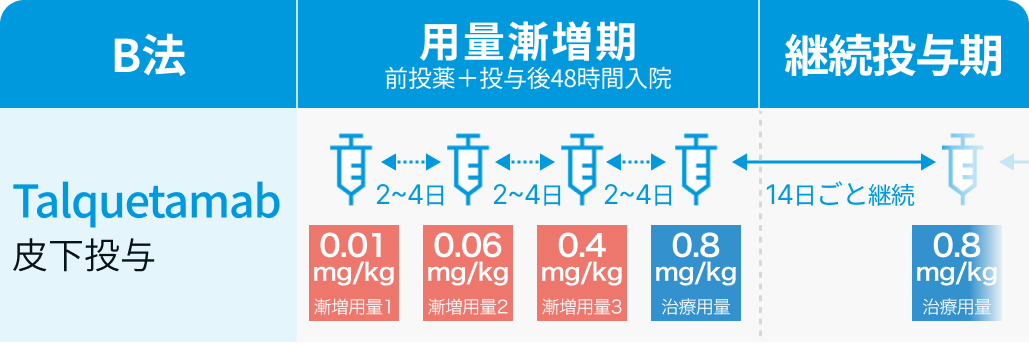
1日目に0.01mg/kgを皮下投与し、 2~4日間隔で0.06mg/kg、 0.4mg/kg、 0.8mg/kgを順に投与した後、 0.8mg/kgを2週ごとに皮下投与
用量漸増期には、 副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤を各投与の1~3時間前に前投薬として投与し、 投与後は48時間の入院管理を行う。 なお、 用量漸増期の各投与間隔は最大で7日まで延長可能である。
Key Data|臨床試験結果
📊 MonumenTAL-1試験
N Engl J Med. 2022;387(24):2232-2244.
重治療歴を有する再発又は難治性の多発性骨髄腫患者232例を対象に実施された国際共同第I相非盲検多施設共同試験。 いずれの例も、 標準治療に抵抗性であるか、 あるいは有害事象により継続困難であった症例であり、 治療歴の中央値は6レジメンであった。 本試験は、 用量漸増パート (パート1) と用量拡大パート (パート2) で構成され、 主要評価項目は用量制限毒性 (パート1のみ)、 有害事象、 臨床検査値異常の頻度と種類であった。
【有効性】毎週投与群 / 隔週投与群
- 奏効率 : 70% / 64%
- 最良部分奏効 (VGPR) 以上 : 57% / 52%
- 完全奏効 (CR) 以上 : 23% / 23%
- 奏効期間中央値 : 10.2ヵ月 / 7.8ヵ月
【安全性】毎週投与群 / 隔週投与群
主な有害事象 : 全Grade (Grade≧3)
- 貧血 60% (30%) / 43% (23%)
- 好中球減少 67% (60%) / 36% (32%)
- リンパ球減少 40% (40%) / 39% (39%)
- 血小板減少 37% (23%) / 23% (11%)
- 白血球減少 40% (30%) / 18% (14%)
- CRS 77% (3%) / 80% (0%)
- 皮膚関連事象 67% (0%) / 70% (2%)
- 味覚不全 63% / 57%
- 疲労 33% (3%) / 27% (0%)
- 爪関連事象 57% (0%) / 27% (2%)
- 発熱 33% (0%) / 18% (0%)
- 頭痛 20% (0%) / 25% (0%)
- 発疹関連事象 47% (0%) / 30% (16%)
- 下痢 30% (0%) / 16% (0%)
- 咳 20% (0%) / 11% (0%)
- 口腔乾燥 30% (0%) / 57% (0%)
- 悪心 30% (0%) / 16% (0%)
- 関節痛 23% (0%) / 9% (0%)
- 体重減少 30% (0%) / 32% (2%)
- ALT増加 20% (3%) / 30% (7%)
- AST増加 10% (0%) / 34% (7%)
- 背部痛 10% (0%) / 20% (0%)
- 低リン血症 27% (17%) / 18% (7%)
- 嚥下障害 37% (0%) / 27% (0%)
- 食欲減退 20% (3%) / 20% (0%)
- 便秘 7% (0%) / 14% (0%)
- γ-GTP増加 20% (3%) / 23% (7%)
各プロトコル
適格基準
MonumenTAL-1試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球数≧1,000/mm³
- 血小板数≧7.5万/mm³
- ヘモグロビン≧8.0g/dL
- 腎機能 : CrCl≧40 mL/min/1.73m²
- 肝機能 : T-Bil≦2.0×ULN、 AST/ALT≦3.0×ULN
有害事象発現時の減量・休薬・中止基準

タービー®電子添文情報¹⁾を基に編集部作成
休薬後に再開する場合の用量調整
A法 :
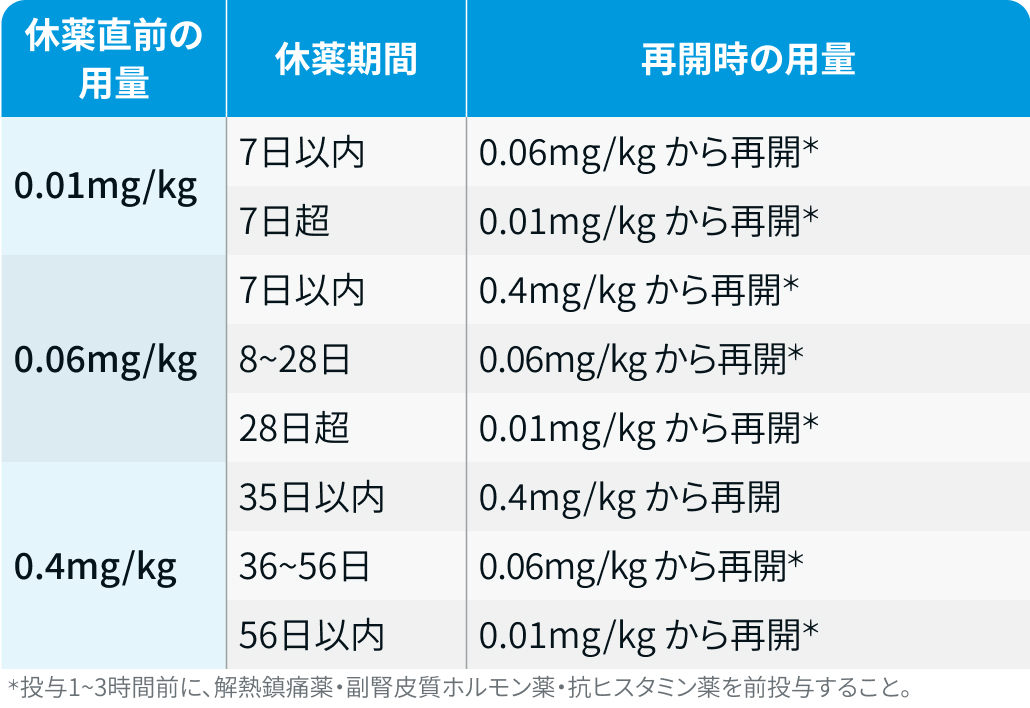
タービー®電子添文情報¹⁾を基に編集部作成
B法 :
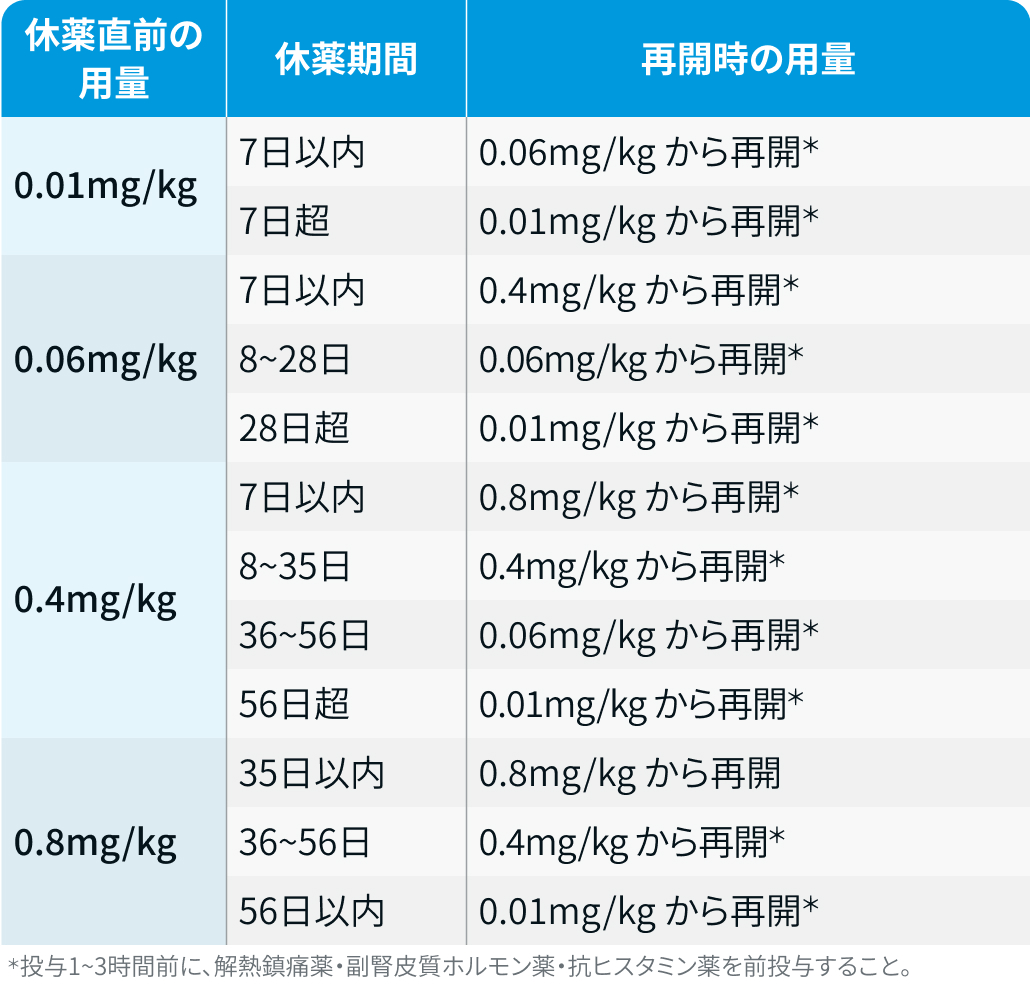
タービー®電子添文情報¹⁾を基に編集部作成
レジメンの特徴と注意点
本レジメンは、 免疫調節薬、 プロテアソーム阻害薬、 抗CD38モノクローナル抗体製剤を含む、 少なくとも3つの標準的な治療が無効であった、 又は治療後に再発した患者に適用される。
作用機序の特徴
トアルクエタマブは、 T細胞上のCD3と骨髄腫細胞上のGPRC5Dに結合するヒト化IgG4型の二重特異性抗体であり、 T細胞を活性化しGPRC5D発現腫瘍細胞の傷害を誘導する。
レジメン適用時の注意事項
投与部位 : 腹部や大腿部などに皮下注射。 複数回注射が必要な場合は、 同一部位への反復は避ける。
CRS : 特に漸増期はリスクが高いため、 各投与後48時間は必ず入院管理とする。 継続投与期も、 患者の状態に応じて入院を検討する。 予防的に前投薬を行い、 投与中は発熱、 悪寒、 低血圧、 頻脈、 低酸素、 頭痛、 肝酵素上昇等に十分な観察を行う。 症状出現時は速やかな受診を指導し、 緊急時に備えてトシリズマブ (遺伝子組換え) を使用できる体制を整えておく。
MonumenTAL-1試験³⁾では、 デキサメタゾン16mgを本剤投与の約3時間前に、 ジフェンヒドラミン50mgを約1時間前に、 アセトアミノフェン650~1,000mgを約30分前に前投与することが設定されていた。
神経学的事象 (ICANS含む) : 失語、 意識障害、 認知機能低下、 筋力低下、 痙攣、 脳浮腫などの神経学的事象があらわれることがある。 ICANSが疑われる場合は速やかな受診を指導し、 次回以降の投与後48時間は入院管理を検討すること。 錯乱、 痙攣等の発現により自動車運転など危険を伴う作業は制限し、 特に漸増期や神経症状が持続している間は従事させない。 運動失調などの小脳症状の出現・悪化についても十分に観察する。
感染症・血球減少 : 日和見感染症を含む感染症の発現・悪化が報告されているため、 投与前に必要に応じた予防措置を講じる。 投与中は感染兆候に注意し、 血球減少のリスクに対して定期的な血液検査と状態の観察を行う。
RMP【重要な特定されたリスク】
タービー®医薬品リスク管理計画書 (RMP)
- CRS
- 神経学的事象 (ICANS) 含む
- 感染症
- 血球減少
出典
- ヤンセンファーマ株式会社. タービー®皮下注3mg/40mg 電子添文 2025年6月作成 (第1版)
- ヤンセンファーマ株式会社. タービー®皮下注3mg/43mg 適正使用ガイド 2025年6月作成
- N Engl J Med. 2022;387(24):2232-2244.
最終更新 : 2025年7月8日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Talquetamab
Talquetamab (A法):トアルクエタマブ(タービー®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 0.01mg/kg (漸増用量1) 皮下投与 | 漸増期 | Day1 |
| 0.06mg/kg (漸増用量2) 皮下投与 | 漸増期 | 漸増用量1から2〜4日空ける |
| 0.4mg/kg (治療用量) 皮下投与 | 漸増期 | 漸増用量2から2〜4日空ける |
| 0.4mg/kg (治療用量) 皮下投与 | 継続投与期 | 治療用量到達後、週に1回繰り返す |
Talquetamab (B法):トアルクエタマブ(タービー®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 0.01mg/kg (漸増用量1) 皮下投与 | 漸増期 | Day1 |
| 0.06mg/kg (漸増用量2) 皮下投与 | 漸増期 | 漸増用量1から2〜4日空ける |
| 0.4mg/kg (漸増用量3) 皮下投与 | 漸増期 | 漸増用量2から2〜4日空ける |
| 0.8mg/kg (治療用量) 皮下投与 | 漸増期 | 漸増用量3から2〜4日空ける |
| 0.8mg/kg (治療用量) 皮下投与 | 継続投与期 | 治療用量到達後、2週に1回繰り返す |
前投薬
| 用量漸増期には、 副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤を各投与の1~3時間前に投与。 |
その他
| 用量漸増期は、 投与後48時間の入院管理を行う。 |
| 用量漸増期の各投与間隔は最大で7日まで延長可能。 |
| 用量漸増期は2–4日ごとに投与 (例:4月1日投与 → 次は4月3–5日のいずれか)。 |
概要
2024年11月20日に、 「再発又は難治性の多発性骨髄腫 (標準的な治療が困難な場合に限る) 」 を対象として製造販売承認を申請。 2025年6月24日に正式承認された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗GPRC5D・抗CD3二重特異性抗体 トアルクエタマブ
*ヤンセンファーマ株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】21日間
【催吐性】 最小度*
【FN発症】低リスク**
*NCCN Guidelines Version 2.2025 Antiemesis
**MonumenTAL-1試験のFN発生率1.5%²⁾を基に編集部が分類
A法およびB法のいずれかを選択する。 投与間隔および維持投与量が異なるため、 選択にあたっては注意が必要である。
A法 :

1日目に0.01mg/kgを皮下投与し、 2~4日間隔で0.06mg/kg、 0.4mg/kgを順に投与した後、 0.4mg/kgを毎週皮下投与
B法 :

1日目に0.01mg/kgを皮下投与し、 2~4日間隔で0.06mg/kg、 0.4mg/kg、 0.8mg/kgを順に投与した後、 0.8mg/kgを2週ごとに皮下投与
用量漸増期には、 副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤を各投与の1~3時間前に前投薬として投与し、 投与後は48時間の入院管理を行う。 なお、 用量漸増期の各投与間隔は最大で7日まで延長可能である。
Key Data|臨床試験結果
📊 MonumenTAL-1試験
N Engl J Med. 2022;387(24):2232-2244.
重治療歴を有する再発又は難治性の多発性骨髄腫患者232例を対象に実施された国際共同第I相非盲検多施設共同試験。 いずれの例も、 標準治療に抵抗性であるか、 あるいは有害事象により継続困難であった症例であり、 治療歴の中央値は6レジメンであった。 本試験は、 用量漸増パート (パート1) と用量拡大パート (パート2) で構成され、 主要評価項目は用量制限毒性 (パート1のみ)、 有害事象、 臨床検査値異常の頻度と種類であった。
【有効性】毎週投与群 / 隔週投与群
- 奏効率 : 70% / 64%
- 最良部分奏効 (VGPR) 以上 : 57% / 52%
- 完全奏効 (CR) 以上 : 23% / 23%
- 奏効期間中央値 : 10.2ヵ月 / 7.8ヵ月
【安全性】毎週投与群 / 隔週投与群
主な有害事象 : 全Grade (Grade≧3)
- 貧血 60% (30%) / 43% (23%)
- 好中球減少 67% (60%) / 36% (32%)
- リンパ球減少 40% (40%) / 39% (39%)
- 血小板減少 37% (23%) / 23% (11%)
- 白血球減少 40% (30%) / 18% (14%)
- CRS 77% (3%) / 80% (0%)
- 皮膚関連事象 67% (0%) / 70% (2%)
- 味覚不全 63% / 57%
- 疲労 33% (3%) / 27% (0%)
- 爪関連事象 57% (0%) / 27% (2%)
- 発熱 33% (0%) / 18% (0%)
- 頭痛 20% (0%) / 25% (0%)
- 発疹関連事象 47% (0%) / 30% (16%)
- 下痢 30% (0%) / 16% (0%)
- 咳 20% (0%) / 11% (0%)
- 口腔乾燥 30% (0%) / 57% (0%)
- 悪心 30% (0%) / 16% (0%)
- 関節痛 23% (0%) / 9% (0%)
- 体重減少 30% (0%) / 32% (2%)
- ALT増加 20% (3%) / 30% (7%)
- AST増加 10% (0%) / 34% (7%)
- 背部痛 10% (0%) / 20% (0%)
- 低リン血症 27% (17%) / 18% (7%)
- 嚥下障害 37% (0%) / 27% (0%)
- 食欲減退 20% (3%) / 20% (0%)
- 便秘 7% (0%) / 14% (0%)
- γ-GTP増加 20% (3%) / 23% (7%)
各プロトコル
適格基準
MonumenTAL-1試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球数≧1,000/mm³
- 血小板数≧7.5万/mm³
- ヘモグロビン≧8.0g/dL
- 腎機能 : CrCl≧40 mL/min/1.73m²
- 肝機能 : T-Bil≦2.0×ULN、 AST/ALT≦3.0×ULN
有害事象発現時の減量・休薬・中止基準

タービー®電子添文情報¹⁾を基に編集部作成
休薬後に再開する場合の用量調整
A法 :

タービー®電子添文情報¹⁾を基に編集部作成
B法 :

タービー®電子添文情報¹⁾を基に編集部作成
レジメンの特徴と注意点
本レジメンは、 免疫調節薬、 プロテアソーム阻害薬、 抗CD38モノクローナル抗体製剤を含む、 少なくとも3つの標準的な治療が無効であった、 又は治療後に再発した患者に適用される。
作用機序の特徴
トアルクエタマブは、 T細胞上のCD3と骨髄腫細胞上のGPRC5Dに結合するヒト化IgG4型の二重特異性抗体であり、 T細胞を活性化しGPRC5D発現腫瘍細胞の傷害を誘導する。
レジメン適用時の注意事項
投与部位 : 腹部や大腿部などに皮下注射。 複数回注射が必要な場合は、 同一部位への反復は避ける。
CRS : 特に漸増期はリスクが高いため、 各投与後48時間は必ず入院管理とする。 継続投与期も、 患者の状態に応じて入院を検討する。 予防的に前投薬を行い、 投与中は発熱、 悪寒、 低血圧、 頻脈、 低酸素、 頭痛、 肝酵素上昇等に十分な観察を行う。 症状出現時は速やかな受診を指導し、 緊急時に備えてトシリズマブ (遺伝子組換え) を使用できる体制を整えておく。
MonumenTAL-1試験³⁾では、 デキサメタゾン16mgを本剤投与の約3時間前に、 ジフェンヒドラミン50mgを約1時間前に、 アセトアミノフェン650~1,000mgを約30分前に前投与することが設定されていた。
神経学的事象 (ICANS含む) : 失語、 意識障害、 認知機能低下、 筋力低下、 痙攣、 脳浮腫などの神経学的事象があらわれることがある。 ICANSが疑われる場合は速やかな受診を指導し、 次回以降の投与後48時間は入院管理を検討すること。 錯乱、 痙攣等の発現により自動車運転など危険を伴う作業は制限し、 特に漸増期や神経症状が持続している間は従事させない。 運動失調などの小脳症状の出現・悪化についても十分に観察する。
感染症・血球減少 : 日和見感染症を含む感染症の発現・悪化が報告されているため、 投与前に必要に応じた予防措置を講じる。 投与中は感染兆候に注意し、 血球減少のリスクに対して定期的な血液検査と状態の観察を行う。
RMP【重要な特定されたリスク】
タービー®医薬品リスク管理計画書 (RMP)
- CRS
- 神経学的事象 (ICANS) 含む
- 感染症
- 血球減少
出典
- ヤンセンファーマ株式会社. タービー®皮下注3mg/40mg 電子添文 2025年6月作成 (第1版)
- ヤンセンファーマ株式会社. タービー®皮下注3mg/43mg 適正使用ガイド 2025年6月作成
- N Engl J Med. 2022;387(24):2232-2244.
最終更新 : 2025年7月8日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

