本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
血管新生阻害薬 スニチニブリンゴ酸塩カプセル
*ファイザー株式会社の外部サイトへ遷移します
投与スケジュール
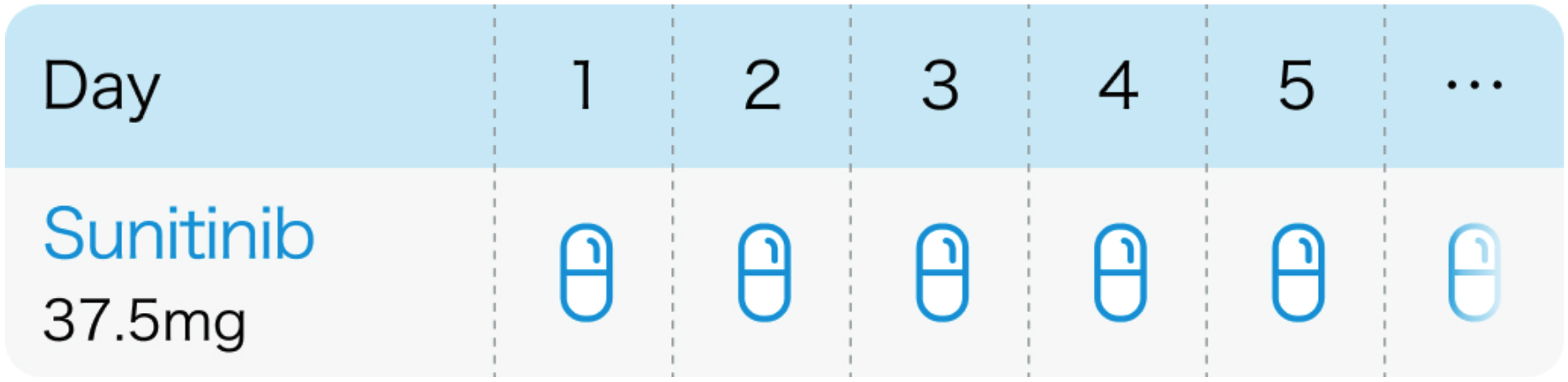
スニチニブとして1日1回37.5mgを経口投与する。 重篤な有害事象がなく、 十分な効果が見られない場合、 1日1回50mgまで増量可能。
スーテント®電子添文 (2024年2月改訂 第2版)¹⁾より作図
各プロトコル
投与開始基準
SUN1111試験³⁾の記載例
進行性、 転移性、 またはその両方の病理学的に確認された高分化型膵内分泌腫瘍を有する手術の対象者でないPS0、1の患者
減量・休薬・中止基準

初回基準量と減量レベル
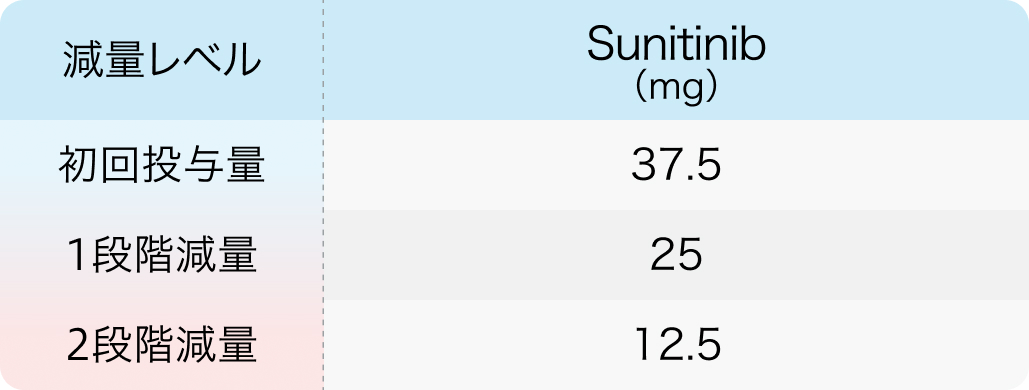
スーテント®電子添文 (2024年2月改訂 第2版)¹⁾より引用
主な有害事象
SUN1111試験³⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 下痢 59.0% (4.8%)
- 悪心 44.6% (1.2%)
- 嘔吐 33.7% (0%)
- 倦怠感 32.5% (4.8%)
- 好中球数減少 28.9% (12.0%)
- 口内炎 21.7% (3.6%)
- 血小板数減少 16.9% (3.6%)
- 粘膜炎 15.7% (1.2%)
- 体重減少 15.7% (1.2%)
- 便秘 14.5% (0%)
注意すべき有害事象
- 高血圧 26.5% (9.6%)
- 手掌・足底発赤知覚不全症候群 22.9% (6.0%)
特徴と注意点
スニチニブはVEGFRやPDGFRなどの受容体型チロシンキナーゼ阻害薬であり、 抗血管新生作用のほか、 細胞増殖抑制作用を有する。
膵神経内分泌腫瘍に対する標準治療の一つに位置づけられており、 膵・消化管神経内分泌腫瘍ガイドライン第2版⁴⁾では、 膵神経内分泌腫瘍に対する抗腫瘍薬として推奨されている (GradeA)。 ただし、 消化管神経内分泌腫瘍に対する有効性は示されていないため膵神経内分泌腫瘍に対してのみ保険適用となっている。
スニチニブは腎細胞癌や消化管間質腫瘍でも保険適用となっているが、 膵神経内分泌腫瘍に使用する際は上記の腫瘍と用法・用量が異なるため注意が必要である。
スニチニブには様々な副作用があるが、 頻度の高いものとして下痢、 悪心・嘔吐、 無力症、 好中球減少症、 高血圧、 手掌足底知覚不全症候群などがある。 手掌足底知覚不全症候群は長期に薬剤を継続する上で問題となることが多く、 保湿剤の予防的な使用や、 症状発現時のステロイド軟膏など、 十分な対策が必要である。
出典
1) ファイザー株式会社. スーテント®電子添文 (2024年2月改訂 第2版) [最終閲覧 : 2025/1/4]
2) ファイザー株式会社. スーテント®適正使用ガイド (2023年8月改訂) [最終閲覧 : 2025/1/4]
4) 日本神経内分泌腫瘍研究会 (JNETS) 編, 膵・消化管神経内分泌腫瘍 (NEN) 診療ガイドライン2019年 [第2版], 金原出版 [東京], 2019
最終更新日 : 2025年1月4日
執筆医 : 香川大学医学部附属病院 腫瘍内科 講師 奥山浩之先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
Sunitinib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
血管新生阻害薬 スニチニブリンゴ酸塩カプセル
*ファイザー株式会社の外部サイトへ遷移します
投与スケジュール

スニチニブとして1日1回37.5mgを経口投与する。 重篤な有害事象がなく、 十分な効果が見られない場合、 1日1回50mgまで増量可能。
スーテント®電子添文 (2024年2月改訂 第2版)¹⁾より作図
各プロトコル
投与開始基準
SUN1111試験³⁾の記載例
進行性、 転移性、 またはその両方の病理学的に確認された高分化型膵内分泌腫瘍を有する手術の対象者でないPS0、1の患者
減量・休薬・中止基準

初回基準量と減量レベル

スーテント®電子添文 (2024年2月改訂 第2版)¹⁾より引用
主な有害事象
SUN1111試験³⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 下痢 59.0% (4.8%)
- 悪心 44.6% (1.2%)
- 嘔吐 33.7% (0%)
- 倦怠感 32.5% (4.8%)
- 好中球数減少 28.9% (12.0%)
- 口内炎 21.7% (3.6%)
- 血小板数減少 16.9% (3.6%)
- 粘膜炎 15.7% (1.2%)
- 体重減少 15.7% (1.2%)
- 便秘 14.5% (0%)
注意すべき有害事象
- 高血圧 26.5% (9.6%)
- 手掌・足底発赤知覚不全症候群 22.9% (6.0%)
特徴と注意点
スニチニブはVEGFRやPDGFRなどの受容体型チロシンキナーゼ阻害薬であり、 抗血管新生作用のほか、 細胞増殖抑制作用を有する。
膵神経内分泌腫瘍に対する標準治療の一つに位置づけられており、 膵・消化管神経内分泌腫瘍ガイドライン第2版⁴⁾では、 膵神経内分泌腫瘍に対する抗腫瘍薬として推奨されている (GradeA)。 ただし、 消化管神経内分泌腫瘍に対する有効性は示されていないため膵神経内分泌腫瘍に対してのみ保険適用となっている。
スニチニブは腎細胞癌や消化管間質腫瘍でも保険適用となっているが、 膵神経内分泌腫瘍に使用する際は上記の腫瘍と用法・用量が異なるため注意が必要である。
スニチニブには様々な副作用があるが、 頻度の高いものとして下痢、 悪心・嘔吐、 無力症、 好中球減少症、 高血圧、 手掌足底知覚不全症候群などがある。 手掌足底知覚不全症候群は長期に薬剤を継続する上で問題となることが多く、 保湿剤の予防的な使用や、 症状発現時のステロイド軟膏など、 十分な対策が必要である。
出典
1) ファイザー株式会社. スーテント®電子添文 (2024年2月改訂 第2版) [最終閲覧 : 2025/1/4]
2) ファイザー株式会社. スーテント®適正使用ガイド (2023年8月改訂) [最終閲覧 : 2025/1/4]
4) 日本神経内分泌腫瘍研究会 (JNETS) 編, 膵・消化管神経内分泌腫瘍 (NEN) 診療ガイドライン2019年 [第2版], 金原出版 [東京], 2019
最終更新日 : 2025年1月4日
執筆医 : 香川大学医学部附属病院 腫瘍内科 講師 奥山浩之先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。