「PSMA陽性の遠隔転移を有する去勢抵抗性前立腺癌(mCRPC)」 を対象とし製造販売承認を申請し、 2025年9月19日に正式承認。 PSMAのPETイメージングのためのロカメッツ®キットおよびガリアファーム®⁶⁸Ge/⁶⁸Gaジェネレータをセットで用いる。
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
プルヴィクト® (ルテチウムビピボチドテトラキセタン : Lu-177)
*ノバルティスファーマ株式会社の製品サイトに遷移します
投与スケジュール
【1コース】 6週間
【催吐性】 低リスク*
【FN発症】 低リスク**
*NCCN Guidelines Version 2.2025 Antiemesisを基に記載
**VISION試験³⁾のFN発生率0.2%を基に編集部が分類

1回7.4GBqを6週間間隔で最大6回静脈内投与
以下のいずれかの方法で投与²⁾

Key Data|臨床試験結果
📊 VISION試験
N Engl J Med. 2021;385(12):1091-1103.
少なくとも1種類のアンドロゲン受容体経路阻害薬および1~2種類のタキサン系レジメンによる治療歴を有するPSMA陽性mCRPC 831例を対象とした第III相無作為化比較試験。 Lu-177+標準治療群551例、 標準治療単独群280例に割り付け、 主要評価項目は画像診断に基づく無増悪生存期間 (rPFS) とOSとされた。
*標準治療はアビラテロンやエンザルタミドなど承認済みホルモン治療薬、 ビスホスホネート、 放射線治療、 デノスマブ、 任意量のグルココルチコイドが許可され、 一方で細胞障害性化学療法、 Ra-223など全身用放射性同位元素、 免疫療法、 当時治験薬であった薬剤は禁忌とされた。
【有効性】¹⁷⁷Lu-PSMA-617群 (vs 対照群)
- OS中央値 15.3ヵ月 (vs 11.3ヵ月)
- HR 0.62 (95%CI 0.52–0.74、 p<0.001)
- rPFS中央値 8.7ヵ月 (vs 3.4ヵ月)
- HR 0.40 (99.2%CI 0.29–0.57、 p<0.001)
- 奏効率 29.8% (vs 1.7%)
- PSA反応率 (≧50%低下) 46% (vs 7%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 疲労 43.1% (5.9%)
- 口内乾燥 38.8% (0%)
- 悪心 35.3% (1.3%)
- 貧血 31.8% (12.9%)
- 背部痛 23.4% (3.2%)
- 関節痛 22.3% (1.1%)
- 食欲減退 21.2% (1.9%)
- 便秘 20.2% (1.1%)
- 下痢 18.9% (0.8%)
- 嘔吐 18.9% (0.9%)
- 血小板減少 17.2% (7.9%)
- リンパ球減少 14.2% (7.8%)
- 白血球減少 12.5% (2.5%)
各プロトコル
適格基準
VISION試験³⁾の主な適格基準 :
- 18歳以上
- ECOG PS 0–2
- 白血球≧2,500/μL、 又は好中球≧1,500/μL
- 血小板≧10万/μL
- ヘモグロビン≧9.0g/dL
- 肝機能 : T-Bil≦1.5×ULN、 AST/ALT≦3.0×ULN
- 腎機能 : Cre≦1.5×ULN 又はCrCl≧50mL/min
- 少なくとも1つの新規アンドロゲン軸薬 (NAAD) および1つ又は2つのタキサン系レジメンによる既治療歴あり
用量レベル
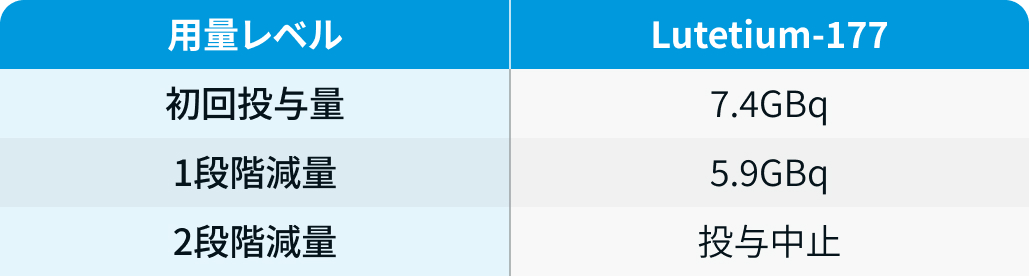
VISION試験³⁾では、 減量は1回のみ許可され再増量は不可であり、 追加の減量が必要な毒性が出た場合や有害事象による投与遅延が4週間を超える場合は治療を中止するとされた。
有害事象発現時の減量・休薬・中止基準
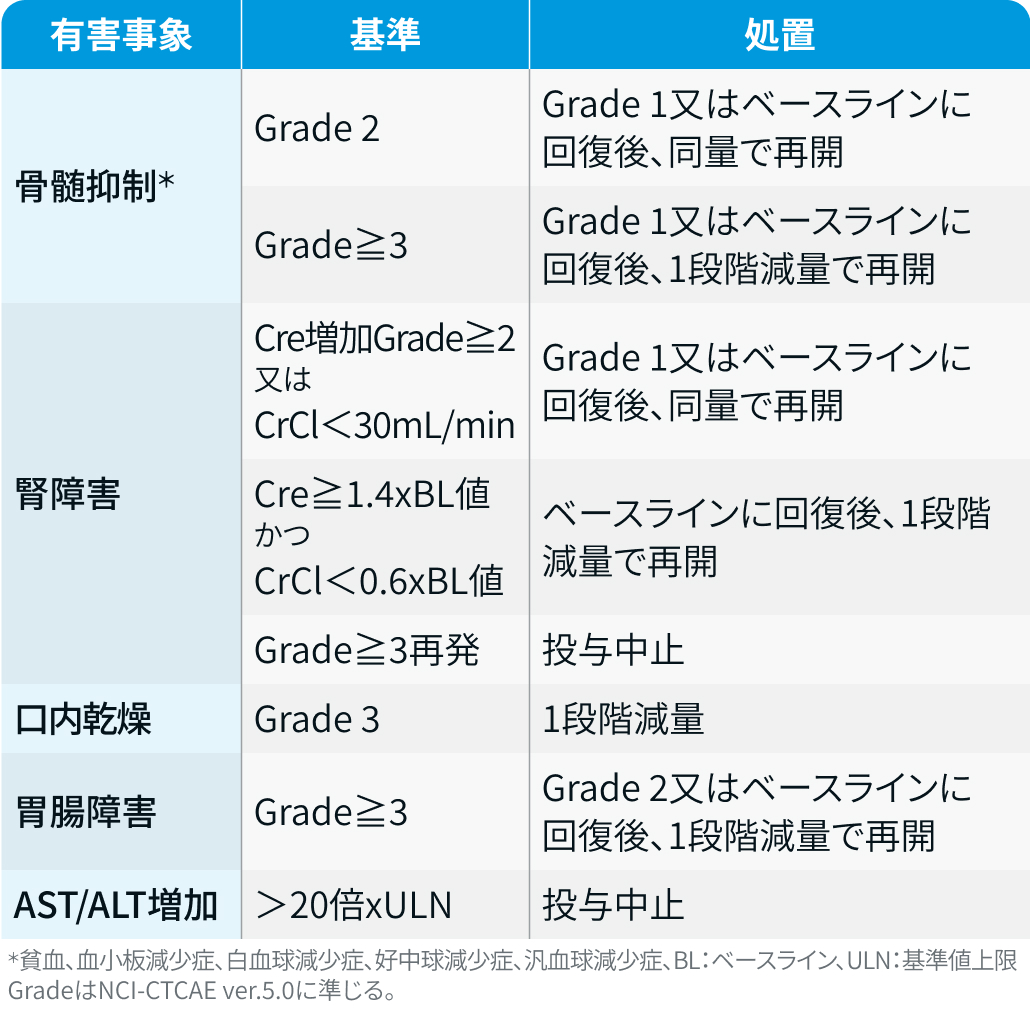
プルヴィクト®電子添文情報¹⁾を基に編集部作成
VISION試験³⁾では、 その他の有害事象への対応方法は以下のとおり定められていた。
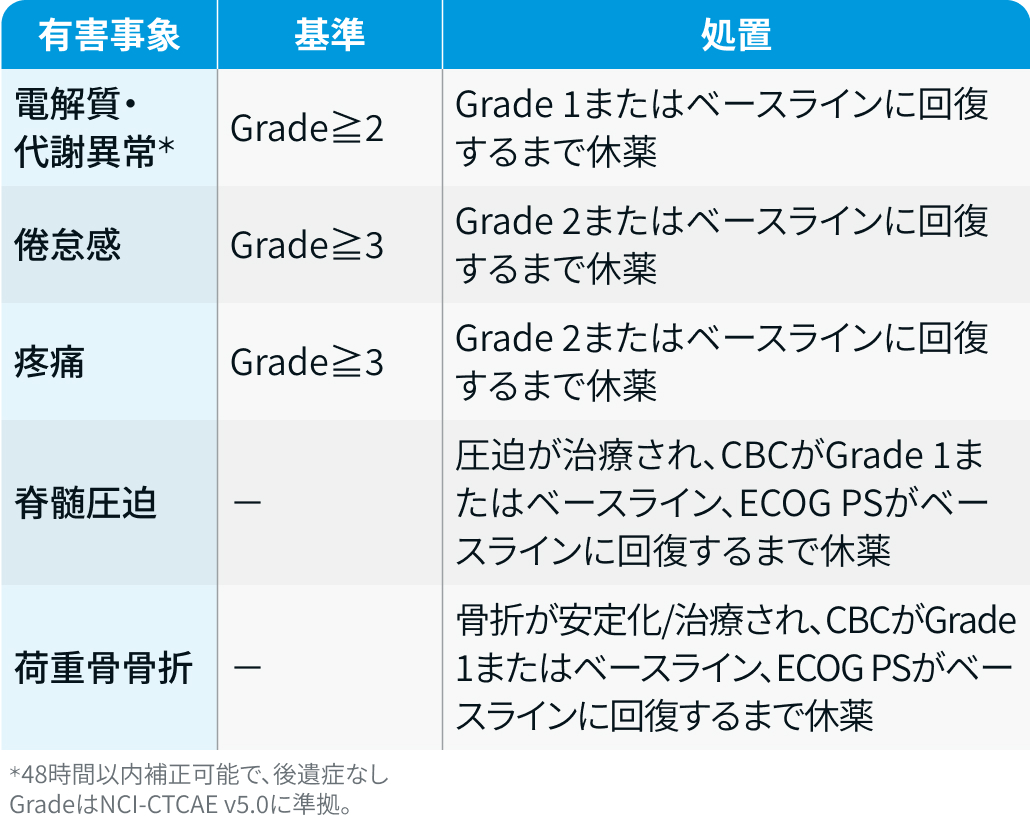
VISION試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
本放射性リガンド療法 (RLT) は、 特定の医療機関でのみ実施可能である。
ノバルティスファーマ株式会社の製品サイトに遷移します
本レジメンの位置付け
新規アンドロゲン受容体シグナル阻害薬 (ARSI) 治療歴を有するPSMA陽性mCRPCが適応。
アビラテロン、 エンザルタミド、 アパルタミド、 ダロルタミド未治療患者での有効性・安全性は確立していない。 タキサン系抗癌薬未治療の場合は、 その治療実施を慎重に検討し、 適応を選択する。
作用機序の特徴
Lu-177は、 PSMA高親和性のビピボチドテトラキセタンをLu-177で標識した放射性リガンド治療薬である。 PSMA高発現を示す去勢抵抗性前立腺癌などに結合後、 エンドサイトーシスを介して腫瘍細胞内に取り込まれ、 Lu-177から放出されるベータ線によりDNA損傷を誘発し、 腫瘍増殖を抑制する。 Lu-177のベータ線は正常組織への影響を抑えつつ、 腫瘍を効率的に照射する。
レジメン適用時の注意事項
骨髄抑制 : 投与開始前及び投与中は定期的に血液検査を行い、 状態を十分に確認
腎機能障害 : 投与開始前および投与中に定期的な腎機能検査で状態を確認し、 投与前後には水分補給と排尿を促す
放射線防護
以下、 FDA添付文書情報を基に編集部作成
医療従事者の防護 : 放射性医薬品であるため、 鉛シールド・鉛ガラスシリンジシールド・防護手袋を必ず使用し、 被曝を最小化する
患者指導のポイント :
- 水分摂取と頻回排尿を促し膀胱被曝を低減
- 投与後2日間は家庭内で1m未満の近接接触を回避
- 小児および妊婦との接触は7日間制限
- 性行為は7日間禁止
- 同居人との就寝は別室とし、 以下を遵守
同居人とは3日間、 子どもとは7日間、 妊婦とは15日間別室とする。
RMP【重要な特定されたリスク】
プルヴィクト ®RMP : 医薬品リスク管理計画書
- 骨髄抑制
- 腎機能障害
出典
- ノバルティスファーマ株式会社. プルヴィクト静注 電子添文情報 2025年 9 月作成 第1版.
- ノバルティスファーマ株式会社. プルヴィクト静注 医薬品インタビューフォーム 2025年 9 月作成 第1版.
- N Engl J Med. 2021;385(12):1091-1103.
最終更新 : 2025年10月6日
執筆 : HOKUTO編集部がん専門・指導薬剤師
監修医師 : HOKUTO編集部 医師
Lutetium-177 vipivotide tetraxetan (Lu-177)
「PSMA陽性の遠隔転移を有する去勢抵抗性前立腺癌(mCRPC)」 を対象とし製造販売承認を申請し、 2025年9月19日に正式承認。 PSMAのPETイメージングのためのロカメッツ®キットおよびガリアファーム®⁶⁸Ge/⁶⁸Gaジェネレータをセットで用いる。
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
プルヴィクト® (ルテチウムビピボチドテトラキセタン : Lu-177)
*ノバルティスファーマ株式会社の製品サイトに遷移します
投与スケジュール
【1コース】 6週間
【催吐性】 低リスク*
【FN発症】 低リスク**
*NCCN Guidelines Version 2.2025 Antiemesisを基に記載
**VISION試験³⁾のFN発生率0.2%を基に編集部が分類

1回7.4GBqを6週間間隔で最大6回静脈内投与
以下のいずれかの方法で投与²⁾

Key Data|臨床試験結果
📊 VISION試験
N Engl J Med. 2021;385(12):1091-1103.
少なくとも1種類のアンドロゲン受容体経路阻害薬および1~2種類のタキサン系レジメンによる治療歴を有するPSMA陽性mCRPC 831例を対象とした第III相無作為化比較試験。 Lu-177+標準治療群551例、 標準治療単独群280例に割り付け、 主要評価項目は画像診断に基づく無増悪生存期間 (rPFS) とOSとされた。
*標準治療はアビラテロンやエンザルタミドなど承認済みホルモン治療薬、 ビスホスホネート、 放射線治療、 デノスマブ、 任意量のグルココルチコイドが許可され、 一方で細胞障害性化学療法、 Ra-223など全身用放射性同位元素、 免疫療法、 当時治験薬であった薬剤は禁忌とされた。
【有効性】¹⁷⁷Lu-PSMA-617群 (vs 対照群)
- OS中央値 15.3ヵ月 (vs 11.3ヵ月)
- HR 0.62 (95%CI 0.52–0.74、 p<0.001)
- rPFS中央値 8.7ヵ月 (vs 3.4ヵ月)
- HR 0.40 (99.2%CI 0.29–0.57、 p<0.001)
- 奏効率 29.8% (vs 1.7%)
- PSA反応率 (≧50%低下) 46% (vs 7%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 疲労 43.1% (5.9%)
- 口内乾燥 38.8% (0%)
- 悪心 35.3% (1.3%)
- 貧血 31.8% (12.9%)
- 背部痛 23.4% (3.2%)
- 関節痛 22.3% (1.1%)
- 食欲減退 21.2% (1.9%)
- 便秘 20.2% (1.1%)
- 下痢 18.9% (0.8%)
- 嘔吐 18.9% (0.9%)
- 血小板減少 17.2% (7.9%)
- リンパ球減少 14.2% (7.8%)
- 白血球減少 12.5% (2.5%)
各プロトコル
適格基準
VISION試験³⁾の主な適格基準 :
- 18歳以上
- ECOG PS 0–2
- 白血球≧2,500/μL、 又は好中球≧1,500/μL
- 血小板≧10万/μL
- ヘモグロビン≧9.0g/dL
- 肝機能 : T-Bil≦1.5×ULN、 AST/ALT≦3.0×ULN
- 腎機能 : Cre≦1.5×ULN 又はCrCl≧50mL/min
- 少なくとも1つの新規アンドロゲン軸薬 (NAAD) および1つ又は2つのタキサン系レジメンによる既治療歴あり
用量レベル

VISION試験³⁾では、 減量は1回のみ許可され再増量は不可であり、 追加の減量が必要な毒性が出た場合や有害事象による投与遅延が4週間を超える場合は治療を中止するとされた。
有害事象発現時の減量・休薬・中止基準

プルヴィクト®電子添文情報¹⁾を基に編集部作成
VISION試験³⁾では、 その他の有害事象への対応方法は以下のとおり定められていた。

VISION試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
本放射性リガンド療法 (RLT) は、 特定の医療機関でのみ実施可能である。
ノバルティスファーマ株式会社の製品サイトに遷移します
本レジメンの位置付け
新規アンドロゲン受容体シグナル阻害薬 (ARSI) 治療歴を有するPSMA陽性mCRPCが適応。
アビラテロン、 エンザルタミド、 アパルタミド、 ダロルタミド未治療患者での有効性・安全性は確立していない。 タキサン系抗癌薬未治療の場合は、 その治療実施を慎重に検討し、 適応を選択する。
作用機序の特徴
Lu-177は、 PSMA高親和性のビピボチドテトラキセタンをLu-177で標識した放射性リガンド治療薬である。 PSMA高発現を示す去勢抵抗性前立腺癌などに結合後、 エンドサイトーシスを介して腫瘍細胞内に取り込まれ、 Lu-177から放出されるベータ線によりDNA損傷を誘発し、 腫瘍増殖を抑制する。 Lu-177のベータ線は正常組織への影響を抑えつつ、 腫瘍を効率的に照射する。
レジメン適用時の注意事項
骨髄抑制 : 投与開始前及び投与中は定期的に血液検査を行い、 状態を十分に確認
腎機能障害 : 投与開始前および投与中に定期的な腎機能検査で状態を確認し、 投与前後には水分補給と排尿を促す
放射線防護
以下、 FDA添付文書情報を基に編集部作成
医療従事者の防護 : 放射性医薬品であるため、 鉛シールド・鉛ガラスシリンジシールド・防護手袋を必ず使用し、 被曝を最小化する
患者指導のポイント :
- 水分摂取と頻回排尿を促し膀胱被曝を低減
- 投与後2日間は家庭内で1m未満の近接接触を回避
- 小児および妊婦との接触は7日間制限
- 性行為は7日間禁止
- 同居人との就寝は別室とし、 以下を遵守
同居人とは3日間、 子どもとは7日間、 妊婦とは15日間別室とする。
RMP【重要な特定されたリスク】
プルヴィクト ®RMP : 医薬品リスク管理計画書
- 骨髄抑制
- 腎機能障害
出典
- ノバルティスファーマ株式会社. プルヴィクト静注 電子添文情報 2025年 9 月作成 第1版.
- ノバルティスファーマ株式会社. プルヴィクト静注 医薬品インタビューフォーム 2025年 9 月作成 第1版.
- N Engl J Med. 2021;385(12):1091-1103.
最終更新 : 2025年10月6日
執筆 : HOKUTO編集部がん専門・指導薬剤師
監修医師 : HOKUTO編集部 医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。