RUX:ルキソリチニブ(ジャカビ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1回20mg 1日2回で開始 経口 | MF:骨髄線維症 | Day 1~ |
| 1回10mg 1日2回で開始 経口 | PV:真性多血症 | Day 1~ |
その他
| ジャカビ®錠には5mgと10mgの錠剤がある. |
| 開始用量は疾患、 血小板数、 患者状態により異なる. |
| 血小板数5万~10万未満のPV患者への開始用量の情報は得られていないため、 投与の可否を慎重に検討し、 低用量から投与を開始する. |
| 増量する場合は5mgずつ、 2週間以上の間隔を空ける. |
| 用量は1回25mg1日2回が最大. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「ノバルティス ファーマ株式会社」 の外部サイトへ遷移します.
主な有害事象
MF:骨髄線維症
COMFORT-I試験¹⁾より引用
【骨髄抑制】
- ヘモグロビン減少(96.1%、 ≧Grade3 45.2%)
- 血小板数減少・血小板減少症(69.7%、 ≧Grade3 12.9%)
- 好中球数減少(18.7%、 ≧Grade3 7.1%)
【主な有害事象】
- 疲労・倦怠感(25.2%、 ≧Grade3 5.2%)
- 下痢(23.2%、 ≧Grade3 1.9%)
- 末梢性浮腫(18.7%、 ≧Grade3 0%)
- 斑状出血(18.7%、 ≧Grade3 0%)
- 呼吸困難(17.4%、 ≧Grade3 1.3%)
- めまい(14.8%、 ≧Grade3 1.3%)
- 嘔気(12.3%、 ≧Grade3 0%)
- 頭痛(14.8%、 ≧Grade3 0%)
- 便秘(12.9%、 ≧Grade3 0%)
- 嘔吐(12.3%、 ≧Grade3 1.3%)
- 四肢痛(12.3%、 ≧Grade3 1.3%)
- 不眠症(11.6%、 ≧Grade3 0%)
- 関節痛(11.0%、 ≧Grade3 1.9%)
- 発熱(11.0%、 ≧Grade3 1.3%)
- 腹痛(10.3%、 ≧Grade3 5.2%)
PV:真性多血症
RESPONSE試験²⁾より引用
【骨髄抑制】
- 貧血(43.6%、 ≧Grade3 1.8%)
- 血小板減少症(24.5%、 ≧Grade3 5.5%)
- リンパ球減少症(43.6%、 ≧Grade3 16.4%)
- 白血球減少症(9.1%、 ≧Grade3 0.9%)
- 好中球減少症(1.8%、 ≧Grade3 0.9%)
【主な有害事象】
- 頭痛(16.4%、 ≧Grade3 0.9%)
- 下痢(14.5%、 ≧Grade3 0%)
- 疲労・倦怠感(14.5%、 ≧Grade3 0%)
- 掻痒感(13.6%、 ≧Grade3 0.9%)
- めまい(11.8%、 ≧Grade3 0%)
- 筋攣縮(11.8%、 ≧Grade3 0.9%)
- 呼吸困難(10.0%、 ≧Grade3 2.7%)
【その他重要な有害事象】
適正使用ガイドより引用
- 感染症(MF:11.0%、 ≧Grade3 2.0%)、 (PV:9.1%、 ≧Grade3 0.9%)
- 出血(MF:8.0%、 ≧Grade3 0.7%)、 (PV:3.6%、 ≧Grade3 0%)
- 肝機能障害(MF:2.3%、 ≧Grade3 0.7%)、 (PV:5.5%、 ≧Grade3 2.7%)
- 高血圧(MF:1.3%、 ≧Grade3 0%)、 (PV:1.8%、 ≧Grade3 0%)
- 進行性多巣性白質脳症 (頻度不明)
- 間質性肺疾患(頻度不明)
- 心不全(頻度不明)
特徴と注意点
- CYP3A4関連の相互作用に注意.
- 肝障害および腎障害患者では減量を考慮.
- 緊急時を除き、 投与中止時には漸減を行う.
MF:骨髄線維症
- 同種造血幹細胞移植適応外のMFに対する第一選択薬.
- 中~高リスクMF患者の脾腫・臨床症状を軽減し、OSを改善させる.
- 血小板数と好中球数に応じて用量調節.
MF患者における減量・休薬基準
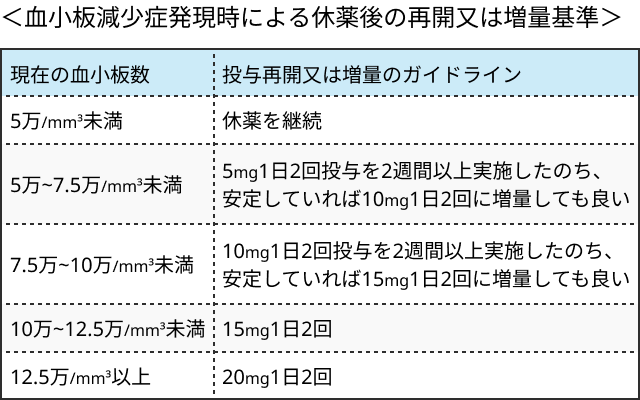

PV:真性多血症
- ヒドロキシウレア不耐・抵抗性例に用いる.
- ヘモグロビン値、 血小板数、 好中球数に応じて用量調節.
PV患者における減量・休薬基準
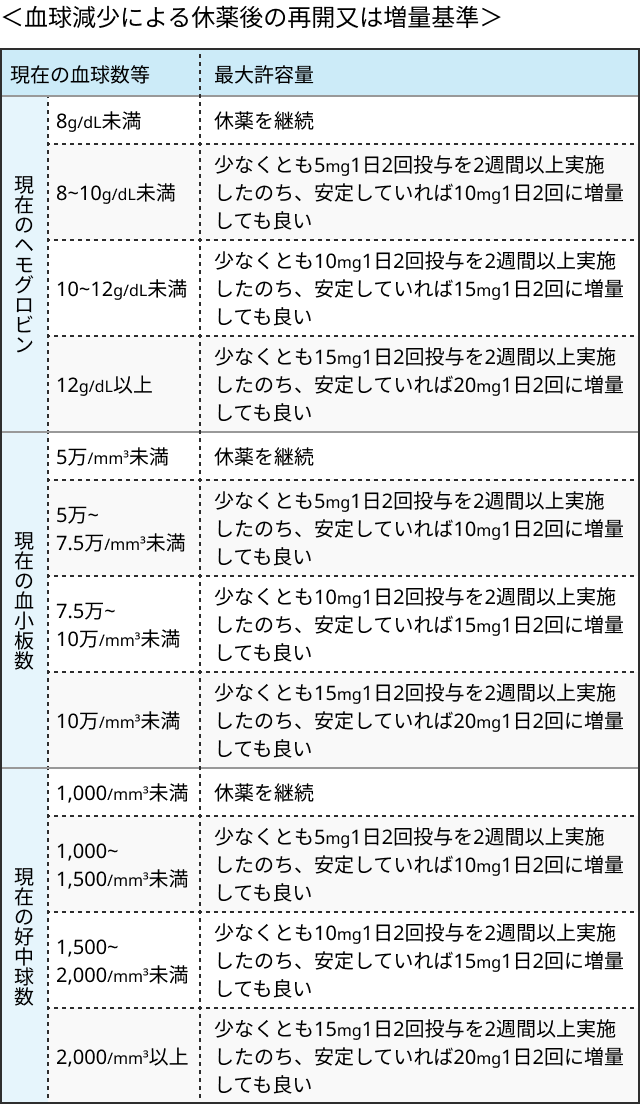
関連する臨床試験の結果
COMFORT-I試験 (351試験)¹⁾
中リスクまたは高リスクの骨髄線維症の患者309例を対象に、 ルキソリチニブの有効性を、 プラセボを対照に検討した国際共同二重盲検無作為化プラセボ対照第3相試験
24週までの35%以上の脾臓容積減少達成率
- ルキソリチニブ群 41.9%
- プラセボ群 0.7%
RESPONSE試験 (B2301試験)²⁾
脾腫を伴う瀉血が必要な真性多血症患者222例を対象に、 ルキソリチニブの有効性を既存の標準治療.を対照に検討した国際共同無作為化非盲検第3相試験
24週までの脾臓容積35%以上減少とHt値のコントロール両方ができた患者割合
- ルキソリチニブ群 20.9%
- 既存の標準治療群 0.9%
参考文献
1. N Engl J Med . 2012 Mar 1;366(9):799-807.
2. N Engl J Med. 2015 Jan 29;372(5):426-35.
最終更新:2023年8月2日
監修医師:東海大学血液腫瘍内科 扇屋大輔
Ruxolitinib
RUX:ルキソリチニブ(ジャカビ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1回20mg 1日2回で開始 経口 | MF:骨髄線維症 | Day 1~ |
| 1回10mg 1日2回で開始 経口 | PV:真性多血症 | Day 1~ |
その他
| ジャカビ®錠には5mgと10mgの錠剤がある. |
| 開始用量は疾患、 血小板数、 患者状態により異なる. |
| 血小板数5万~10万未満のPV患者への開始用量の情報は得られていないため、 投与の可否を慎重に検討し、 低用量から投与を開始する. |
| 増量する場合は5mgずつ、 2週間以上の間隔を空ける. |
| 用量は1回25mg1日2回が最大. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「ノバルティス ファーマ株式会社」 の外部サイトへ遷移します.
主な有害事象
MF:骨髄線維症
COMFORT-I試験¹⁾より引用
【骨髄抑制】
- ヘモグロビン減少(96.1%、 ≧Grade3 45.2%)
- 血小板数減少・血小板減少症(69.7%、 ≧Grade3 12.9%)
- 好中球数減少(18.7%、 ≧Grade3 7.1%)
【主な有害事象】
- 疲労・倦怠感(25.2%、 ≧Grade3 5.2%)
- 下痢(23.2%、 ≧Grade3 1.9%)
- 末梢性浮腫(18.7%、 ≧Grade3 0%)
- 斑状出血(18.7%、 ≧Grade3 0%)
- 呼吸困難(17.4%、 ≧Grade3 1.3%)
- めまい(14.8%、 ≧Grade3 1.3%)
- 嘔気(12.3%、 ≧Grade3 0%)
- 頭痛(14.8%、 ≧Grade3 0%)
- 便秘(12.9%、 ≧Grade3 0%)
- 嘔吐(12.3%、 ≧Grade3 1.3%)
- 四肢痛(12.3%、 ≧Grade3 1.3%)
- 不眠症(11.6%、 ≧Grade3 0%)
- 関節痛(11.0%、 ≧Grade3 1.9%)
- 発熱(11.0%、 ≧Grade3 1.3%)
- 腹痛(10.3%、 ≧Grade3 5.2%)
PV:真性多血症
RESPONSE試験²⁾より引用
【骨髄抑制】
- 貧血(43.6%、 ≧Grade3 1.8%)
- 血小板減少症(24.5%、 ≧Grade3 5.5%)
- リンパ球減少症(43.6%、 ≧Grade3 16.4%)
- 白血球減少症(9.1%、 ≧Grade3 0.9%)
- 好中球減少症(1.8%、 ≧Grade3 0.9%)
【主な有害事象】
- 頭痛(16.4%、 ≧Grade3 0.9%)
- 下痢(14.5%、 ≧Grade3 0%)
- 疲労・倦怠感(14.5%、 ≧Grade3 0%)
- 掻痒感(13.6%、 ≧Grade3 0.9%)
- めまい(11.8%、 ≧Grade3 0%)
- 筋攣縮(11.8%、 ≧Grade3 0.9%)
- 呼吸困難(10.0%、 ≧Grade3 2.7%)
【その他重要な有害事象】
適正使用ガイドより引用
- 感染症(MF:11.0%、 ≧Grade3 2.0%)、 (PV:9.1%、 ≧Grade3 0.9%)
- 出血(MF:8.0%、 ≧Grade3 0.7%)、 (PV:3.6%、 ≧Grade3 0%)
- 肝機能障害(MF:2.3%、 ≧Grade3 0.7%)、 (PV:5.5%、 ≧Grade3 2.7%)
- 高血圧(MF:1.3%、 ≧Grade3 0%)、 (PV:1.8%、 ≧Grade3 0%)
- 進行性多巣性白質脳症 (頻度不明)
- 間質性肺疾患(頻度不明)
- 心不全(頻度不明)
特徴と注意点
- CYP3A4関連の相互作用に注意.
- 肝障害および腎障害患者では減量を考慮.
- 緊急時を除き、 投与中止時には漸減を行う.
MF:骨髄線維症
- 同種造血幹細胞移植適応外のMFに対する第一選択薬.
- 中~高リスクMF患者の脾腫・臨床症状を軽減し、OSを改善させる.
- 血小板数と好中球数に応じて用量調節.
MF患者における減量・休薬基準


PV:真性多血症
- ヒドロキシウレア不耐・抵抗性例に用いる.
- ヘモグロビン値、 血小板数、 好中球数に応じて用量調節.
PV患者における減量・休薬基準

関連する臨床試験の結果
COMFORT-I試験 (351試験)¹⁾
中リスクまたは高リスクの骨髄線維症の患者309例を対象に、 ルキソリチニブの有効性を、 プラセボを対照に検討した国際共同二重盲検無作為化プラセボ対照第3相試験
24週までの35%以上の脾臓容積減少達成率
- ルキソリチニブ群 41.9%
- プラセボ群 0.7%
RESPONSE試験 (B2301試験)²⁾
脾腫を伴う瀉血が必要な真性多血症患者222例を対象に、 ルキソリチニブの有効性を既存の標準治療.を対照に検討した国際共同無作為化非盲検第3相試験
24週までの脾臓容積35%以上減少とHt値のコントロール両方ができた患者割合
- ルキソリチニブ群 20.9%
- 既存の標準治療群 0.9%
参考文献
1. N Engl J Med . 2012 Mar 1;366(9):799-807.
2. N Engl J Med. 2015 Jan 29;372(5):426-35.
最終更新:2023年8月2日
監修医師:東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

