本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗PD-1モノクローナル抗体 ペムブロリズマブ
*MSD製薬の外部サイトへ遷移します
投与スケジュール
【1コース】21日 or 42日
【催吐性】 最小度催吐性
【FN発症】低リスク
1コース21日間 (3週間ごと投与の場合)
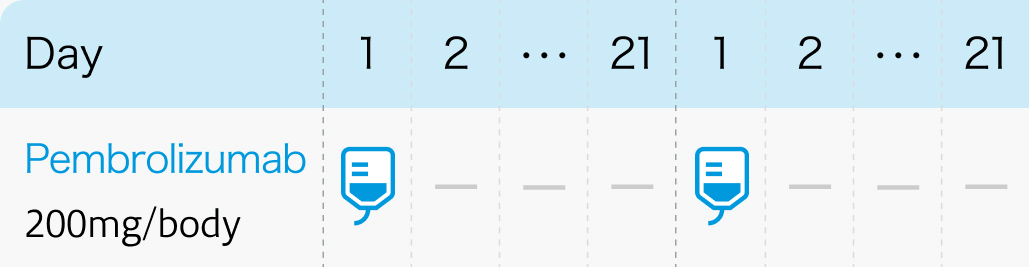
1コース42日間 (6週間ごと投与の場合)
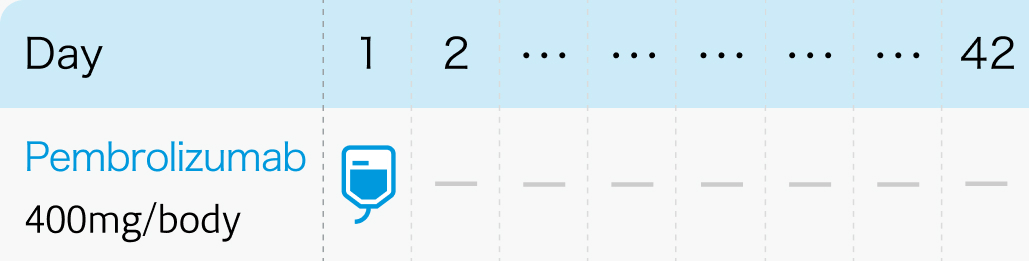
白金系抗悪性腫瘍剤を含む化学療法の適応とならない化学療法未治療患者への本剤単独投与については、 他の治療の実施についても慎重に検討すること。
キイトルーダ®添付文書(2024年12月改訂 第22版)より引用
特徴と注意点
2次治療の適応について
プラチナ併用化学療法4-6サイクル後にPDであった症例あるいは、 周術期のプラチナ併用化学療法後12か月以内に増悪した症例で使用する。
1次治療の適応について
Pembrolizumab単剤療法は、 化学療法歴のないシスプラチンを含む化学療法に不適格の根治切除不能な尿路上皮がん患者370例を対象とした海外第2相試験KEYNOTE-052試験²⁾などの結果に基づいて、 尿路上皮癌の1次治療にも2024年9月24日に承認されている。 なお、同日にエンホルツマブ ベドチン (パドセブ®)との併用療法も承認されている。
なお、 KEYNOTE-052試験は30<CCr<60ml/min、 PS 2、 難聴/末梢神経障害/心不全の3因子のうち少なくとも1因子を有するシスプラチン不耐の局所進行/転移性尿路上皮がんの患者を対象に行われた、 単群第II相試験である。
添付文書には 「ほかの治療の実施についても慎重に検討すること」 とあり、 EV+Pembro療法やGEM+CBDCA療法の検討も促されている。 なお、 Pembroなどの免疫チェックポイント阻害薬の腎機能障害患者に対する推奨は、 透析患者においても 「行うことを弱く推奨する」 (がん薬物療法時の腎障害診療ガイドライン2022) とされている。
KeyData|臨床試験結果
2次治療|KEYNOTE-045試験¹⁾
N Engl J Med. 2017;376(11):1015-26.
プラチナ製剤併用化学療法後に再発または進行した局所進行性または転移性の尿路上皮癌患者において、抗PD-1抗体ペムブロリズマブ投与の効果を、 化学療法群を対照に検証した国際第Ⅲ相比較試験
【有効性】ペムブロリズマブ群
- mOS (全集団) : 10.1ヵ月
- mOS (PD-L1高発現) : 8.0 ヵ月
- OS率 (1年時、 2年時、 3年時、 4年時)
44.2%、 26.9%、 20.7%、 16.7%
- mPFS (全集団) : 2.1ヵ月
- ORR (全集団) : 21.9%
- mDOR (全集団) : 29.7ヵ月
【安全性】ペムブロリズマブ群 主な有害事象
- 貧血 3.4% (Grade 3.4 0.8%)
- 好中球減少 0.4% (0.4%)
- 白血球減少 0.4% (0.4%)
- 疲労 13.9% (1.1%)
- 悪心 10.9% (0.4%)
- 下痢 9.0% (1.1%)
- 食欲減退 8.6% (0%)
- 発熱 6.4% (0%)
- 無力症 5.6% (0.4%)
- 嘔吐 4.5% (0%)
- 便秘 2.3% (0%)
- 末梢性ニューロパチー 0.4% (0%)
- 末梢性感覚ニューロパチー 0.8% (0%)
1次治療|KEYNOTE-052試験²⁾
Lancet Oncol. 2017 ;18(11):1483-92.
化学療法歴のないシスプラチンを含む化学療法に不適格の根治切除不能な尿路上皮がん患者370例を対象とした海外第2相試験。 主要評価項目はORRであった。
【有効性】ペムブロリズマブ群
- ORR 28.6% [主要評価項目]
CR 8.9%、 PR19.7%
【安全性】ペムブロリズマブ群
- 解析対象例370例中249例 (67.3%) に副作用
- 主な副作用 (10%以上)
- 疲労67例 (18.1%)
- そう痒症66例 (17.8%)
- 発疹43例 (11.6%)
- 食欲減退40例 (10.8%)
- 甲状腺機能低下症37例 (10.0%)
各プロトコル
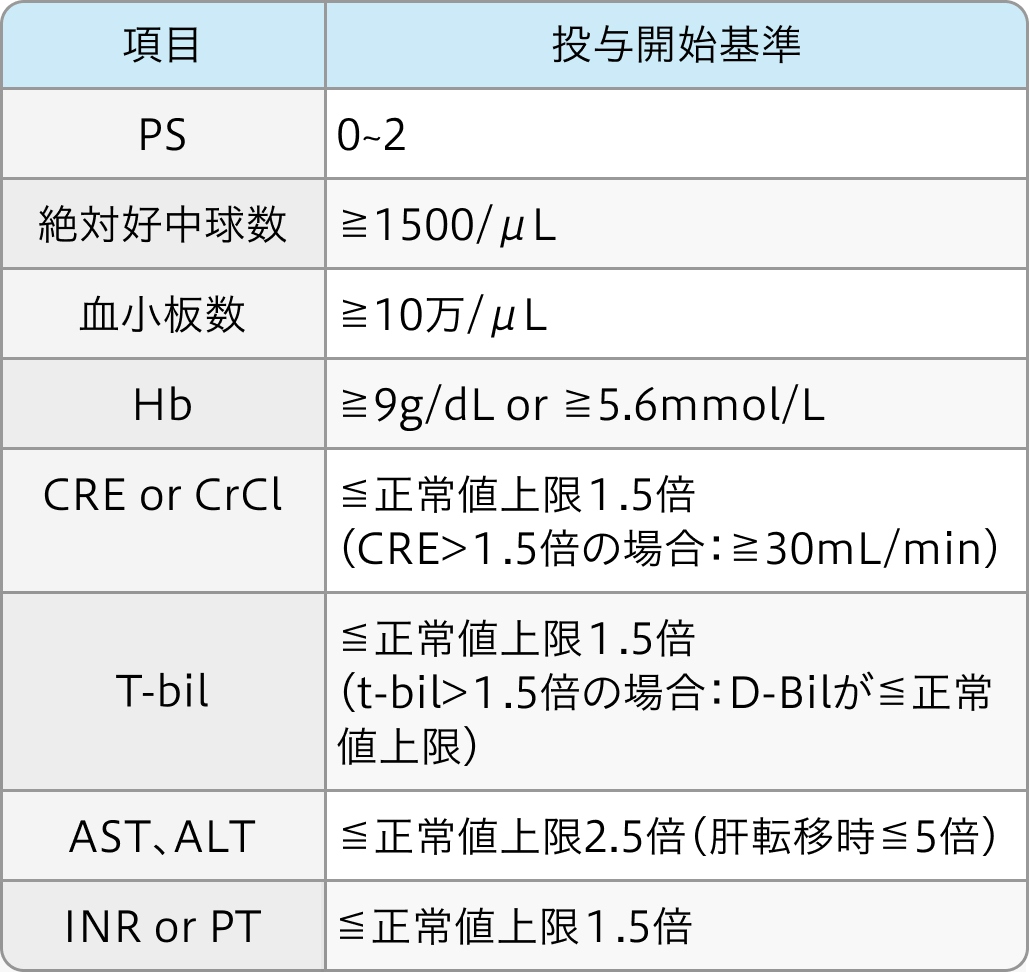
投与開始基準
KEYNOTE 045試験¹⁾の基準 (抜粋)
局所進行性または転移性の膀胱癌の組織学的または細胞学的診断ある18歳以上の患者で以下を満たすもの
休薬・中止・減量基準
添付文書より 効能共通

出典
最終更新日 : 2025年1月8日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
Pembrolizumab
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗PD-1モノクローナル抗体 ペムブロリズマブ
*MSD製薬の外部サイトへ遷移します
投与スケジュール
【1コース】21日 or 42日
【催吐性】 最小度催吐性
【FN発症】低リスク
1コース21日間 (3週間ごと投与の場合)

1コース42日間 (6週間ごと投与の場合)

白金系抗悪性腫瘍剤を含む化学療法の適応とならない化学療法未治療患者への本剤単独投与については、 他の治療の実施についても慎重に検討すること。
キイトルーダ®添付文書(2024年12月改訂 第22版)より引用
特徴と注意点
2次治療の適応について
プラチナ併用化学療法4-6サイクル後にPDであった症例あるいは、 周術期のプラチナ併用化学療法後12か月以内に増悪した症例で使用する。
1次治療の適応について
Pembrolizumab単剤療法は、 化学療法歴のないシスプラチンを含む化学療法に不適格の根治切除不能な尿路上皮がん患者370例を対象とした海外第2相試験KEYNOTE-052試験²⁾などの結果に基づいて、 尿路上皮癌の1次治療にも2024年9月24日に承認されている。 なお、同日にエンホルツマブ ベドチン (パドセブ®)との併用療法も承認されている。
なお、 KEYNOTE-052試験は30<CCr<60ml/min、 PS 2、 難聴/末梢神経障害/心不全の3因子のうち少なくとも1因子を有するシスプラチン不耐の局所進行/転移性尿路上皮がんの患者を対象に行われた、 単群第II相試験である。
添付文書には 「ほかの治療の実施についても慎重に検討すること」 とあり、 EV+Pembro療法やGEM+CBDCA療法の検討も促されている。 なお、 Pembroなどの免疫チェックポイント阻害薬の腎機能障害患者に対する推奨は、 透析患者においても 「行うことを弱く推奨する」 (がん薬物療法時の腎障害診療ガイドライン2022) とされている。
KeyData|臨床試験結果
2次治療|KEYNOTE-045試験¹⁾
N Engl J Med. 2017;376(11):1015-26.
プラチナ製剤併用化学療法後に再発または進行した局所進行性または転移性の尿路上皮癌患者において、抗PD-1抗体ペムブロリズマブ投与の効果を、 化学療法群を対照に検証した国際第Ⅲ相比較試験
【有効性】ペムブロリズマブ群
- mOS (全集団) : 10.1ヵ月
- mOS (PD-L1高発現) : 8.0 ヵ月
- OS率 (1年時、 2年時、 3年時、 4年時)
44.2%、 26.9%、 20.7%、 16.7%
- mPFS (全集団) : 2.1ヵ月
- ORR (全集団) : 21.9%
- mDOR (全集団) : 29.7ヵ月
【安全性】ペムブロリズマブ群 主な有害事象
- 貧血 3.4% (Grade 3.4 0.8%)
- 好中球減少 0.4% (0.4%)
- 白血球減少 0.4% (0.4%)
- 疲労 13.9% (1.1%)
- 悪心 10.9% (0.4%)
- 下痢 9.0% (1.1%)
- 食欲減退 8.6% (0%)
- 発熱 6.4% (0%)
- 無力症 5.6% (0.4%)
- 嘔吐 4.5% (0%)
- 便秘 2.3% (0%)
- 末梢性ニューロパチー 0.4% (0%)
- 末梢性感覚ニューロパチー 0.8% (0%)
1次治療|KEYNOTE-052試験²⁾
Lancet Oncol. 2017 ;18(11):1483-92.
化学療法歴のないシスプラチンを含む化学療法に不適格の根治切除不能な尿路上皮がん患者370例を対象とした海外第2相試験。 主要評価項目はORRであった。
【有効性】ペムブロリズマブ群
- ORR 28.6% [主要評価項目]
CR 8.9%、 PR19.7%
【安全性】ペムブロリズマブ群
- 解析対象例370例中249例 (67.3%) に副作用
- 主な副作用 (10%以上)
- 疲労67例 (18.1%)
- そう痒症66例 (17.8%)
- 発疹43例 (11.6%)
- 食欲減退40例 (10.8%)
- 甲状腺機能低下症37例 (10.0%)
各プロトコル
投与開始基準
KEYNOTE 045試験¹⁾の基準 (抜粋)
局所進行性または転移性の膀胱癌の組織学的または細胞学的診断ある18歳以上の患者で以下を満たすもの

休薬・中止・減量基準
添付文書より 効能共通

出典
最終更新日 : 2025年1月8日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。