本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
チロシンキナーゼ阻害薬 カボザンチニブリンゴ酸塩錠
*武田薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾、CABOSUN試験²⁾の用法・用量
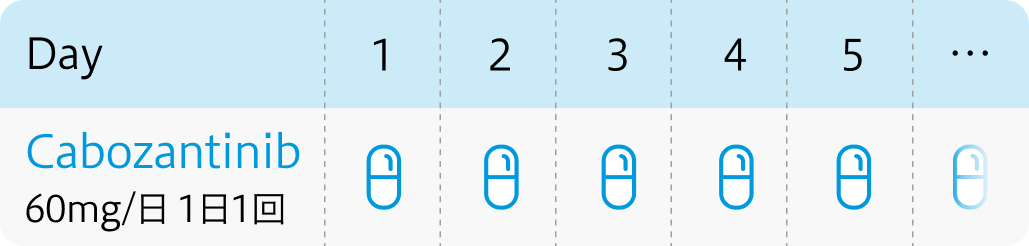
1日1回60mgを空腹時に経口投与する。 なお、 患者の状態により適宜減量する。
カボメティクス®電子添文 (2024年2月改訂 第7版)¹⁾、 J Clin Oncol. 2017 Feb 20;35(6):591-597²⁾より引用
特徴と注意点
1次治療 スニチニブとの比較
第Ⅱ相無作為化比較試験のCABOSUN試験において、 MSKCC分類のIntermediate-Poorリスク淡明細胞型腎細胞癌の1次治療に対して、 スニチニブとの比較も行われ、PFSでの成績改善があり保険承認となった²⁾。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
2次治療 エベロリムスとの比較
第Ⅲ相無作為化比較試験のMETEOR試験において、 血管新生阻害薬単剤治療後の2次治療に対してPFSの延長が示された³⁾。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
1次治療 CABOSUN試験²⁾
未治療の局所進行性または転移を有する淡明細胞型腎細胞癌患者において、 カボザンチニブの効果を、 スニチニブ単独療法を対照に検証した第Ⅱ相無作為化比較試験CABOSUNの結果より、 無増悪生存期間 (PFS) および奏効率 (ORR) に対する有益性が示された。
有効性|カボザンチニブ群
- mPFS : 8.6ヵ月 (95%CI 6.8-14.0ヵ月)
スニチニブ群:5.3ヵ月 (3.0-8.2ヵ月)
HR 0.48 (95%CI0.31-0.74)、 P=0.0008
- mOS : 26.6ヵ月 (14.6ヵ月-未到達)
エベロリムス群 21.2ヵ月 (16.3-27.4ヵ月)
HR 0.80 (95%CI 0.53-1.21)
- ORR : 20% (12.0-30.8%)
エベロリムス群 : 9% (3.7-17.6%)
安全性|主な有害事象 (カッコ内 Grade3~4)
- AST上昇 61.5% (2.6%)
- ALT上昇 55.1% (5.1%)
- 血小板数減少 39.7% (1.3%)
- 貧血 33.3% (1.3%)
- 好中球数減少 15.4% (0%)
- 白血球数減少 11.5% (0%)
- 倦怠感 85.9% (6.4%)
- 高血圧 80.8% (28.2%)
- 下痢 71.8% (10.3%)
- 口腔粘膜炎 35.9% (5.1%)
- 体重減少 32.1% (3.8%)
- 悪心 32.1% (2.6%)
J Clin Oncol. 2017 Feb 20;35(6):591-597²⁾より引用
>>臨床試験の詳細を見る
各プロトコル
投与開始基準
CABOSUN試験²⁾のプロトコル
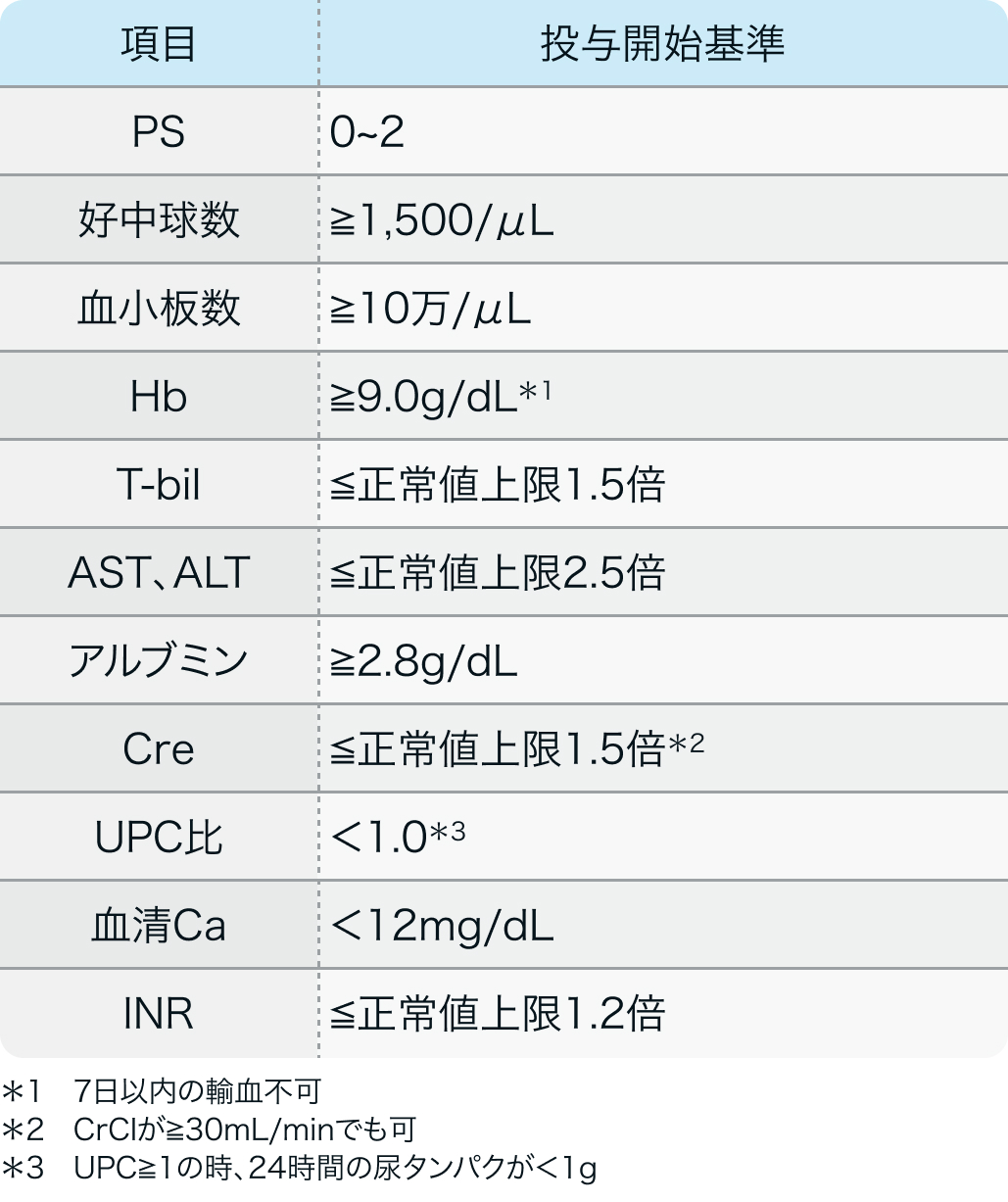
J Clin Oncol. 2017 Feb 20;35(6):591-597²⁾より作図
減量基準
CABOSUN試験²⁾のプロトコル
初回基準量と減量レベル
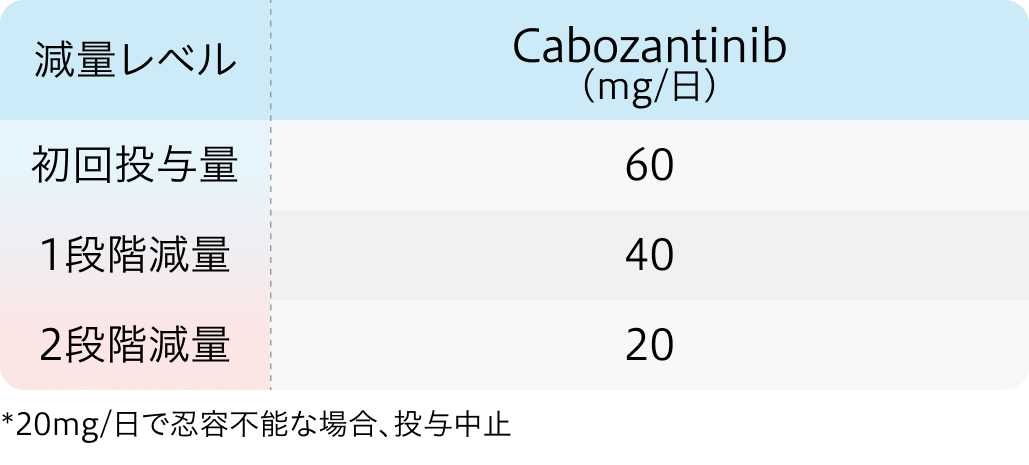
J Clin Oncol. 2017 Feb 20;35(6):591-597²⁾より作図
出典
1) 武田薬品工業株式会社. カボメティクス®電子添文 (2024年2月改訂 第7版) [最終閲覧:2024/11/26]
最終更新日:2024年11月26日
監修医師:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
Cabozantinib (一次治療以降)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
チロシンキナーゼ阻害薬 カボザンチニブリンゴ酸塩錠
*武田薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾、CABOSUN試験²⁾の用法・用量

1日1回60mgを空腹時に経口投与する。 なお、 患者の状態により適宜減量する。
カボメティクス®電子添文 (2024年2月改訂 第7版)¹⁾、 J Clin Oncol. 2017 Feb 20;35(6):591-597²⁾より引用
特徴と注意点
1次治療 スニチニブとの比較
第Ⅱ相無作為化比較試験のCABOSUN試験において、 MSKCC分類のIntermediate-Poorリスク淡明細胞型腎細胞癌の1次治療に対して、 スニチニブとの比較も行われ、PFSでの成績改善があり保険承認となった²⁾。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
2次治療 エベロリムスとの比較
第Ⅲ相無作為化比較試験のMETEOR試験において、 血管新生阻害薬単剤治療後の2次治療に対してPFSの延長が示された³⁾。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
1次治療 CABOSUN試験²⁾
未治療の局所進行性または転移を有する淡明細胞型腎細胞癌患者において、 カボザンチニブの効果を、 スニチニブ単独療法を対照に検証した第Ⅱ相無作為化比較試験CABOSUNの結果より、 無増悪生存期間 (PFS) および奏効率 (ORR) に対する有益性が示された。
有効性|カボザンチニブ群
- mPFS : 8.6ヵ月 (95%CI 6.8-14.0ヵ月)
スニチニブ群:5.3ヵ月 (3.0-8.2ヵ月)
HR 0.48 (95%CI0.31-0.74)、 P=0.0008
- mOS : 26.6ヵ月 (14.6ヵ月-未到達)
エベロリムス群 21.2ヵ月 (16.3-27.4ヵ月)
HR 0.80 (95%CI 0.53-1.21)
- ORR : 20% (12.0-30.8%)
エベロリムス群 : 9% (3.7-17.6%)
安全性|主な有害事象 (カッコ内 Grade3~4)
- AST上昇 61.5% (2.6%)
- ALT上昇 55.1% (5.1%)
- 血小板数減少 39.7% (1.3%)
- 貧血 33.3% (1.3%)
- 好中球数減少 15.4% (0%)
- 白血球数減少 11.5% (0%)
- 倦怠感 85.9% (6.4%)
- 高血圧 80.8% (28.2%)
- 下痢 71.8% (10.3%)
- 口腔粘膜炎 35.9% (5.1%)
- 体重減少 32.1% (3.8%)
- 悪心 32.1% (2.6%)
J Clin Oncol. 2017 Feb 20;35(6):591-597²⁾より引用
>>臨床試験の詳細を見る
各プロトコル
投与開始基準
CABOSUN試験²⁾のプロトコル

J Clin Oncol. 2017 Feb 20;35(6):591-597²⁾より作図
減量基準
CABOSUN試験²⁾のプロトコル
初回基準量と減量レベル

J Clin Oncol. 2017 Feb 20;35(6):591-597²⁾より作図
出典
1) 武田薬品工業株式会社. カボメティクス®電子添文 (2024年2月改訂 第7版) [最終閲覧:2024/11/26]
最終更新日:2024年11月26日
監修医師:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。