治療スケジュール
概要
監修医師
Pembro:Pembrolizumab(キイトルーダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/body (3週間間隔の場合) | 1~ | Day1 |
| 400mg/body (6週間間隔の場合) | 1~ | Day1 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
3週間間隔
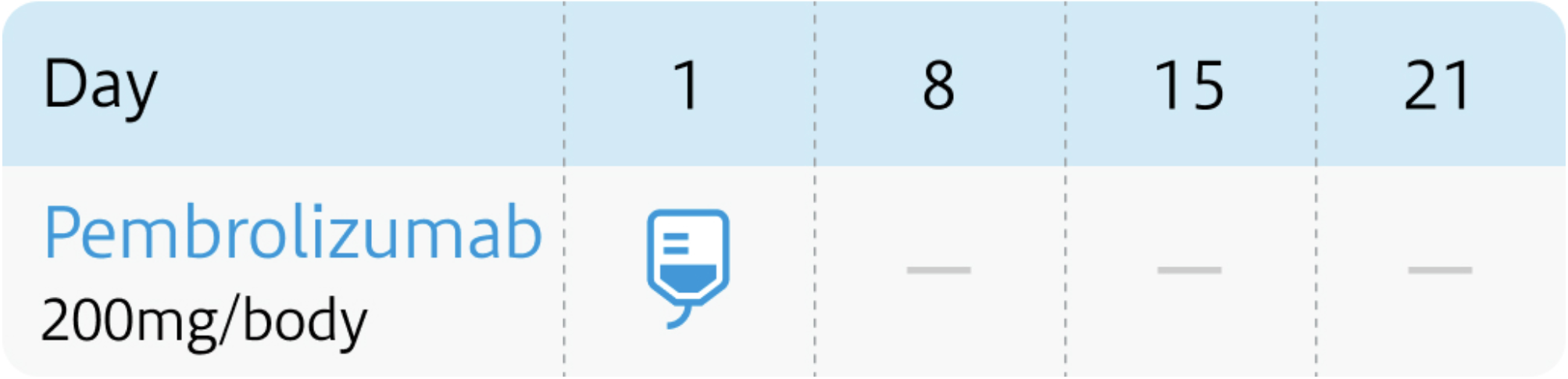
6週間間隔
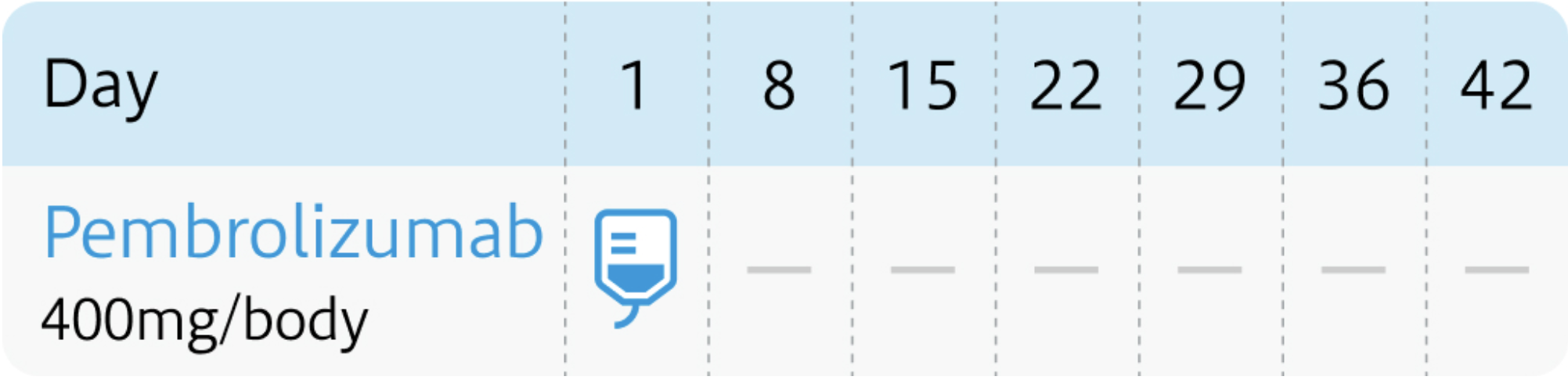
キイトルーダ®電子添文 (2024年1月改訂 第17版) ¹⁾より作図
投与開始基準
KEYNOTE-158試験³⁾のプロトコル
組織学的/細胞学的に確認された進行性の治癒不可能な非結腸直腸固形腫瘍を有し、 以前の標準治療で疾患が進行したか、 またはそれに対する不耐性を有する18歳以上の以下に当てはまる患者

J Clin Oncol. 2020 Jan 1;38(1):1-10.³⁾より作図
休薬・中止・減量基準
ペムブロリズマブ電子添文¹⁾の減量・休薬・中止基準

キイトルーダ®電子添文 (2024年1月改訂 第17版) ¹⁾より作図
主な有害事象
KEYNOTE-158試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 14.6% (0.9%)
- 下痢 12.0% (0%)
- 甲状腺機能低下症 8.2% (0%)
- 悪心 6.4% (0%)
J Clin Oncol. 2020 Jan 1;38(1):1-10.³⁾より引用
上手に使うためのワンポイント
- 免疫関連有害事象のマネージメントは基本的にはがん免疫療法ガイドラインを参考に行う⁴⁾。 日本における保険承認状況と異なることに留意が必要ではあるが、 ASCO⁵⁾やESMO⁶⁾のガイドラインも参考になる。
- 免疫関連有害事象の管理が最も重要である。 患者教育・多職種チーム医療はもちろん、 採血セットを作成する、 他科コンサルテーションのシステム作り、 患者にirAEを疑う症状が出現した際の相談部署・受診基準など院内のirAE対策システム作りが望ましい。 院内のみで完結できないケースが多々あると考えられるが、 地域の基幹病院とコンサルテーションできるシステム作りが望ましい。 様々な施設の取り組みが各製薬会社のHPで紹介されているため、 参考にしていただきたい。
- Pseudo progressionが一定数存在する。 CT上増悪を疑うような場合でも、 (明らかな増悪を除き) CTのみで増悪と判断せず、 腫瘍マーカーの変動、 臨床症状の変化など総合的に判断する。 担当医個人ではなく、 カンファレンスで検討することが望ましい。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 大腸癌治療ガイドラインでは、 MSI-H/dMMR大腸癌に対する1次治療の標準治療である⁷⁾。
- コンパニオン診断薬であるMSI検査やMMR検査は施設によっては外注検査になる。 他のバイオマーカー同様、 ルーチンでMSIまたはMMR検査を提出しておく。
- KEYNOTE-177試験³⁾でペムブロリズマブは主要評価項目の1つであるPFSにおいて、 従来の標準治療に対する優越性を示した⁸⁾⁹⁾。 しかしながら、 治療開始から4–8ヵ月においては、 ペムブロリズマブが標準治療を下回る傾向にあり、 早期不応例が一定数存在することに留意する。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
KEYNOTE-158試験³⁾
化学療法歴のある進行・再発のTMB-High固形癌患者におけるペムブロリズマブの有効性及び安全性を検討するための国際共同非無作為化非盲検複数コホート第Ⅱ相試験。 主要評価項目は奏効率 (ORR)、 副次評価項目は奏効期間 (DOR)、 無増悪生存期間 (PFS)、 全生存期間 (OS)、 安全性とされた。
J Clin Oncol. 2020 Jan 1;38(1):1-10.¹⁾
出典
- MSD製薬. キイトルーダ®電子添文 (2024年1月改訂 第17版) [最終閲覧 : 2024/04/16]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年3月作成) [最終閲覧 : 2024/04/16]
- Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol. 2020 Jan 1;38(1):1-10. PMID: 31682550
- がん免疫療法ガイドライン第3版. 日本臨床腫瘍学会編. 金原出版株式会社.
- Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol. 2021 Dec 20;39(36):4073-4126. PMID: 34724392
- Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Dec;33(12):1217-1238. PMID: 36270461
- 金原出版株式会社. 大腸癌治療ガイドライン医師用2022年版. 大腸癌研究会編
- Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol. 2022 May;23(5):659-670. PMID: 35427471
- Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med. 2020 Dec 3;383(23):2207-2218. PMID: 33264544
最終更新日 : 2024年4月16日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
Pembrolizumab
ペムブロリズマブ (キイトルーダ®) [大腸癌]
2024年04月26日更新
Pembro:Pembrolizumab(キイトルーダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/body (3週間間隔の場合) | 1~ | Day1 |
| 400mg/body (6週間間隔の場合) | 1~ | Day1 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
3週間間隔

6週間間隔

キイトルーダ®電子添文 (2024年1月改訂 第17版) ¹⁾より作図
投与開始基準
KEYNOTE-158試験³⁾のプロトコル
組織学的/細胞学的に確認された進行性の治癒不可能な非結腸直腸固形腫瘍を有し、 以前の標準治療で疾患が進行したか、 またはそれに対する不耐性を有する18歳以上の以下に当てはまる患者

J Clin Oncol. 2020 Jan 1;38(1):1-10.³⁾より作図
休薬・中止・減量基準
ペムブロリズマブ電子添文¹⁾の減量・休薬・中止基準

キイトルーダ®電子添文 (2024年1月改訂 第17版) ¹⁾より作図
主な有害事象
KEYNOTE-158試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 14.6% (0.9%)
- 下痢 12.0% (0%)
- 甲状腺機能低下症 8.2% (0%)
- 悪心 6.4% (0%)
J Clin Oncol. 2020 Jan 1;38(1):1-10.³⁾より引用
上手に使うためのワンポイント
- 免疫関連有害事象のマネージメントは基本的にはがん免疫療法ガイドラインを参考に行う⁴⁾。 日本における保険承認状況と異なることに留意が必要ではあるが、 ASCO⁵⁾やESMO⁶⁾のガイドラインも参考になる。
- 免疫関連有害事象の管理が最も重要である。 患者教育・多職種チーム医療はもちろん、 採血セットを作成する、 他科コンサルテーションのシステム作り、 患者にirAEを疑う症状が出現した際の相談部署・受診基準など院内のirAE対策システム作りが望ましい。 院内のみで完結できないケースが多々あると考えられるが、 地域の基幹病院とコンサルテーションできるシステム作りが望ましい。 様々な施設の取り組みが各製薬会社のHPで紹介されているため、 参考にしていただきたい。
- Pseudo progressionが一定数存在する。 CT上増悪を疑うような場合でも、 (明らかな増悪を除き) CTのみで増悪と判断せず、 腫瘍マーカーの変動、 臨床症状の変化など総合的に判断する。 担当医個人ではなく、 カンファレンスで検討することが望ましい。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 大腸癌治療ガイドラインでは、 MSI-H/dMMR大腸癌に対する1次治療の標準治療である⁷⁾。
- コンパニオン診断薬であるMSI検査やMMR検査は施設によっては外注検査になる。 他のバイオマーカー同様、 ルーチンでMSIまたはMMR検査を提出しておく。
- KEYNOTE-177試験³⁾でペムブロリズマブは主要評価項目の1つであるPFSにおいて、 従来の標準治療に対する優越性を示した⁸⁾⁹⁾。 しかしながら、 治療開始から4–8ヵ月においては、 ペムブロリズマブが標準治療を下回る傾向にあり、 早期不応例が一定数存在することに留意する。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
KEYNOTE-158試験³⁾
化学療法歴のある進行・再発のTMB-High固形癌患者におけるペムブロリズマブの有効性及び安全性を検討するための国際共同非無作為化非盲検複数コホート第Ⅱ相試験。 主要評価項目は奏効率 (ORR)、 副次評価項目は奏効期間 (DOR)、 無増悪生存期間 (PFS)、 全生存期間 (OS)、 安全性とされた。
J Clin Oncol. 2020 Jan 1;38(1):1-10.¹⁾
出典
- MSD製薬. キイトルーダ®電子添文 (2024年1月改訂 第17版) [最終閲覧 : 2024/04/16]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年3月作成) [最終閲覧 : 2024/04/16]
- Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol. 2020 Jan 1;38(1):1-10. PMID: 31682550
- がん免疫療法ガイドライン第3版. 日本臨床腫瘍学会編. 金原出版株式会社.
- Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol. 2021 Dec 20;39(36):4073-4126. PMID: 34724392
- Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Dec;33(12):1217-1238. PMID: 36270461
- 金原出版株式会社. 大腸癌治療ガイドライン医師用2022年版. 大腸癌研究会編
- Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol. 2022 May;23(5):659-670. PMID: 35427471
- Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med. 2020 Dec 3;383(23):2207-2218. PMID: 33264544
最終更新日 : 2024年4月16日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

