本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソテール®など (添付文書¹⁾)
タキサン系抗悪性腫瘍薬 ドセタキセル
投与スケジュール
【1コース】21~28日間
【催吐性】 軽度催吐性
電子添文¹⁾の用法および用量
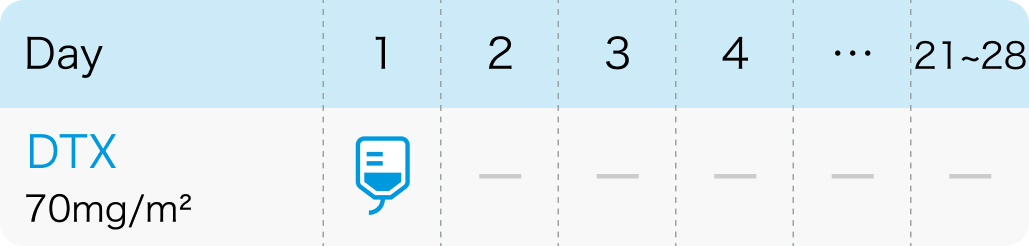
70mg/m²を1時間以上かけ3~4週間毎に点滴静注
タキソテール®電子添文 (2024年6月改訂第5版)¹⁾より作図、引用
前投薬・投与スケジュール例
- DEX 8.25mg+生食 50mL (30分)
- DTX 70mg/m²+生食 250mL (60分)
- 生食 50mL (全開投与)
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
💬DTXを使用する際には、 DEXを前投薬として投与することで、 蓄積毒性である浮腫を予防することができる
各プロトコル
投与開始基準
国内共同第Ⅱ相試験²⁾のプロトコル例
20~74歳で、 余命が3ヵ月を超え、 組織学的に原発性III期、 IV期または再発性の子宮内膜癌と診断されている下記に該当する患者
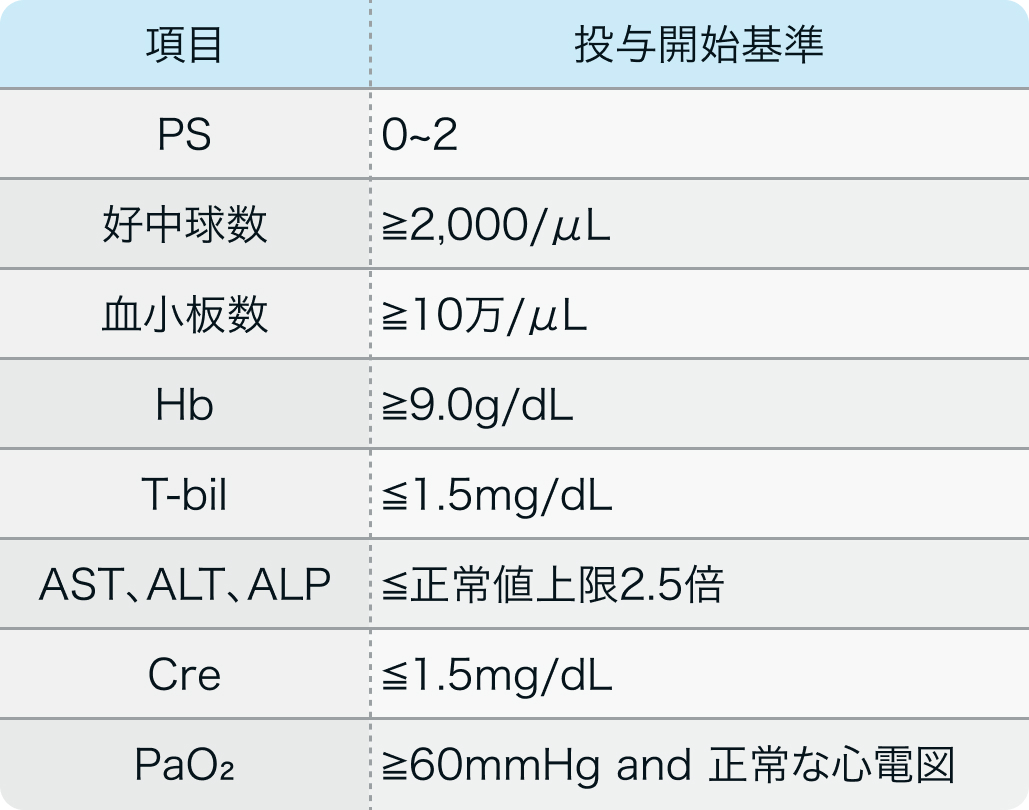
Br J Cancer. 2005 Oct 31;93(9):999-1004²⁾より作図
電子添文¹⁾の記載
子宮体癌。 術後補助化学療法における有効性及び安全性は確立されていない タキソテール®電子添文 (2023年7月改訂 第4版)¹⁾より引用
減量・休薬・中止基準
国内共同第Ⅱ相試験²⁾のプロトコル例
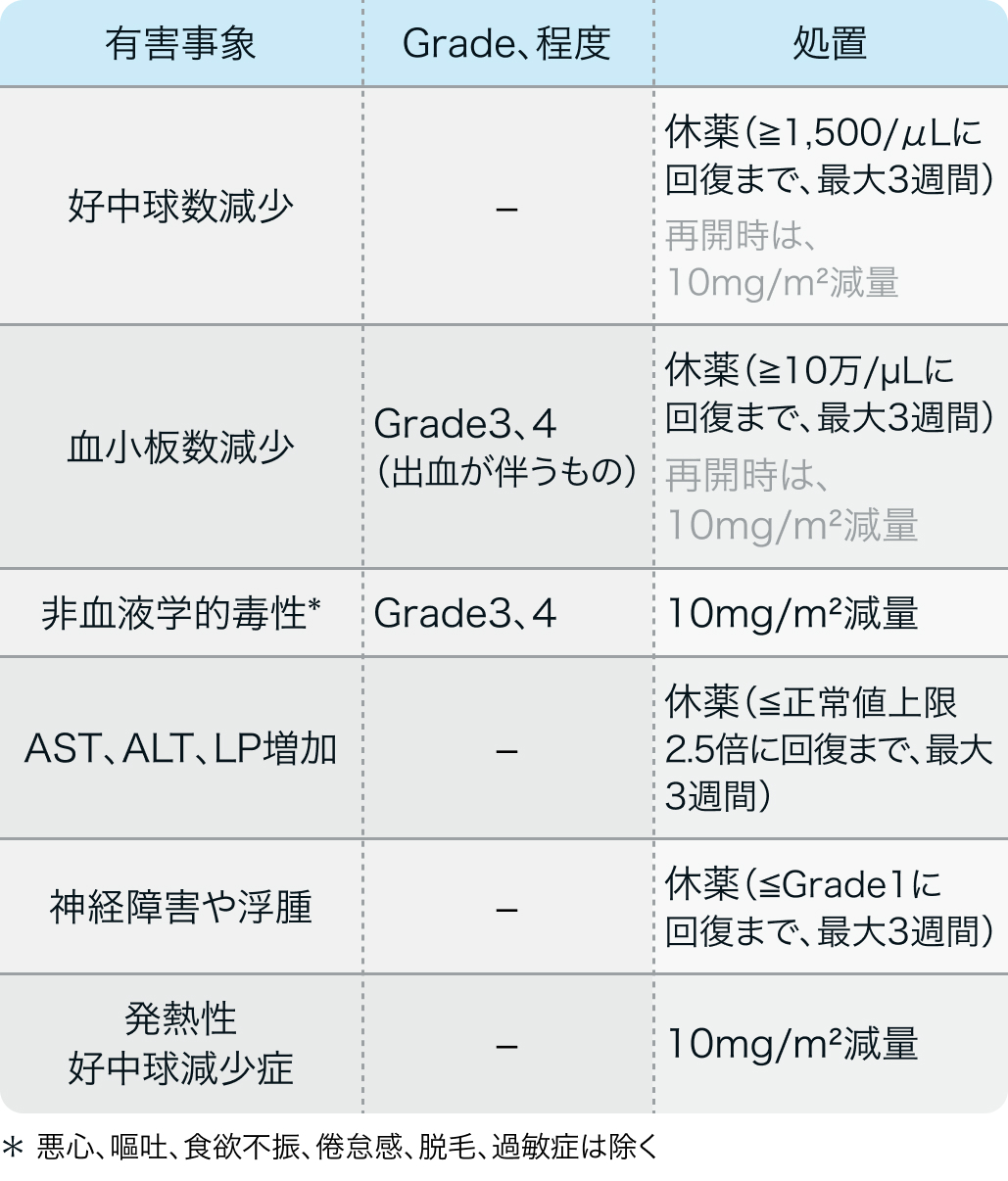
Br J Cancer. 2005 Oct 31;93(9):999-1004²⁾より作図
KeyData|臨床試験結果
国内共同第Ⅱ相試験²⁾
対象: 組織学的に確認された進行または再発子宮体癌患者33例
方法: DTX 70mg/m²を3週間ごとに投与
【有効性】
- ORR 31%
- TTP 3.9ヵ月
- mOS 17.8ヵ月
【安全性】主な有害事象 (カッコ内 Grade3~4)
- 好中球数減少 97.0% (93.9%)
- 脱毛症 93.9% (0%)
- Hb減少 72.7% (6.1%)
- 血小板数減少 21.2% (0%)
- 倦怠感 69.7% (9.1%)
- 嘔吐 39.4% (9.1%)
- 下痢 60.6% (9.1%)
- 便秘 48.5% (12.1%)
- 口内炎 27.3% (3.0%)
- 発熱性好中球減少症 18.2% (9.1%)
- AST増加 36.4% (0%)
- ALT増加 30.3% (0%)
Br J Cancer. 2005 Oct 31;93(9):999-1004²⁾より引用
エキスパートによるワンポイント
転移・再発後の2次治療として、 ドセタキセルは、 31% (95%CI 16.1-50.0%) の奏効率を示しています²⁾。
現在では、 レンバチニブ+ペムブロリズマブが2次治療の標準ですが、 何らかの理由で、 レンバチニブ+ペムブロリズマブが使用できない患者、 また、 3次治療 (全身状態の良い患者) の選択肢になるかと思われます。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
1) サノフィ株式会社. ワンタキソテール®電子添文 (2024年6月改訂第5版) [最終閲覧 : 2024/12/11]
最終更新日 : 2024年12月11日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
DTX
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソテール®など (添付文書¹⁾)
タキサン系抗悪性腫瘍薬 ドセタキセル
投与スケジュール
【1コース】21~28日間
【催吐性】 軽度催吐性
電子添文¹⁾の用法および用量

70mg/m²を1時間以上かけ3~4週間毎に点滴静注
タキソテール®電子添文 (2024年6月改訂第5版)¹⁾より作図、引用
前投薬・投与スケジュール例
- DEX 8.25mg+生食 50mL (30分)
- DTX 70mg/m²+生食 250mL (60分)
- 生食 50mL (全開投与)
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
💬DTXを使用する際には、 DEXを前投薬として投与することで、 蓄積毒性である浮腫を予防することができる
各プロトコル
投与開始基準
国内共同第Ⅱ相試験²⁾のプロトコル例
20~74歳で、 余命が3ヵ月を超え、 組織学的に原発性III期、 IV期または再発性の子宮内膜癌と診断されている下記に該当する患者

Br J Cancer. 2005 Oct 31;93(9):999-1004²⁾より作図
電子添文¹⁾の記載
子宮体癌。 術後補助化学療法における有効性及び安全性は確立されていない タキソテール®電子添文 (2023年7月改訂 第4版)¹⁾より引用
減量・休薬・中止基準
国内共同第Ⅱ相試験²⁾のプロトコル例

Br J Cancer. 2005 Oct 31;93(9):999-1004²⁾より作図
KeyData|臨床試験結果
国内共同第Ⅱ相試験²⁾
対象: 組織学的に確認された進行または再発子宮体癌患者33例
方法: DTX 70mg/m²を3週間ごとに投与
【有効性】
- ORR 31%
- TTP 3.9ヵ月
- mOS 17.8ヵ月
【安全性】主な有害事象 (カッコ内 Grade3~4)
- 好中球数減少 97.0% (93.9%)
- 脱毛症 93.9% (0%)
- Hb減少 72.7% (6.1%)
- 血小板数減少 21.2% (0%)
- 倦怠感 69.7% (9.1%)
- 嘔吐 39.4% (9.1%)
- 下痢 60.6% (9.1%)
- 便秘 48.5% (12.1%)
- 口内炎 27.3% (3.0%)
- 発熱性好中球減少症 18.2% (9.1%)
- AST増加 36.4% (0%)
- ALT増加 30.3% (0%)
Br J Cancer. 2005 Oct 31;93(9):999-1004²⁾より引用
エキスパートによるワンポイント
転移・再発後の2次治療として、 ドセタキセルは、 31% (95%CI 16.1-50.0%) の奏効率を示しています²⁾。
現在では、 レンバチニブ+ペムブロリズマブが2次治療の標準ですが、 何らかの理由で、 レンバチニブ+ペムブロリズマブが使用できない患者、 また、 3次治療 (全身状態の良い患者) の選択肢になるかと思われます。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
1) サノフィ株式会社. ワンタキソテール®電子添文 (2024年6月改訂第5版) [最終閲覧 : 2024/12/11]
最終更新日 : 2024年12月11日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。