2024年8月28日に「ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法」を対象に新たに適応が追加された
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
第2世代ALK阻害薬 アレクチニブ
*中外製薬株式会社の外部サイトへ遷移します
>切除不能な進行・再発のALK陽性NSCLCのレジメンはこちら
>再発又は難治性のALK陽性ALCLのレジメンについてはこちら
投与スケジュール
【1コース】連日内服投与
【催吐性】 軽度催吐性
【FN発症】低リスク
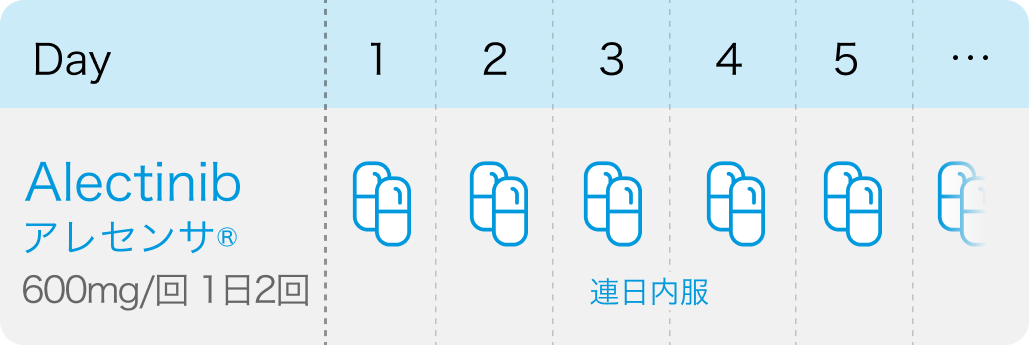
ALK融合遺伝子陽性のNSCLCにおける術後補助療法: 成人には1回600mgを1日2回、 食後に経口投与。 ただし、 投与期間は24ヵ月間までとする。 なお、 患者の状態により適宜減量する。
アレセンサ®添付文書¹⁾、 N Engl J Med. 2024 Apr 11;390(14):1265-1276.³⁾より引用
KeyData|臨床試験結果
📊ALINA試験³⁾
病期IB (≧4cm)~IIIA (UICC/AJCC 第7版) の完全切除ALK陽性早期NSCLC患者257例 (日本人35例含む) を対象に、 アレクチニブ 600mg 1日2回24ヵ月投与の有効性と安全性を、 プラチナ製剤ベースの化学療法を対照に検証した国際第III相試験。 主要評価項目はDFS。
【有効性】アレクチニブ群 vs 対照群
2年DFS : 93.6% vs 63.0%
疾患再発または死亡HR 0.24、 95%CI 0.13~0.45、 P<0.001
また、 CNSのDFSに関する臨床的に意味のある利益と関連した (CNS疾患再発または死亡のHR 0.22、 95%CI 0.08~0.58)。 予期しない安全性所見は認められなかった。
【安全性】主な有害事象 (カッコ内 Grade3~4)
- 悪心 7.8% (0%)
- クレアチンキナーゼ増加 43.0% (6.2%)
- 便秘 42.2 % (0.8%)
- AST増加 41.4% (0.8%)
- ALT増加 33.6% (1.6%)
- Bil増加 33.6% (1.6%)
- 食欲の低下 5.5% (0%)
- COVID-19 28.9% (0%)
- 筋肉痛 28.1% (0.8%)
- 貧血 23.4% (0%)
- 嘔吐 7.0% (0%)
- ALP増加 25.0% (0%)
- 白血球数減少 1.6% (0%)
- 好中球数減少 2.3% (0%)
- 無力症 10.9% (0%)
- 好中球減少症 1.6% (0%)
- クレアチニン増加 14.8% (0.8%)
- 咳 14.8% (0.8%)
- 疲労 14.1% (0.8%)
- 発疹 14.1% (0.8%)
- 倦怠感 4.7% (0%)
- 体重増加 13.3% (0.8%)
- 下痢 12.5% (0.8%)
- 頭痛 10.9% (0%)
- 呼吸困難 10.2% (0.8 %)
- 味覚障害 10.2% (0%)
- 浮腫、 末梢 10.2% (0%)
N Engl J Med. 2024 Apr 11;390(14):1265-1276³⁾より引用
各プロトコル
減量の目安
アレセンサ®添付文書¹⁾より引用
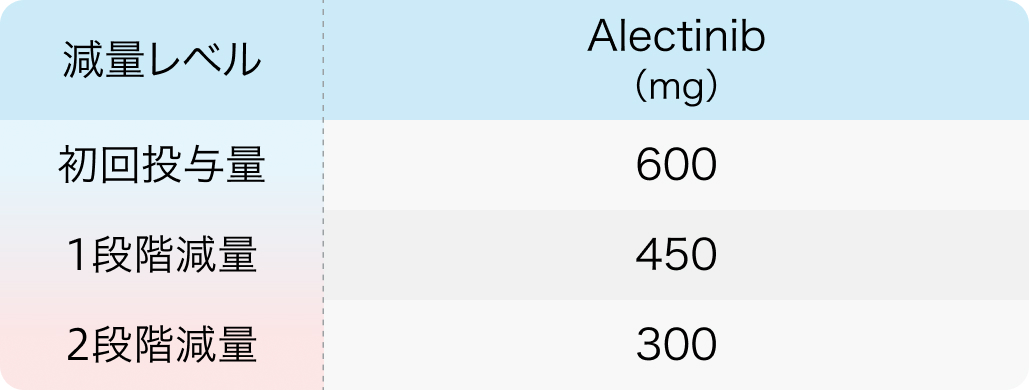
副作用発現時の用量調節基準
アレセンサ®添付文書¹⁾より引用

特徴と注意点
国内で2番目に承認された第2世代ALK阻害薬。 ALK陽性進行NSCLCは、 NSCLCの3~5%で認められ、 特に若年者や非喫煙者に多い⁴⁾。 2024年8月に新たに 「ALK融合遺伝子陽性のNSCLCにおける術後補助療法」 として承認された。
👨⚕️監修医師コメント : ALK阻害剤の中で忍容性は極めて高い。 術後補助療法の場合は用量が倍になるため注意 (投与期間2年間)
>切除不能な進行・再発のALK陽性NSCLCのレジメンはこちら
>再発又は難治性のALK陽性ALCLのレジメンについてはこちら
遺伝子パネル検査・コンパニオン診断
日本肺癌学会の各種手引き⁴⁾やHOKUTO編集部のまとめコンテンツを参照ください。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
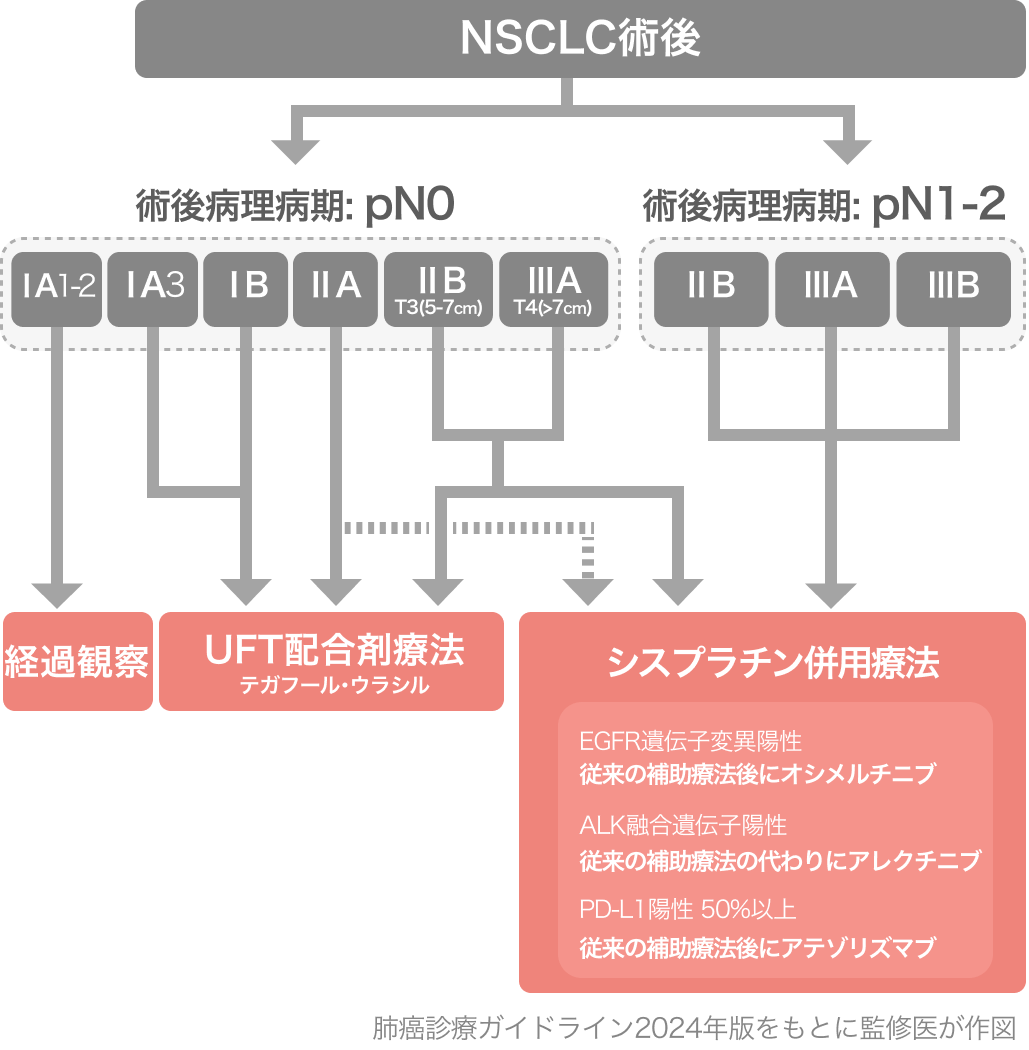
肺癌診療ガイドライン2024の記載⁵⁾
前版では記載がなかったが、ALINA試験の結果を基に、 NSCLC周術期治療において以下の推奨が追加された。
ALK 融合遺伝子陽性の術後病理病期II-IIB期 (第9版) *N3は除く 完全切除例に対して、 従来の術後補助薬物療法の代わりとしてアレクチニブによる治療を行うよう弱く推奨する [2B]
肺癌診療ガイドライン -悪性胸膜中皮腫・胸腺腫瘍含む- 2024年版より引用
出典
1) 中外製薬株式会社 「アレセンサ®カプセル 添付文書」 (2024年8月改訂第2版) [最終確認 2025/04/15]
2) 中外製薬株式会社 「アレセンサ®適正使用ガイド」 (2024年8月改訂) [最終確認 2025/04/15]
4) 日本肺癌学会バイオマーカー委員会. 肺癌患者におけるALK融合遺伝子検査の手引き
5) 肺癌診療ガイドライン -悪性胸膜中皮腫・胸腺腫瘍含む- 2024年版
最終更新日 : 2025年4月15日
HOKUTO編集部医師監修
Alectinib
2024年8月28日に「ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法」を対象に新たに適応が追加された
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
第2世代ALK阻害薬 アレクチニブ
*中外製薬株式会社の外部サイトへ遷移します
>切除不能な進行・再発のALK陽性NSCLCのレジメンはこちら
>再発又は難治性のALK陽性ALCLのレジメンについてはこちら
投与スケジュール
【1コース】連日内服投与
【催吐性】 軽度催吐性
【FN発症】低リスク

ALK融合遺伝子陽性のNSCLCにおける術後補助療法: 成人には1回600mgを1日2回、 食後に経口投与。 ただし、 投与期間は24ヵ月間までとする。 なお、 患者の状態により適宜減量する。
アレセンサ®添付文書¹⁾、 N Engl J Med. 2024 Apr 11;390(14):1265-1276.³⁾より引用
KeyData|臨床試験結果
📊ALINA試験³⁾
病期IB (≧4cm)~IIIA (UICC/AJCC 第7版) の完全切除ALK陽性早期NSCLC患者257例 (日本人35例含む) を対象に、 アレクチニブ 600mg 1日2回24ヵ月投与の有効性と安全性を、 プラチナ製剤ベースの化学療法を対照に検証した国際第III相試験。 主要評価項目はDFS。
【有効性】アレクチニブ群 vs 対照群
2年DFS : 93.6% vs 63.0%
疾患再発または死亡HR 0.24、 95%CI 0.13~0.45、 P<0.001
また、 CNSのDFSに関する臨床的に意味のある利益と関連した (CNS疾患再発または死亡のHR 0.22、 95%CI 0.08~0.58)。 予期しない安全性所見は認められなかった。
【安全性】主な有害事象 (カッコ内 Grade3~4)
- 悪心 7.8% (0%)
- クレアチンキナーゼ増加 43.0% (6.2%)
- 便秘 42.2 % (0.8%)
- AST増加 41.4% (0.8%)
- ALT増加 33.6% (1.6%)
- Bil増加 33.6% (1.6%)
- 食欲の低下 5.5% (0%)
- COVID-19 28.9% (0%)
- 筋肉痛 28.1% (0.8%)
- 貧血 23.4% (0%)
- 嘔吐 7.0% (0%)
- ALP増加 25.0% (0%)
- 白血球数減少 1.6% (0%)
- 好中球数減少 2.3% (0%)
- 無力症 10.9% (0%)
- 好中球減少症 1.6% (0%)
- クレアチニン増加 14.8% (0.8%)
- 咳 14.8% (0.8%)
- 疲労 14.1% (0.8%)
- 発疹 14.1% (0.8%)
- 倦怠感 4.7% (0%)
- 体重増加 13.3% (0.8%)
- 下痢 12.5% (0.8%)
- 頭痛 10.9% (0%)
- 呼吸困難 10.2% (0.8 %)
- 味覚障害 10.2% (0%)
- 浮腫、 末梢 10.2% (0%)
N Engl J Med. 2024 Apr 11;390(14):1265-1276³⁾より引用
各プロトコル
減量の目安
アレセンサ®添付文書¹⁾より引用

副作用発現時の用量調節基準
アレセンサ®添付文書¹⁾より引用

特徴と注意点
国内で2番目に承認された第2世代ALK阻害薬。 ALK陽性進行NSCLCは、 NSCLCの3~5%で認められ、 特に若年者や非喫煙者に多い⁴⁾。 2024年8月に新たに 「ALK融合遺伝子陽性のNSCLCにおける術後補助療法」 として承認された。
👨⚕️監修医師コメント : ALK阻害剤の中で忍容性は極めて高い。 術後補助療法の場合は用量が倍になるため注意 (投与期間2年間)
>切除不能な進行・再発のALK陽性NSCLCのレジメンはこちら
>再発又は難治性のALK陽性ALCLのレジメンについてはこちら
遺伝子パネル検査・コンパニオン診断
日本肺癌学会の各種手引き⁴⁾やHOKUTO編集部のまとめコンテンツを参照ください。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
肺癌診療ガイドライン2024の記載⁵⁾
前版では記載がなかったが、ALINA試験の結果を基に、 NSCLC周術期治療において以下の推奨が追加された。
ALK 融合遺伝子陽性の術後病理病期II-IIB期 (第9版) *N3は除く 完全切除例に対して、 従来の術後補助薬物療法の代わりとしてアレクチニブによる治療を行うよう弱く推奨する [2B]
肺癌診療ガイドライン -悪性胸膜中皮腫・胸腺腫瘍含む- 2024年版より引用

出典
1) 中外製薬株式会社 「アレセンサ®カプセル 添付文書」 (2024年8月改訂第2版) [最終確認 2025/04/15]
2) 中外製薬株式会社 「アレセンサ®適正使用ガイド」 (2024年8月改訂) [最終確認 2025/04/15]
4) 日本肺癌学会バイオマーカー委員会. 肺癌患者におけるALK融合遺伝子検査の手引き
5) 肺癌診療ガイドライン -悪性胸膜中皮腫・胸腺腫瘍含む- 2024年版
最終更新日 : 2025年4月15日
HOKUTO編集部医師監修
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。