本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テセントリク® (アテゾリズマブ)
抗PD-L1抗体 *中外製薬株式会社の外部サイトへ遷移します
アバスチン® (ベバシズマブ)
抗VEGF抗体 *中外製薬の外部サイトへ遷移します
投与スケジュール
IMpower150試験のプロトコル³⁾

4~6サイクル終了後,増悪を認めなければベバシズマブ+アテゾリズマブ併用の維持療法を考慮する。 PTX投与30分前までにデキサメタゾン、 H1、 H2 blockerの前投薬を行う。
Lancet Oncol. 2019 Jul;20(7):924-937. より作図
電子添文の用法用量
Atezolizumab: 1回1200mgを60分かけ3週間間隔で点滴静注
Bmab : 1回15mg/kgを点滴静注。 投与間隔は3週間以上
CBDCA : 1日1回300~400mg/m²を投与、 少なくとも4週休薬
PTX : 1日1回210mg/m² を点滴静注、 少なくとも3週休薬
KeyData|臨床試験結果
IMpower150試験³⁾
N Engl J Med. 2018;378(24):2288-2301.
進行非扁平上皮NSCLC患者を対象に、 初回治療としてABCP療法 (本レジメン) の有効性と安全性を評価した第III相無作為化試験。 患者は1,202例が登録され (国内93例を含む)、 ABCP群、 BCP群、 ACP群の3群に無作為化された。 主要評価項目はOSであった。
有効性|ABCP療法ITT集団
- mOS : 19.2ヵ月 [主要評価項目]
BCP群: 14.7ヵ月、 HR 0.78 (95%CI: 0.64–0.96)、 p=0.02
※EGFR遺伝子変異陽性例 : 未到達
PC群 18.7、 HR 0.61、 95%CI 0.29-1.28
- mPFS : 8.3ヵ月
BCP群: 6.8ヵ月、 HR 0.62 (95%CI 0.52–0.74)、 p<0.001
※EGFR遺伝子変異陽性例 : 10.2ヵ月
PC群 6.9ヵ月、 HR 0.61、 95%CI 0.36-1.03
- ORR : 63.5%
BCP群: 48.0%
安全性 Grade 3以上の治療関連有害事象発生率は、 ABCP群 57.2%、 BCP群 50.0%であった。
参考:ATTLAS試験 (KCSG-LU19-04)⁴⁾
J Clin Oncol. 2024;42(11):1241-1251.
EGFRまたはALK遺伝子変異を有するNSCLC患者を対象に、 チロシンキナーゼ阻害薬 (TKI) 治療後の病勢進行時におけるABCP療法 (本レジメン) の有効性と安全性を評価した韓国国内16施設で実施された第III相無作為化試験。228例の患者が登録され (EGFR遺伝子変異陽性例 215例、 ALK融合遺伝子陽性例 13例)、 ABCP療法群 154例とペメトレキセド+カルボプラチンまたはシスプラチン療法群 74例に割り付けられた。 主要評価項目はPFSであった。
有効性|ABCP療法群
- mPFS : 8.5ヵ月 [主要評価項目]
PC群 5.6ヵ月、 HR 0.62、 95%CI 0.45-0.86、 p=0.004
※EGFR遺伝子変異陽性例 : 8.7ヵ月
PC群 5.6ヵ月、 HR 0.60、 95%CI 0.43-0.84
- ORR : 69.5%
PC群 41.9%、 p<0.001
- mOS : 20.6ヵ月
PC群 20.3ヵ月、 HR 1.01、 95%CI 0.69-1.46、 p=0.975
安全性|ABCP療法の有害事象プロファイルは既報と一致しており、 新たな安全性シグナルは報告されなかった。
特徴と注意点
肺癌診療ガイドライン2024年版の記載⁵⁾
2次治療以降でABCP療法の推奨度が上昇
ABCP (Atezolizumab+Bmab+CBDCA+PTX)
一次治療EGFR-TKI*耐性または増悪後例に二次治療で細胞傷害性抗癌薬と免疫チェックポイント阻害薬を併用した治療は勧められるか? *オシメルチニブを一次治療で用いていない、 および一次治療EGFR-TKI耐性後T790M変異陽性の場合以外
旧版では、 1次治療でのEGFR-TKI耐性または増悪後、 2次治療以降での細胞傷害性抗癌薬+ICI併用療法に関するCQ自体は既に存在していたが、 「推奨に至る根拠が明確ではない」 に留まっていた。 2024年版では、 ATTLAS試験の結果を受けて、 推奨内容および推奨度が 「1次治療でのEGFR-TKI耐性獲得後または増悪後」 に 「弱く推奨 (2B)」 することと変更された。
各プロトコル
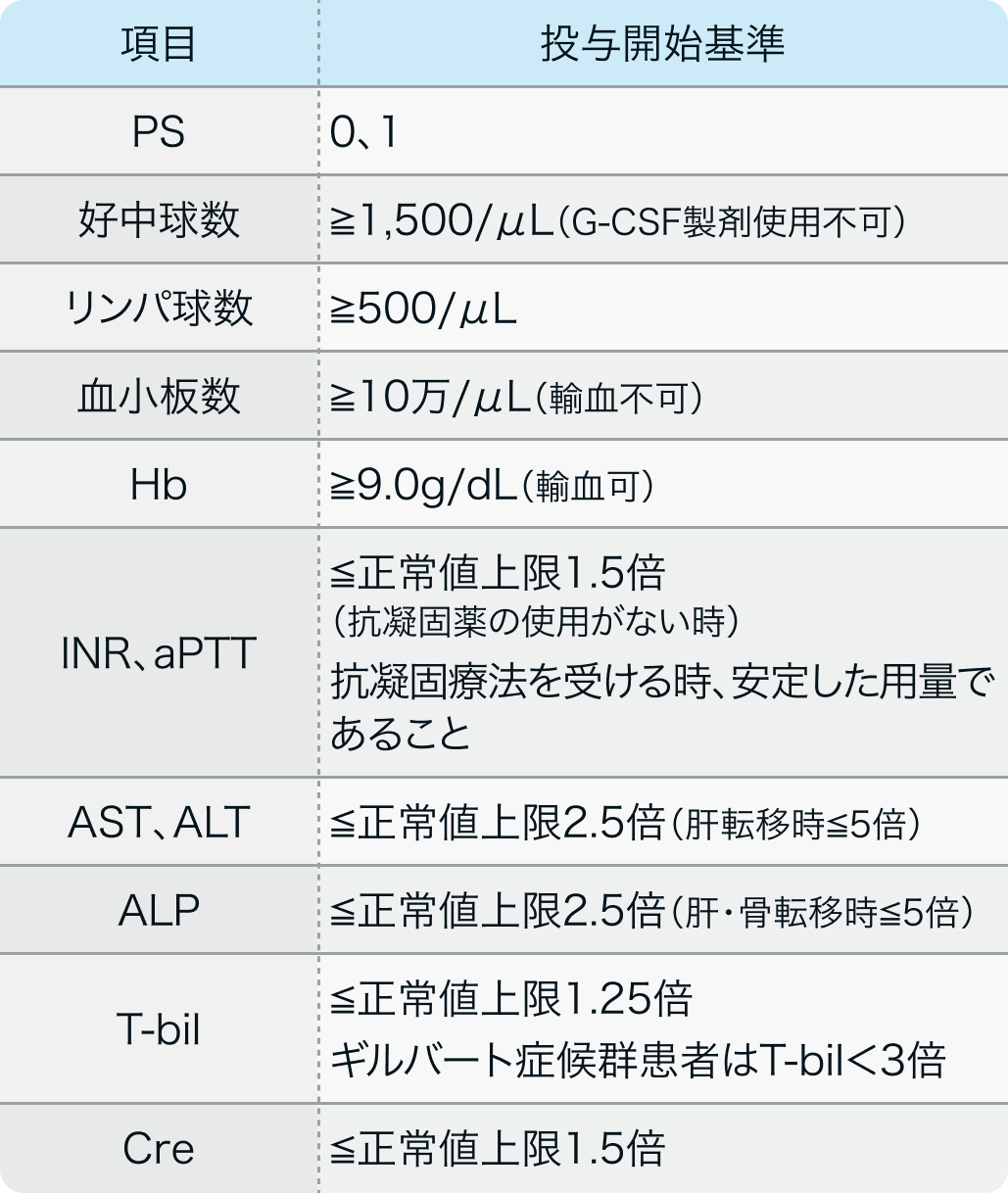
投与開始基準
IMpower150試験のプロトコル³⁾
減量・休薬・中止基準
アテゾリズマブ適正使用ガイド²⁾
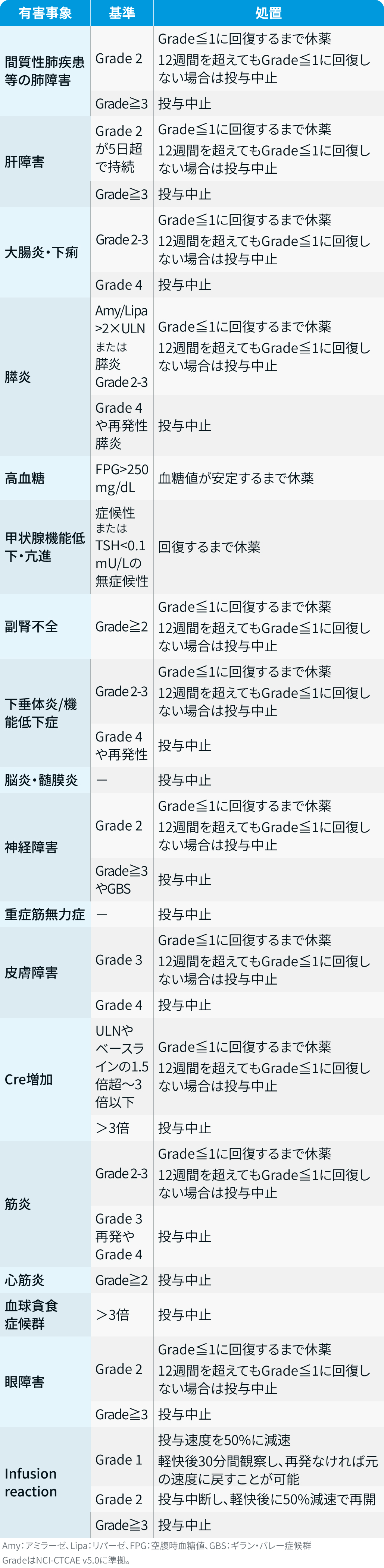
テセントリク®電子添文、 適正使用ガイド より引用
出典
1) 中外製薬株式会社. テセントリク®点滴静注電子添文情報 2025年9月改訂 第10版 [最終閲覧:2025/10/20]
2) 中外製薬株式会社. テセントリク®︎適正使用ガイド 2025年9月改訂 [最終閲覧:2025/10/20]
5) 肺癌診療ガイドライン-悪性胸膜中皮腫・ 胸腺腫瘍含む-2024年版
最終更新日 : 2025年10月20日
監修医師 : HOKUTO編集部監修医師
Atezolizumab+Bmab+CBDCA+PTX
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テセントリク® (アテゾリズマブ)
抗PD-L1抗体 *中外製薬株式会社の外部サイトへ遷移します
アバスチン® (ベバシズマブ)
抗VEGF抗体 *中外製薬の外部サイトへ遷移します
投与スケジュール
IMpower150試験のプロトコル³⁾

4~6サイクル終了後,増悪を認めなければベバシズマブ+アテゾリズマブ併用の維持療法を考慮する。 PTX投与30分前までにデキサメタゾン、 H1、 H2 blockerの前投薬を行う。
Lancet Oncol. 2019 Jul;20(7):924-937. より作図
電子添文の用法用量
Atezolizumab: 1回1200mgを60分かけ3週間間隔で点滴静注
Bmab : 1回15mg/kgを点滴静注。 投与間隔は3週間以上
CBDCA : 1日1回300~400mg/m²を投与、 少なくとも4週休薬
PTX : 1日1回210mg/m² を点滴静注、 少なくとも3週休薬
KeyData|臨床試験結果
IMpower150試験³⁾
N Engl J Med. 2018;378(24):2288-2301.
進行非扁平上皮NSCLC患者を対象に、 初回治療としてABCP療法 (本レジメン) の有効性と安全性を評価した第III相無作為化試験。 患者は1,202例が登録され (国内93例を含む)、 ABCP群、 BCP群、 ACP群の3群に無作為化された。 主要評価項目はOSであった。
有効性|ABCP療法ITT集団
- mOS : 19.2ヵ月 [主要評価項目]
BCP群: 14.7ヵ月、 HR 0.78 (95%CI: 0.64–0.96)、 p=0.02
※EGFR遺伝子変異陽性例 : 未到達
PC群 18.7、 HR 0.61、 95%CI 0.29-1.28
- mPFS : 8.3ヵ月
BCP群: 6.8ヵ月、 HR 0.62 (95%CI 0.52–0.74)、 p<0.001
※EGFR遺伝子変異陽性例 : 10.2ヵ月
PC群 6.9ヵ月、 HR 0.61、 95%CI 0.36-1.03
- ORR : 63.5%
BCP群: 48.0%
安全性 Grade 3以上の治療関連有害事象発生率は、 ABCP群 57.2%、 BCP群 50.0%であった。
参考:ATTLAS試験 (KCSG-LU19-04)⁴⁾
J Clin Oncol. 2024;42(11):1241-1251.
EGFRまたはALK遺伝子変異を有するNSCLC患者を対象に、 チロシンキナーゼ阻害薬 (TKI) 治療後の病勢進行時におけるABCP療法 (本レジメン) の有効性と安全性を評価した韓国国内16施設で実施された第III相無作為化試験。228例の患者が登録され (EGFR遺伝子変異陽性例 215例、 ALK融合遺伝子陽性例 13例)、 ABCP療法群 154例とペメトレキセド+カルボプラチンまたはシスプラチン療法群 74例に割り付けられた。 主要評価項目はPFSであった。
有効性|ABCP療法群
- mPFS : 8.5ヵ月 [主要評価項目]
PC群 5.6ヵ月、 HR 0.62、 95%CI 0.45-0.86、 p=0.004
※EGFR遺伝子変異陽性例 : 8.7ヵ月
PC群 5.6ヵ月、 HR 0.60、 95%CI 0.43-0.84
- ORR : 69.5%
PC群 41.9%、 p<0.001
- mOS : 20.6ヵ月
PC群 20.3ヵ月、 HR 1.01、 95%CI 0.69-1.46、 p=0.975
安全性|ABCP療法の有害事象プロファイルは既報と一致しており、 新たな安全性シグナルは報告されなかった。
特徴と注意点
肺癌診療ガイドライン2024年版の記載⁵⁾
2次治療以降でABCP療法の推奨度が上昇
ABCP (Atezolizumab+Bmab+CBDCA+PTX)
一次治療EGFR-TKI*耐性または増悪後例に二次治療で細胞傷害性抗癌薬と免疫チェックポイント阻害薬を併用した治療は勧められるか? *オシメルチニブを一次治療で用いていない、 および一次治療EGFR-TKI耐性後T790M変異陽性の場合以外
旧版では、 1次治療でのEGFR-TKI耐性または増悪後、 2次治療以降での細胞傷害性抗癌薬+ICI併用療法に関するCQ自体は既に存在していたが、 「推奨に至る根拠が明確ではない」 に留まっていた。 2024年版では、 ATTLAS試験の結果を受けて、 推奨内容および推奨度が 「1次治療でのEGFR-TKI耐性獲得後または増悪後」 に 「弱く推奨 (2B)」 することと変更された。
各プロトコル
投与開始基準
IMpower150試験のプロトコル³⁾

減量・休薬・中止基準
アテゾリズマブ適正使用ガイド²⁾

テセントリク®電子添文、 適正使用ガイド より引用
出典
1) 中外製薬株式会社. テセントリク®点滴静注電子添文情報 2025年9月改訂 第10版 [最終閲覧:2025/10/20]
2) 中外製薬株式会社. テセントリク®︎適正使用ガイド 2025年9月改訂 [最終閲覧:2025/10/20]
5) 肺癌診療ガイドライン-悪性胸膜中皮腫・ 胸腺腫瘍含む-2024年版
最終更新日 : 2025年10月20日
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。