本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
BRAF阻害薬 ダブラフェニブ
*ノバルティス ファーマ株式会社の外部サイトへ遷移します
MEK阻害薬 トラメチニブ
*ノバルティス ファーマ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与
【催吐性】 軽度催吐性
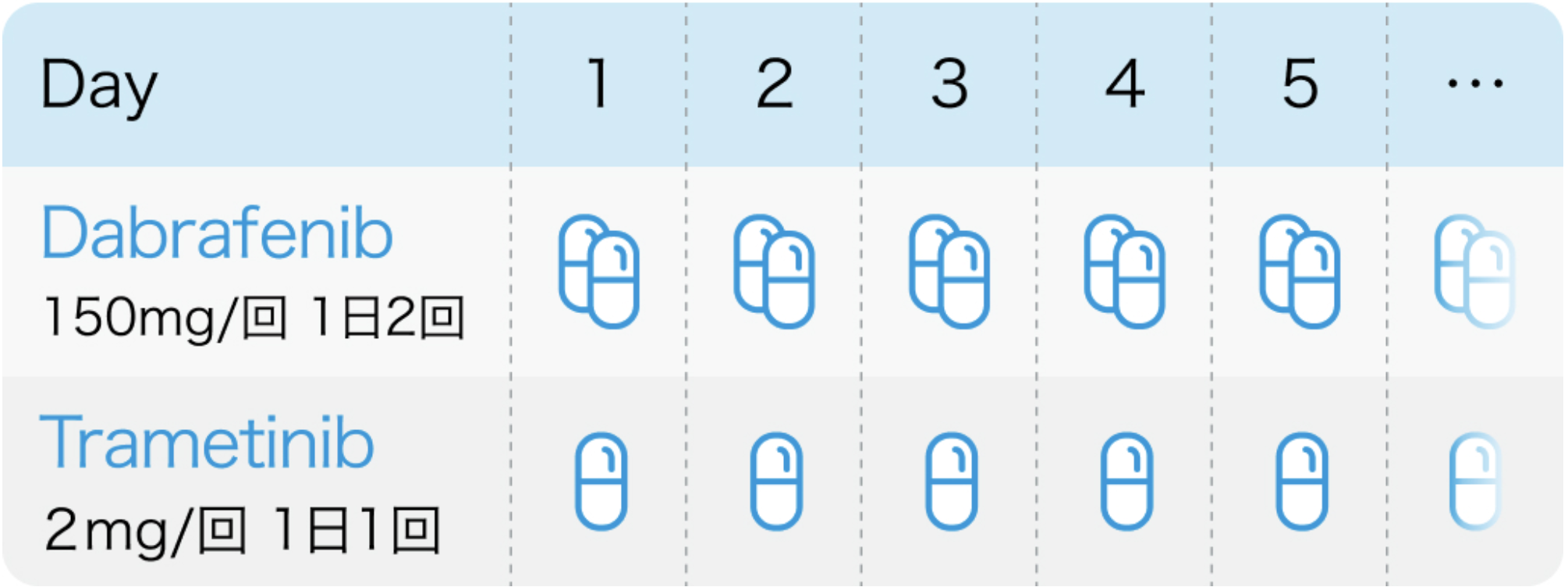
タフィンラー®、メキニスト®電子添文 BRAF遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌より引用
KeyData|臨床試験結果
以下の試験報告がある。 ただし、 これらの臨床試験に登録された日本人症例は限られている。
📊 E2201試験 [海外]
BRAF遺伝子V600E変異陽性Ⅳ期NSCLC患者を対象とした国際共同第Ⅱ相臨床試験
既治療57例 (日本人1例) の有効性結果⁴⁾⁶⁾
- ORR : 66.7% (主要評価項目)
- mPFS : 9.7ヵ月
- mOS : 18.2ヵ月
- 5年生存率 : 19%
未治療例 36例 (日本人なし)の有効性結果⁵⁾⁶⁾
- ORR : 64% (主要評価項目)
- mPFS : 10.9ヵ月
- mOS : 17.3ヵ月
- 5年生存率 : 22%
各プロトコル
開始基準¹⁾²⁾

BRAF V600E変異陽性でIV期NSCLCのうち、ECOG PS 0~2で、十分な臓器機能を有する患者
その他の詳細な開始・除外基準は適正使用ガイドを参照すること
休薬・減量・中止基準¹⁾²⁾

タフィンラー®、メキニスト®適正使用ガイドを基に編集部作表
有棘細胞癌 (皮膚扁平上皮癌) 又は新たな原発性悪性黒色腫の発現時には、 外科的切除等の適切な処置を行った上で、 休薬、 減量なく治療を継続できる。
減量の目安¹⁾²⁾
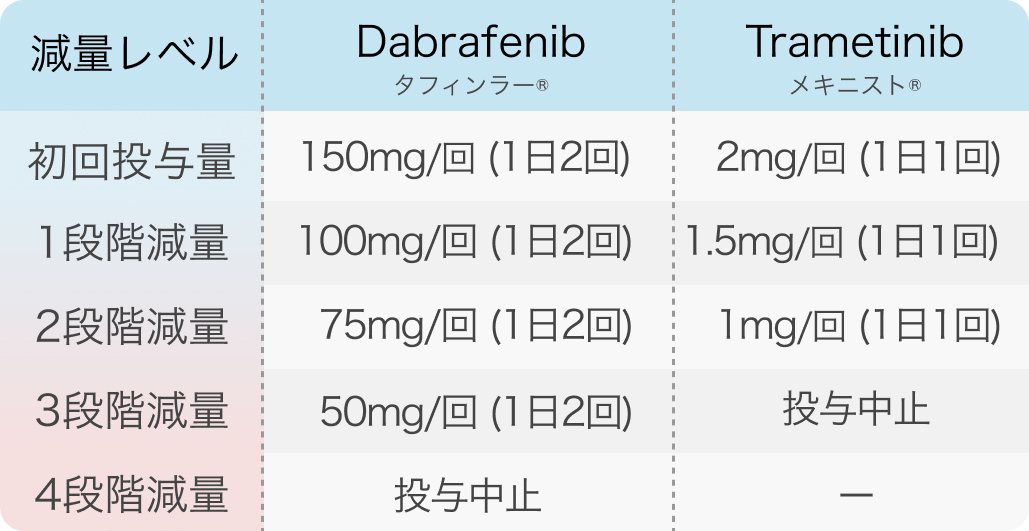
タフィンラー®、メキニスト®適正使用ガイドを基に編集部作表
レジメンの特徴と注意点
本薬剤の用法と管理について
食後に本剤を投与した場合、 Cmax及びAUCが低下するとの報告がある。 食事の影響を避けるため、 食事の1時間前から食後2時間までの間の服用は避けること。 また、 メキニスト®は遮光し、 25°C以下で保存すること。
発熱は1~3週間のうちに約半数で認める
- 感染の除外、 休薬、 解熱剤で管理
イブプロフェン、アセトアミノフェン等
- コントロール不良なら、ステロイドを検討
- 再開時には解熱剤の予防投与を検討
なお、 上記のとおり発熱しても内服継続としていたが、最近は無理せず休薬をする流れである (適正使用ガイドライン)
2次性の皮膚扁平上皮癌の報告あり
- E2201試験 : 2.2% (≧Grade3 1.1%)
発症報告は有棘細胞癌のみ⁴⁻⁶⁾
- 開始前及び投与中に皮膚状態を確認
外科的切除等の適切な処置を行った上で、 休薬、 減量なく治療を継続できる。
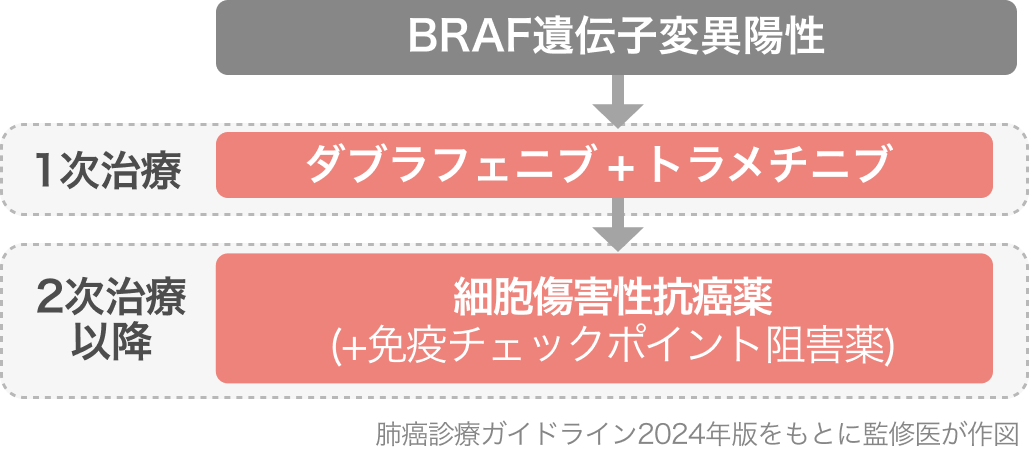
肺癌診療ガイドライン2024の推奨³⁾
BRAF遺伝子V600E変異陽性NSCLCの一次治療として本レジメンは強く推奨されいている[1C]。 なお、この推奨は前版の2023年版より変更なし。
出典
- ノバルティス ファーマ株式会社 「タフィンラー®︎適正使用ガイド2025年8月改訂」 [最終閲覧 2025/10/5]
- ノバルティス ファーマ株式会社 「メキニスト®︎適正使用ガイド 2025年8月改訂」 [最終閲覧 2025/10/5]
- 日本肺癌学会. 肺癌診療ガイドライン-悪性胸膜中皮腫・ 胸腺腫瘍含む-2024年版
- Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol. 2016 Jul;17(7):984-993. PMID: 27283860
- Dabrafenib plus trametinib in patients with previously untreated BRAF V600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol. 2017 Oct;18(10):1307-1316. PMID: 28919011
- Phase 2 Study of Dabrafenib Plus Trametinib in Patients With BRAF V600E-Mutant Metastatic NSCLC: Updated 5-Year Survival Rates and Genomic Analysis. J Thorac Oncol. 2022 Jan;17(1):103-115. PMID: 34455067
最終更新日 : 2025年10月5日
監修:HOKUTO編集部医師監修
Dabrafenib + Trametinib
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
BRAF阻害薬 ダブラフェニブ
*ノバルティス ファーマ株式会社の外部サイトへ遷移します
MEK阻害薬 トラメチニブ
*ノバルティス ファーマ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与
【催吐性】 軽度催吐性

タフィンラー®、メキニスト®電子添文 BRAF遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌より引用
KeyData|臨床試験結果
以下の試験報告がある。 ただし、 これらの臨床試験に登録された日本人症例は限られている。
📊 E2201試験 [海外]
BRAF遺伝子V600E変異陽性Ⅳ期NSCLC患者を対象とした国際共同第Ⅱ相臨床試験
既治療57例 (日本人1例) の有効性結果⁴⁾⁶⁾
- ORR : 66.7% (主要評価項目)
- mPFS : 9.7ヵ月
- mOS : 18.2ヵ月
- 5年生存率 : 19%
未治療例 36例 (日本人なし)の有効性結果⁵⁾⁶⁾
- ORR : 64% (主要評価項目)
- mPFS : 10.9ヵ月
- mOS : 17.3ヵ月
- 5年生存率 : 22%
各プロトコル
開始基準¹⁾²⁾

BRAF V600E変異陽性でIV期NSCLCのうち、ECOG PS 0~2で、十分な臓器機能を有する患者
その他の詳細な開始・除外基準は適正使用ガイドを参照すること
休薬・減量・中止基準¹⁾²⁾

タフィンラー®、メキニスト®適正使用ガイドを基に編集部作表
有棘細胞癌 (皮膚扁平上皮癌) 又は新たな原発性悪性黒色腫の発現時には、 外科的切除等の適切な処置を行った上で、 休薬、 減量なく治療を継続できる。
減量の目安¹⁾²⁾

タフィンラー®、メキニスト®適正使用ガイドを基に編集部作表
レジメンの特徴と注意点
本薬剤の用法と管理について
食後に本剤を投与した場合、 Cmax及びAUCが低下するとの報告がある。 食事の影響を避けるため、 食事の1時間前から食後2時間までの間の服用は避けること。 また、 メキニスト®は遮光し、 25°C以下で保存すること。
発熱は1~3週間のうちに約半数で認める
- 感染の除外、 休薬、 解熱剤で管理
イブプロフェン、アセトアミノフェン等
- コントロール不良なら、ステロイドを検討
- 再開時には解熱剤の予防投与を検討
なお、 上記のとおり発熱しても内服継続としていたが、最近は無理せず休薬をする流れである (適正使用ガイドライン)
2次性の皮膚扁平上皮癌の報告あり
- E2201試験 : 2.2% (≧Grade3 1.1%)
発症報告は有棘細胞癌のみ⁴⁻⁶⁾
- 開始前及び投与中に皮膚状態を確認
外科的切除等の適切な処置を行った上で、 休薬、 減量なく治療を継続できる。
肺癌診療ガイドライン2024の推奨³⁾
BRAF遺伝子V600E変異陽性NSCLCの一次治療として本レジメンは強く推奨されいている[1C]。 なお、この推奨は前版の2023年版より変更なし。

出典
- ノバルティス ファーマ株式会社 「タフィンラー®︎適正使用ガイド2025年8月改訂」 [最終閲覧 2025/10/5]
- ノバルティス ファーマ株式会社 「メキニスト®︎適正使用ガイド 2025年8月改訂」 [最終閲覧 2025/10/5]
- 日本肺癌学会. 肺癌診療ガイドライン-悪性胸膜中皮腫・ 胸腺腫瘍含む-2024年版
- Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol. 2016 Jul;17(7):984-993. PMID: 27283860
- Dabrafenib plus trametinib in patients with previously untreated BRAF V600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol. 2017 Oct;18(10):1307-1316. PMID: 28919011
- Phase 2 Study of Dabrafenib Plus Trametinib in Patients With BRAF V600E-Mutant Metastatic NSCLC: Updated 5-Year Survival Rates and Genomic Analysis. J Thorac Oncol. 2022 Jan;17(1):103-115. PMID: 34455067
最終更新日 : 2025年10月5日
監修:HOKUTO編集部医師監修
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。