本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*アステラス製薬株式会社の外部サイトへ遷移します
*チェプラファーム株式会社の外部サイトへ遷移します
- エルプラット® (添付文書⁵⁾)
用法用量
GLOW試験⁶⁾のプロトコル (8サイクル継続)
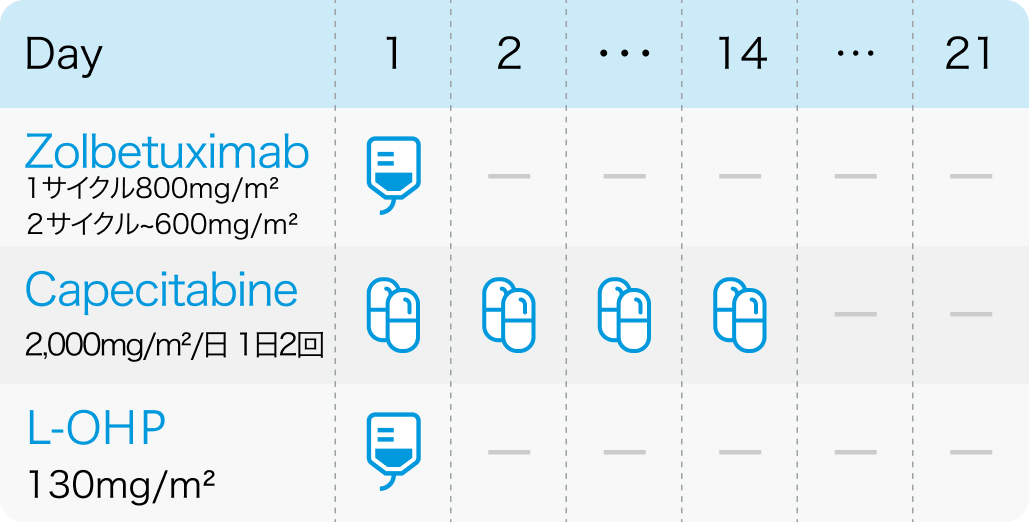
Nat Med. 2023 Aug;29(8):2133-2141⁶⁾より作図
ゾルベツキシマブ電子添文の投与速度基準
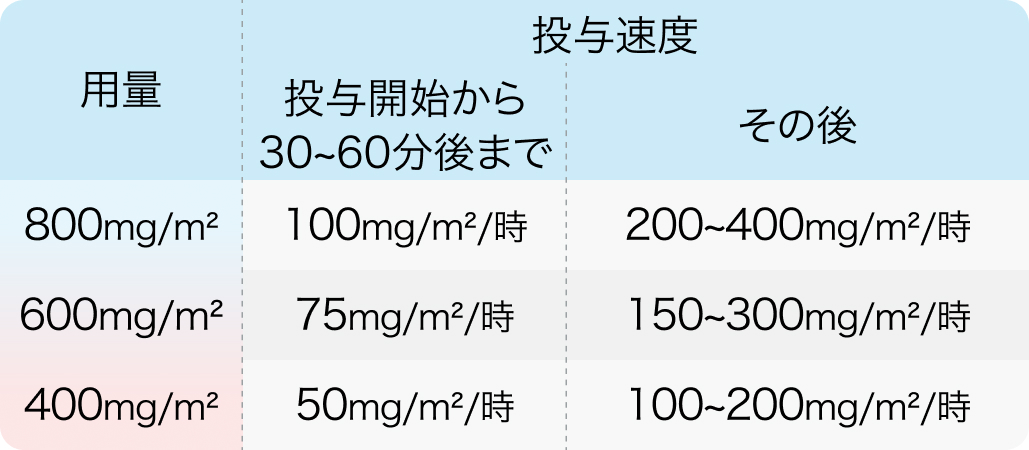
ビロイ®電子添文 (2024年6月改訂 第2版)¹⁾より作図
カペシタビン電子添文³⁾の用法用量
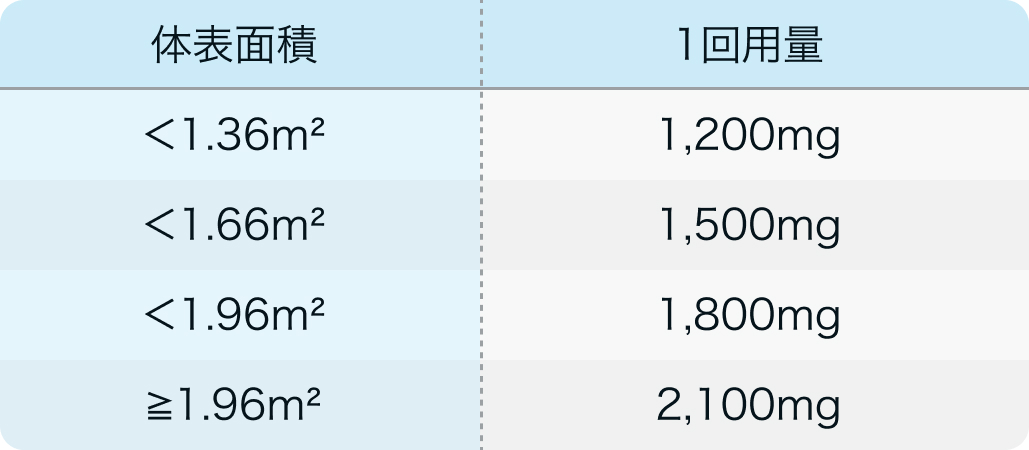
ゼローダ®電子添文 (2024年2月改訂 第3版)³⁾より作図
ゾルベツキシマブ電子添文¹⁾の前投薬記載
悪心、 嘔吐が高頻度にあらわれるので、 本剤投与前に制吐剤の予防投与を検討すること。
ビロイ®電子添文 (2024年6月改訂第2版)¹⁾より引用
電子添文の用法および用量
ゾルベツキシマブ²⁾ : 他の抗悪性腫瘍剤との併用において、 初回は800mg/m²を、 2回目以降は600mg/m²を3週間間隔または400mg/m²を2週間間隔で2時間以上かけて点滴静注
ビロイ®電子添文 (2024年6月改訂 第2版)¹⁾より引用
カペシタビン³⁾⁴⁾ : 体表面積にあわせて次の投与量を朝食後と夕食後30分以内に1日2回、 14日間連日経口投与し、 その後7日間休薬
ゼローダ®電子添文 (2024年2月改訂 第3版)³⁾より引用
オキサリプラチン⁵⁾ : 胃癌にはA法又はB法を使用する。
A法 : 他の抗悪性腫瘍剤との併用において、 85mg/m²を1日1回静脈内に2時間で点滴投与し、 少なくとも13日間休薬
B法 : 他の抗悪性腫瘍剤との併用において、 130mg/m²を1日1回静脈内に2時間で点滴投与し、 少なくとも20日間休薬
エルプラット®電子添文 (2024年4月改訂 第4版)⁵⁾より引用
前投薬
NK₁受容体拮抗薬+5-HT₃受容体拮抗薬+コルチコステロイド (+抗ヒスタミン薬)
糖尿病合併なしなら前日からのオランザピン 5mg投与も選択肢となりうる
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
投与開始基準
GLOW試験⁶⁾のプロトコル
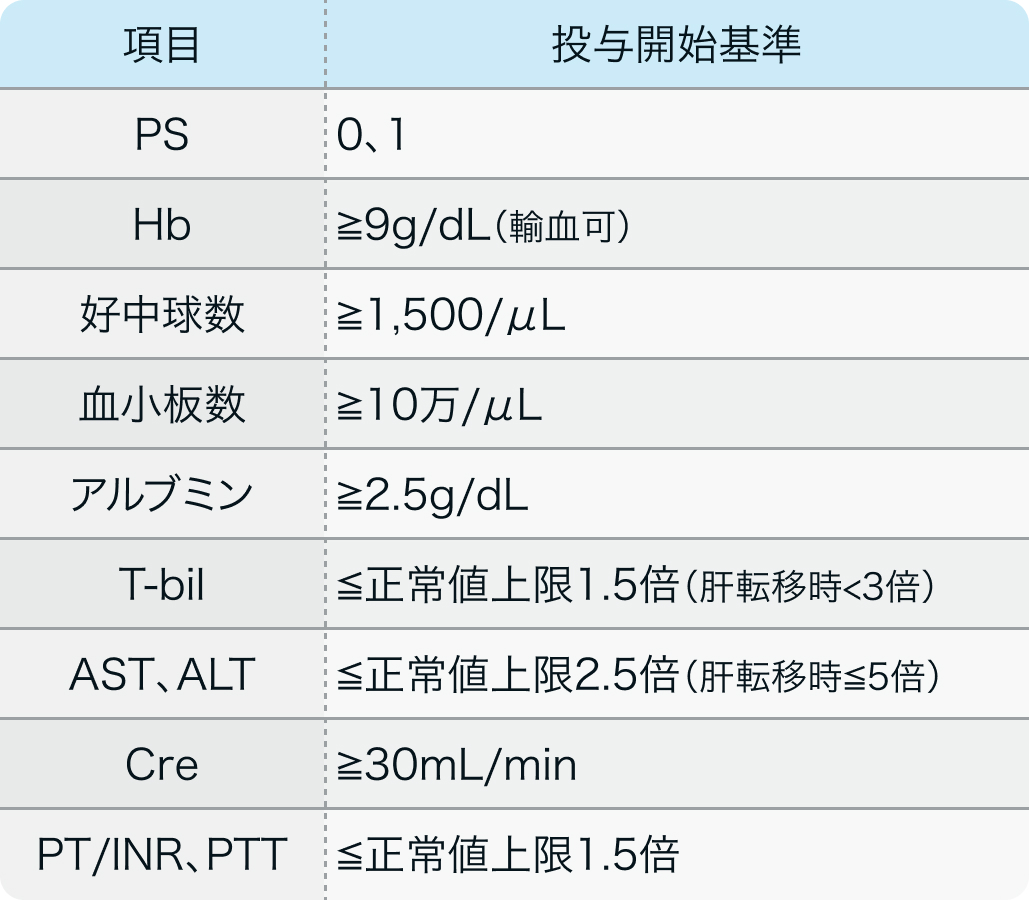
Nat Med. 2023 Aug;29(8):2133-2141⁶⁾より引用
中断・中止基準
ゾルベツキシマブ電子添文¹⁾の中断・中止基準
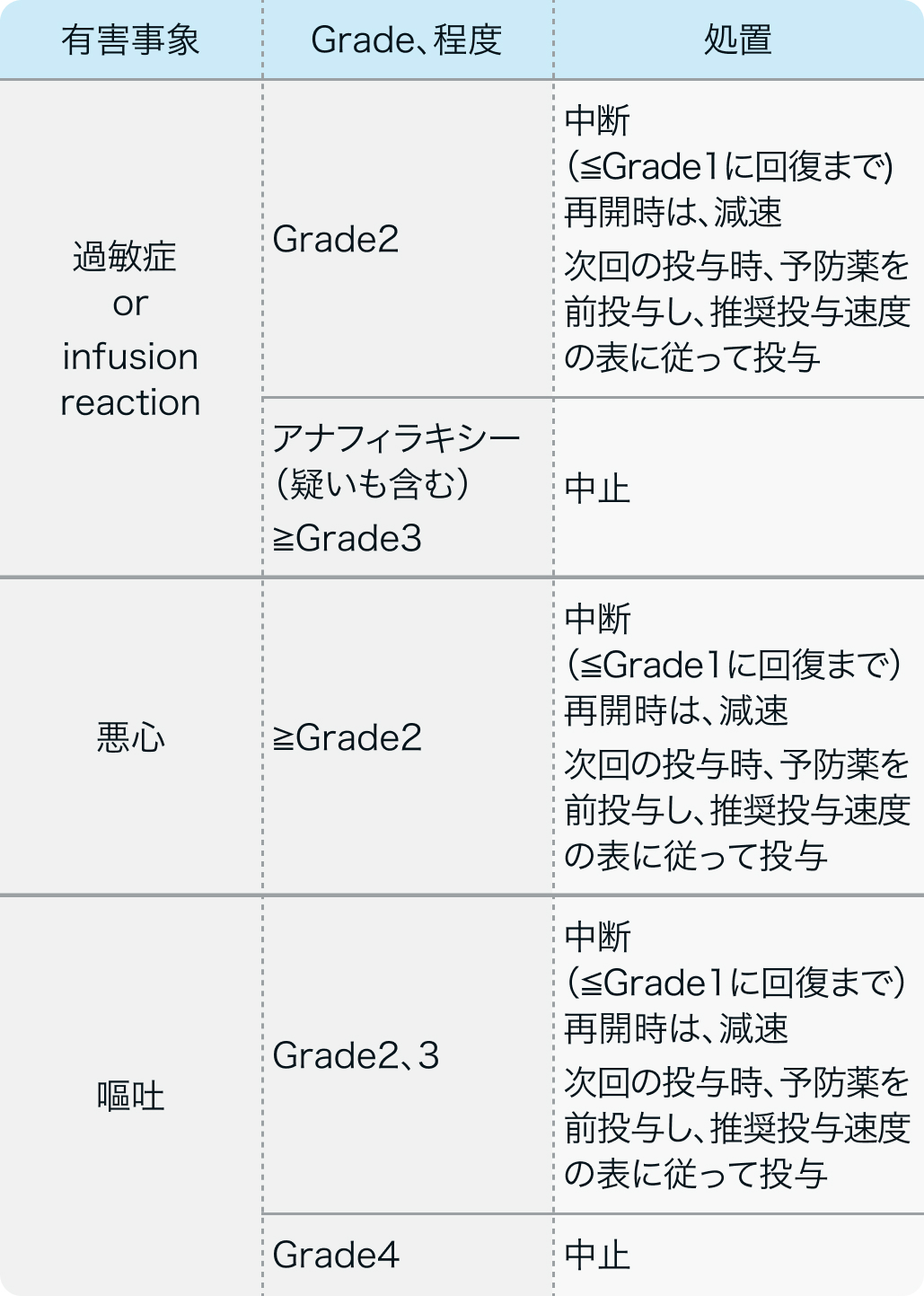
ビロイ®電子添文 (2024年6月改訂 第2版)¹⁾より作図
特徴と注意点
HER2陰性かつCLDN18陽性の治療戦略
本レジメンの使用対象はHER2陰性かつCLDN18陽性に限定される。 肝転移・腹膜播種などの進行が早く、 病理検査結果を待てない症例はCAPOX/FOLFOXなどBackbone chemotherapyだけ開始して、 後に抗HER2薬・ICI・抗CLDN18.2薬を併用するのも治療戦略の一つとなる⁶⁾。
化学療法単独と比較して、 ゾルベツキシマブ併用による奏効割合の上乗せがないため、 投与対象の状況 (CPS、 コンバージョンを狙えるかどうか) を考慮して、 他の薬剤 (ICI等) との比較検討を行う。
悪心・嘔吐管理の重要性
悪心・嘔吐はゾルベツキシマブ投与中に発生する急性期のものと、 CAPOX/FOLFOXによる急性期・遅発期・超遅発期のものがある。 胃癌自体で経口摂取量低下している場合においては遅発期・超遅発期の悪心・嘔吐リスク増大を考慮した場合、 NK1受容体拮抗薬はホスネツピタントが考慮される。
投与中の悪心・嘔吐、 特に突発的に嘔吐する症例もいるので、 スタッフに事前に嘔吐時対応の事前教育と指示が必要である。
オキサリプラチン投与の規定と実臨床での調整
SPOTLIGHT試験では12コース⁷⁾、 GLOW試験で8コースのオキサリプラチン投与が規定されていた⁶⁾。 しかし2次治療におけるPTX+RAMへのシークエンスを考慮すると、 リアルワールドでは化学療法誘発性末梢神経障害を回避するために前者は8コース、 後者は6コース程度の計画中止も選択肢となりうる。
初回投与時の注意点と患者背景の考慮
ゾルベツキシマブ初回投与における悪心・嘔吐・腹痛制御が、 その後の治療継続性に影響する。 患者さんにとって初めての抗癌薬投与であることから、 2回目以降に予測性悪心・嘔吐を出現しないよう配慮した投与が必要である。
薬剤の安定性の観点から、 ゾルベツキシマブは開始6時間以内での投与終了が必要である。 しかしながら、 初回投与時は最大6時間かけてでも悪心、 嘔吐が軽度に収まる投与速度で終了すべきである。 オキサリプラチンの投与もあわせ長時間投与となるため、 初回は入院で導入すべきである。
例外として胃全摘の症例では投与中の悪心・嘔吐が少ないとされており、 患者背景も考慮する。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
出典
- アステラス製薬株式会社. ビロイ®電子添文 (2024年6月改訂第2版) [最終閲覧 : 2024/6/10]
- アステラス製薬株式会社. ビロイ®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/6/10]
- チェプラファーム株式会社. ゼローダ®電子添文 (2024年2月改訂 第3版) [最終閲覧 : 2024/04/23]
- チェプラファーム株式会社. ゼローダ®適正使用ガイド (2024年2月改訂) [最終閲覧 : 2024/04/23]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/04/23]
- Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med. 2023 Aug;29(8):2133-2141. PMID: 37524953
- Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2023 May 20;401(10389):1655-1668. PMID: 37068504
最終更新日 : 2024年7月18日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
Zolbetuximab + CAPOX
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*アステラス製薬株式会社の外部サイトへ遷移します
*チェプラファーム株式会社の外部サイトへ遷移します
- エルプラット® (添付文書⁵⁾)
用法用量
GLOW試験⁶⁾のプロトコル (8サイクル継続)

Nat Med. 2023 Aug;29(8):2133-2141⁶⁾より作図
ゾルベツキシマブ電子添文の投与速度基準

ビロイ®電子添文 (2024年6月改訂 第2版)¹⁾より作図
カペシタビン電子添文³⁾の用法用量

ゼローダ®電子添文 (2024年2月改訂 第3版)³⁾より作図
ゾルベツキシマブ電子添文¹⁾の前投薬記載
悪心、 嘔吐が高頻度にあらわれるので、 本剤投与前に制吐剤の予防投与を検討すること。
ビロイ®電子添文 (2024年6月改訂第2版)¹⁾より引用
電子添文の用法および用量
ゾルベツキシマブ²⁾ : 他の抗悪性腫瘍剤との併用において、 初回は800mg/m²を、 2回目以降は600mg/m²を3週間間隔または400mg/m²を2週間間隔で2時間以上かけて点滴静注
ビロイ®電子添文 (2024年6月改訂 第2版)¹⁾より引用
カペシタビン³⁾⁴⁾ : 体表面積にあわせて次の投与量を朝食後と夕食後30分以内に1日2回、 14日間連日経口投与し、 その後7日間休薬
ゼローダ®電子添文 (2024年2月改訂 第3版)³⁾より引用
オキサリプラチン⁵⁾ : 胃癌にはA法又はB法を使用する。
A法 : 他の抗悪性腫瘍剤との併用において、 85mg/m²を1日1回静脈内に2時間で点滴投与し、 少なくとも13日間休薬
B法 : 他の抗悪性腫瘍剤との併用において、 130mg/m²を1日1回静脈内に2時間で点滴投与し、 少なくとも20日間休薬
エルプラット®電子添文 (2024年4月改訂 第4版)⁵⁾より引用
前投薬
NK₁受容体拮抗薬+5-HT₃受容体拮抗薬+コルチコステロイド (+抗ヒスタミン薬)
糖尿病合併なしなら前日からのオランザピン 5mg投与も選択肢となりうる
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
投与開始基準
GLOW試験⁶⁾のプロトコル

Nat Med. 2023 Aug;29(8):2133-2141⁶⁾より引用
中断・中止基準
ゾルベツキシマブ電子添文¹⁾の中断・中止基準

ビロイ®電子添文 (2024年6月改訂 第2版)¹⁾より作図
特徴と注意点
HER2陰性かつCLDN18陽性の治療戦略
本レジメンの使用対象はHER2陰性かつCLDN18陽性に限定される。 肝転移・腹膜播種などの進行が早く、 病理検査結果を待てない症例はCAPOX/FOLFOXなどBackbone chemotherapyだけ開始して、 後に抗HER2薬・ICI・抗CLDN18.2薬を併用するのも治療戦略の一つとなる⁶⁾。
化学療法単独と比較して、 ゾルベツキシマブ併用による奏効割合の上乗せがないため、 投与対象の状況 (CPS、 コンバージョンを狙えるかどうか) を考慮して、 他の薬剤 (ICI等) との比較検討を行う。
悪心・嘔吐管理の重要性
悪心・嘔吐はゾルベツキシマブ投与中に発生する急性期のものと、 CAPOX/FOLFOXによる急性期・遅発期・超遅発期のものがある。 胃癌自体で経口摂取量低下している場合においては遅発期・超遅発期の悪心・嘔吐リスク増大を考慮した場合、 NK1受容体拮抗薬はホスネツピタントが考慮される。
投与中の悪心・嘔吐、 特に突発的に嘔吐する症例もいるので、 スタッフに事前に嘔吐時対応の事前教育と指示が必要である。
オキサリプラチン投与の規定と実臨床での調整
SPOTLIGHT試験では12コース⁷⁾、 GLOW試験で8コースのオキサリプラチン投与が規定されていた⁶⁾。 しかし2次治療におけるPTX+RAMへのシークエンスを考慮すると、 リアルワールドでは化学療法誘発性末梢神経障害を回避するために前者は8コース、 後者は6コース程度の計画中止も選択肢となりうる。
初回投与時の注意点と患者背景の考慮
ゾルベツキシマブ初回投与における悪心・嘔吐・腹痛制御が、 その後の治療継続性に影響する。 患者さんにとって初めての抗癌薬投与であることから、 2回目以降に予測性悪心・嘔吐を出現しないよう配慮した投与が必要である。
薬剤の安定性の観点から、 ゾルベツキシマブは開始6時間以内での投与終了が必要である。 しかしながら、 初回投与時は最大6時間かけてでも悪心、 嘔吐が軽度に収まる投与速度で終了すべきである。 オキサリプラチンの投与もあわせ長時間投与となるため、 初回は入院で導入すべきである。
例外として胃全摘の症例では投与中の悪心・嘔吐が少ないとされており、 患者背景も考慮する。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
出典
- アステラス製薬株式会社. ビロイ®電子添文 (2024年6月改訂第2版) [最終閲覧 : 2024/6/10]
- アステラス製薬株式会社. ビロイ®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/6/10]
- チェプラファーム株式会社. ゼローダ®電子添文 (2024年2月改訂 第3版) [最終閲覧 : 2024/04/23]
- チェプラファーム株式会社. ゼローダ®適正使用ガイド (2024年2月改訂) [最終閲覧 : 2024/04/23]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/04/23]
- Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med. 2023 Aug;29(8):2133-2141. PMID: 37524953
- Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2023 May 20;401(10389):1655-1668. PMID: 37068504
最終更新日 : 2024年7月18日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。