新薬承認情報
2年前
オプジーボ 「悪性中皮腫」 等への適応追加 -11月の変更承認情報まとめ-
新規、 一部変更を含め9種類を承認
医薬品医療機器総合機構 (PMDA) は、 2023年11月に9種類の医薬品が厚生労働省から承認を受けたと発表した。 うち新薬は2剤であり、 残る7剤は一部変更承認である。
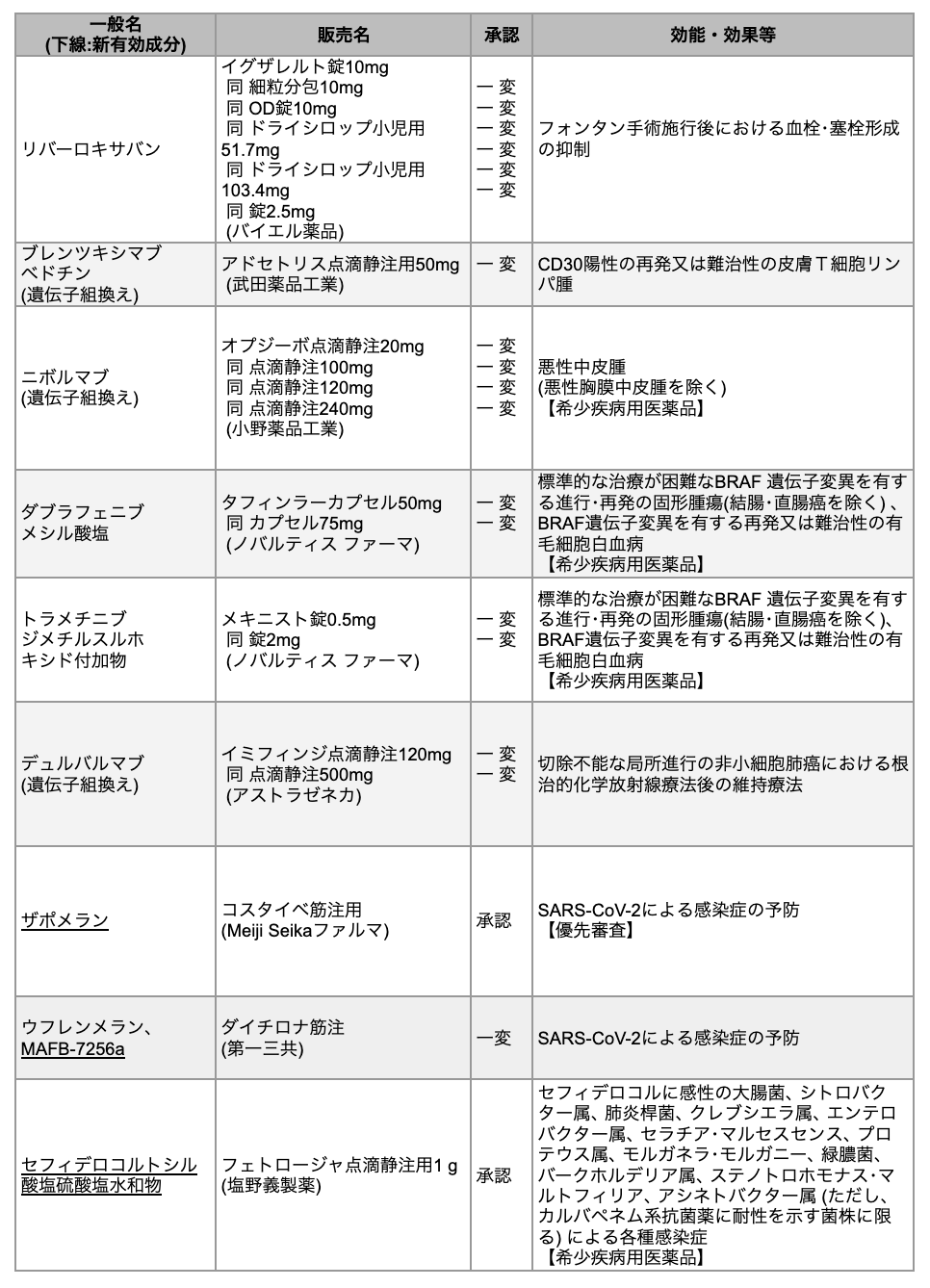
(PMDA発表データを基に編集部作成)
【更新】2023/12/4 11月28日~30日に承認された以下の3剤の情報を表に追加しました。
・ザポメラン
・ウフレンメラン、 MAFB-7256a
・セフィデロコルトシル酸塩硫酸塩水和物
リバーロキサバン
抗凝固薬リバーロキサバン (商品名イグザレルト) は、 フォンタン手術施行後における血栓・塞栓形成の抑制を効能・効果として追加承認された。 フォンタン手術は、 先天性心疾患患者を対象に、 低酸素血症 (チアノーゼ) の改善と心室容量負荷の軽減を目的として行われる。 フォンタン手術後の患児は血栓塞栓症の発現リスクが高いことから、 アスピリンまたはワルファリンの投与が推奨されているが、 投与にあたっての薬物相互作用への配慮や採血が患児および医療従事者の負担となっていた。
ブレンツキシマブ ベドチン
抗体薬物複合体ブレンツキシマブ ベドチン (商品名アドセトリス) は、 CD30陽性の再発または難治性の皮膚T細胞リンパ腫 (CTCL) に対して追加承認された。 悪性リンパ腫の一種であるCD30陽性CTCLに対して現在選択されているほとんどの治療法は十分な奏効率、 奏効期間ではないことが多く、 依然としてアンメットニーズの高い疾患であることから、 新たな作用機序を持つ治療法が望まれていた。
ニボルマブ
抗PD-1抗体ニボルマブ (商品名オプジーボ) は、 悪性中皮腫 (悪性胸膜中皮腫を除く) に対して追加承認された。 今回追加された適応の用法・用量は、 既承認である再発または遠隔転移を有する頭頸部癌、 および原発不明癌と同様となる。 なお、 同薬は2017年に悪性胸膜中皮腫に関する希少疾病用医薬品に指定されており、 同疾患に対する効能・効果の承認は既に取得している。
ダブラフェニブ・トラメチニブ
BRAF阻害薬ダブラフェニブ(商品名タフィンラー)およびMEK阻害薬トラメチニブ(商品名メキニスト)は、 いずれも、 標準的な治療が困難なBRAF遺伝子変異陽性で進行・再発性の固形腫瘍 (結腸・直腸癌を除く) 、 およびBRAF遺伝子変異陽性で再発または難治性の有毛細胞白血病を適応として追加承認された。 いずれの適応疾患も両薬の併用療法での承認となり、 固形腫瘍に対しては初の癌種横断的適応となる。 また、 同併用療法は、 BRAF遺伝子陽性の悪性黒色腫および非小細胞肺癌 (NSCLC) に対しても、 既に国内で承認されている。
デュルバルマブ
抗PD-L1抗体デュルバルマブ(商品名イミフィンジ)は、 切除不能な局所進行NSCLCにおける根治的化学放射線療法後の維持療法を効能・効果とする新用量医薬品として追加承認された。 今回の承認により、 1回1,500mgを4週間間隔で60分間以上かけて静脈内投与するように改められた。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。