HOKUTO編集部
10ヶ月前
子宮体癌の1次治療にICI、 デュルバルマブとオラパリブが登場

2024年11月、 進行・再発子宮体癌に対する新たな1次治療として、 抗PD-L1抗体デュルバルマブ (商品名イミフィンジ®) とPARP阻害薬オラパリブ (商品名リムパーザ®)が適応追加承認された。 同年12月に開催された製造販売元・アストラゼネカ社主催のメディアセミナーでは、 東京慈恵会医科大学産婦人科学講座主任教授の岡本愛光氏が 「進行・再発子宮体癌治療における現状と課題」 について、 同講座講師・診療医長の西川忠曉氏が 「進行・再発子宮体癌の新たな治療選択肢~イミフィンジの新たな可能性とリムパーザを併用することによる相乗効果~」 について、 それぞれ臨床医の立場から解説した。
進行子宮体癌治療の現状と課題

岡本愛光氏 (東京慈恵会医科大学産婦人科学講座主任教授)
子宮体癌の分類は分子遺伝学的分類へ
岡本氏によると、 子宮体癌では近年、 分子遺伝学的分類が導入されつつある。
分子遺伝学的分類の4つの型は予後と相関
類内膜癌、 漿液性癌を含む子宮内膜癌は、 2013年に報告された癌ゲノムアトラス (TCGA) プロジェクトによる網羅的分子遺伝学的解析の結果、 遺伝子の変異や発現状況に基づいて、 ①POLE (ultramutated)、 ②MSI (hypermutated)、 ③Copy-number low、 ④Copy-number high―の4つの型に分類できることが示された¹⁾²⁾³⁾。 この4つの型は予後とも相関することが示されている¹⁾³⁾。
2018年にProMisE分類が提唱
その後、 前述の包括的ゲノム解析を基にしたTCGA分類に替わり、 ミスマッチ修復 (MMR) 関連タンパクおよび癌抑制遺伝子p53の免疫組織化学染色 (IHC) による変異パターンを用いた分類法として、 2018年に"ProMisE"が提唱された²⁾⁴⁾。 ProMisEによる分類でも、 予後はTCGA分類と同様の傾向が示された²⁾。
WHO分類第5版では分子遺伝学的分類を採用
このことを受け、 2020年に改訂された子宮体癌WHO分類 (第5版) では、 類内膜癌を①POLE-ultramutated、 ②MMR-deficient、 ③p53-mutant、 ④非特異的分子プロファイル (NSMP) ―に区分する分子遺伝学的分類が採用された。
NSMPはPOLEの病的変異、 MMR異常、 TP53変異のいずれも起こっていない状態であり、 TCGA分類のCopy-number low、 ProMisEのp53野生型に相当する。
dMMRの子宮体癌ではICIが高効果
MMR機能は、 DNA複製の際に生じる相補的ではない塩基対合 (ミスマッチ) を修復するもので、 MMR機能が低下した状態をMMR deficient (dMMR)、 機能が保たれた状態をMMR proficient (pMMR) と表現する⁵⁾。
dMMR細胞は腫瘍変異負荷 (TMB) が高く、 免疫チェックポイント阻害薬 (ICI) が効果を示した報告があり⁶⁾、 "Hot tumor"といわれる。 pMMR細胞では、 ICIの効果は限定的との報告があり⁶⁾⁷⁾、 "Cold tumor"といわれる。
dMMRはさまざまな癌種で検出されており、 子宮内膜癌で最も高頻度に検出されたとの報告がある⁸⁾。
現行のガイドラインの推奨
欧米 : ICI選択にdMMR判定検査を推奨
米国病理医協会/ASCOのICI治療のためのMMR/MSI検査のガイドライン (2023年版) では、 子宮内膜癌のMMR欠損の判定法としてMMR IHCが推奨されている⁹⁾。
また、 欧州臨床腫瘍学会 (ESMO) の癌免疫療法のためのMSI検査に関するガイドライン (2019年版) では、 MSIの判定法として、 まずMMR IHCの実施を推奨している¹⁰⁾。
日本 : ICIを1次治療で使用できず
日本婦人科腫瘍学会による『子宮体がん治療ガイドライン 2023年版』では、 子宮体癌の主な薬物療法レジメンとして、 ①AP (ドキソルビシン+シスプラチン[CDDP]) 療法、 ②TC (パクリタキセル[PTX]+カルボプラチン) 療法、 ③TAP (PTX+ドキソルビシン+CDDP) 療法、 ④LP (レンバチニブ+ペムブロリズマブ) 療法 (2次治療以降)、 ⑤ペムブロリズマブ単剤療法 (2次治療以降) ―が挙げられている。
すなわち、 これまで日本では、 ICIを1次治療で使用できなかったため、 治療選択肢が限られていた。
子宮体癌の1次治療にICIが初めて登場
岡本氏は 「手術後の薬物療法において、 これまではICIを1次治療で使用できなかったため、 治療選択肢が限られていた。 今回承認されたDUO-Eレジメン (デュルバルマブ±オラパリブ) の承認は、 ミスマッチ修復機能 (MMR) の状態に関係なく、 初めて免疫療法を1次治療に利用できるようになることで、 今後、 患者さんの治療選択肢が増える」 と展望した。
<出典>
1) 日本婦人科腫瘍学会編: 子宮体がん治療ガイドライン 2023年版
2) 日本産科婦人科学会・日本病理学会編: 子宮体癌取扱い規約 病理編 第5版
3) Nature. 2013 May 2;497(7447):67-73.
4) Br J Cancer. 2015 Jul 14;113(2):299-310.
5) 日本癌治療学会編: がん診療ガイドライン. ゲノム診療 dMMR固形がん
6) J Clin Med. 2022 Jul 5;11(13):3912.
7) ESMO Open. 2022 Dec;7(6):100635.
8) Science. 2017 Jul 28;357(6349):409-413.
9) J Clin Oncol. 2023 Apr 1;41(10):1943-1948.
10) Ann Oncol. 2019 Aug 1;30(8):1232-1243.
新たな治療選択肢DUO-Eレジメン

西川忠曉氏 (東京慈恵会医科大学産婦人科学講座 講師・診療医長)
DUO-Eレジメンとは
デュルバルマブ (商品名 : イミフィンジ®) は、 進行・再発子宮体癌に対し、 1次治療としてのデュルバルマブ+化学療法併用、 およびそれに続くデュルバルマブ単剤による維持療法として、 MMRの有無に関わらず承認された。 また、 ミスマッチ修復機能正常 (pMMR) 患者に対しては、 維持療法としてのデュルバルマブ+オラパリブ (商品名 : リムパーザ®) 併用療法が併せて承認された。 なお、 承認は第Ⅲ相試験DUO-E¹⁾の結果に基づく。
国際第III相試験DUO-Eについて
試験概要 : デュルバルマブ±オラパリブを検証
新たに診断された進行または再発子宮体癌患者を対象とした第Ⅲ相試験DUO-Eでは、 初回治療としてデュルバルマブと白金製剤ベースの化学療法 (カルボプラチン+パクリタキセル) の併用療法後に、 デュルバルマブ+オラパリブの併用 (DUO-E Triplet群) またはデュルバルマブ単剤 (DUO-E Doublet群) による維持療法を、 白金製剤ベースの化学療法単独 (TC群) を対照として比較評価した。
対象患者718例は、 DUO-E Triplet群239例、 DUO-E Doublet群238例、 TC群241例に無作為に割り付けられた。
主要評価項目は、 担当医評価による無増悪生存期間 (PFS、 検証的解析項目)。 副次評価項目は 全生存期間 (OS、 検証的解析項目)、 全奏効率 (ORR)、 奏効期間 (DOR)、 安全性などであった。

患者背景 : アジア人は30%、 pMMRは80%
患者背景は治療群間で概ね同様であった。 本試験の特徴として、 アジア人が各群およそ30%、 pMMRがおよそ80%といずれも多くを占めており、 組織型として癌肉腫が含まれている。
Triplet群のPFS : 増悪リスクを45%低減
主要評価項目であるPFS中央値は、 DUO-E Triplet群で15.1ヵ月 (95%CI 12.6-20.7ヵ月)、 TC群では9.6ヵ月 (同9.0-9.9ヵ月) で、 TC群に対するDUO-E Triplet群の優越性が示された [HR 0.55 (95%CI 0.43-0.69)、 p<0.0001 (検証的解析のp値)]。
Doublet群のPFS : 増悪リスクを29%低減
また、 PFS中央値はDUO-E Doublet群で10.2ヵ月 (95%CI 9.7-14.7ヵ月) であり、 TC群に対するDUO-E Doublet群の優越性も示された [HR 0.71 (95%CI 0.57-0.89)、 p=0.003 (検証的解析のp値)]。
DUO-E Doublet群に対するDUO-E Triplet群のHRは0.78 (95%CI 0.61-0.99) であった。
日本人のPFS : Triplet群で有意に改善
PFSのサブグループ解析では、 日本人集団では、 TC群に対するDUO-E Triplet群のHRは0.44 (95%CI 0.22-0.85)、 DUO-E Doublet群のHRは0.61 (95%CI 0.32-1.12) であり、 DUO-E Triplet群で有意な改善が示された。
pMMR集団のPFS:Triplet群でより改善
同じくPFSのサブグループ解析におけるpMMR集団では、 TC群に対するDUO-E Triplet群のHRは0.57 (95%CI 0.44-0.73)、 DUO-E Doublet群のHRは0.77 (95%CI 0.60-0.97) であり、 両群いずれも有意な改善が示された。 また、 DUO-E Doublet群に対するDUO-E Triplet群のHRは0.76 (95%CI 0.59-0.99) とDUO-E Triplet群でより改善した。
dMMR集団のPFSでは、 TC群に対するDUO-E Triplet群のHRは0.41 (95%CI 0.21-0.75)、 DUO-E Doublet群のHRは0.42 (95%CI 0.22-0.80) であり、 両群いずれも有意な改善が示された。 また、 DUO-E Doublet群に対するDUO-E Triplet群のHRは0.97 (95%CI 0.49-1.98) と両群に有意差は認められなかった。
PD-L1陽性集団のPFS:両群いずれも改善
さらにPFSのサブグループ解析におけるPD-L1陽性集団では、 TC群に対するDUO-E Triplet群のHRは0.42 (95%CI 0.31-0.57)、 DUO-E Doublet群のHRは0.63 (95%CI 0.48-0.83) であり、 いずれも有意な改善が示された。
PD-L1陰性集団のPFSでは、 TC群に対するDUO-E Triplet群のHRは0.80 (95%CI 0.55-1.16)、 DUO-E Doublet群のHRは0.89 (95%CI 0.59-1.34) であり、 いずれも有意差は示されなかった。
OS:immatureも、 いずれも優越性は示せず
中間解析 (maturityは27.7%) において、 副次評価項目のOSは、 DUO-E Triplet群で未到達 (95%CI NE-NE)、 TC群で25.9ヵ月 (同23.9ヵ月-NE) で、 TC群に対するDUO-E Triplet群の優越性は示されなかった [HR 0.59 (95%CI 0.42-0.83)、 p=0.003 (検証的解析のp値)]。
また、 DUO-E Doublet群ではOS中央値は未到達 (95%CI NE-NE) で、 TC群に対するDUO-E Doublet群の優越性も示されなかった [HR 0.77 (95%CI 0.56-1.07)、 p=0.12 (検証的解析のp値)]。
安全性:既報と概ね一致
全試験期間でDUO-E Triplet群の237例 (99.6%)、 DUO-E Doublet群の232例 (98.7%)、 TC群の236例 (100.0%) に有害事象が発現した。 主なものとして貧血 (それぞれ61.8%、 47.2%、 54.2%)、 悪心 (54.6%、 40.9%、 44.5%)、 脱毛症 (50.8%、 50.2%、 50.0%)、 疲労 (39.1%、 34.9%、 36.9%)、 便秘 (32.8%、 27.2%、 34.3%) などが報告された。
適応となる患者
これらより、 西川氏は、 デュルバルマブ (イミフィンジ®) およびオラパリブ (リムパーザ®) の適応となる患者について、 以下を示した。
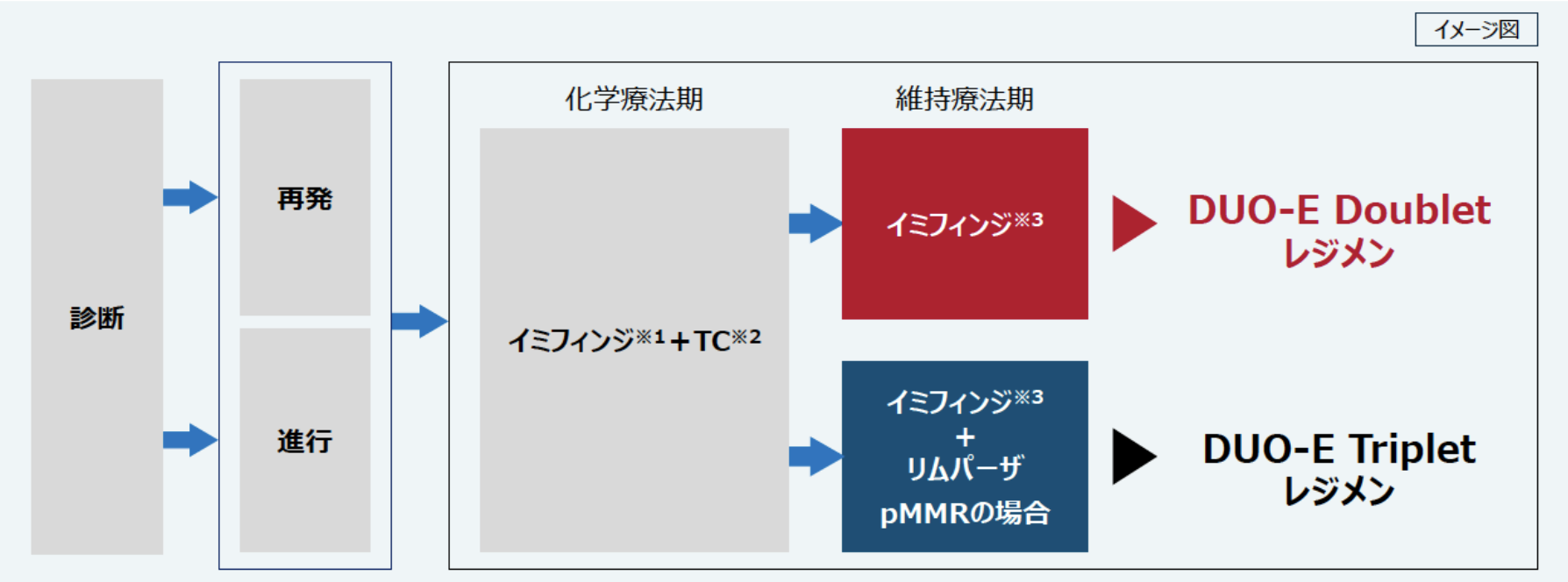
※1 : 1,120mgを3週に1回※2 : カルボプラチン+パクリタキセルを3週に1回、 最大6サイクル ※3 : 1,500mgを4週に1回
(アストラゼネカ株式会社提供資料から転載)
なお、 維持療法については回数の制限が設けられていない。 これについて西川氏は、 「維持療法を3~5年と長期に継続するべきかどうかについてはまだデータもないため、 現状では患者とのShared Decision Making (共同意思決定) に基づき各判断をしていくことになると思う。 ただし、 前提として、 DUO-E試験の結果を実臨床に実装するうえでに”病勢進行を認めるまで (until PD) 投与する”という方針は重要であると考える」 とコメントした。
求められるPrecision Medicineの実装
西川氏は 「進行・再発子宮体癌の1次治療において、 初めてのICIと、 化学療法やPARP阻害薬を用いた複合免疫療法によるパラダイムシフトの始まりである。 婦人科癌診療医は、 分子遺伝学的分類に基づき、 どの薬剤を選択し、 どのように治療戦略を組み立て、 患者さんへ最大限のメリットを届けるかという、 かつて経験したことがない課題に向き合う必要がある」 と総括した。
<出典>
1) J Clin Oncol. 2024 Jan 20;42(3):283-299.
関連レジメン
パクリタキセル + カルボプラチン + デュルバルマブ + オラパリブ | 子宮体癌 > 再発転移後 (一次治療)
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。