HOKUTO編集部
1年前
胃癌バイオマーカー検査 4つの比較 (検査の手引き 第1.1版より)

「切除不能進行・再発胃癌バイオマーカー検査の手引き 第1.1版」¹⁾が日本胃癌学会より公開された。 本改訂では、 CLDN18.2をターゲットとしたゾルベツキシマブの臨床応用開始をはじめ、 各治療薬の適応拡大を反映している。 本稿では、胃癌バイオマーカー検査で用いられる体外診断用医薬品・医療機器を紹介する。
HER2
(1) 該当薬剤
- トラスツズマブ (ハーセプチン®)
- トラスツズマブ デルクステカン (エンハーツ®)
(2) 薬事上の位置付け
適用判断に必須 (体外診断用医薬品*)
*2013年7月1日付のコンパニオン診断薬に関する厚労省課長通知以前に最初に承認されたため、 薬事上の位置づけは 「体外診断用医薬品」 であるが、 「みなしコンパニオン診断薬」 として使用
(3) 使用検体
FFPE組織 (ホルマリン固定パラフィン包埋)
(4) 検査キット
免疫組織化学(IHC)
- ダコHercepTest II
- ベンタナ ultraView パスウェーHER2 (4B5)
- ヒストファイン HER2キット (MONO)
- ヒストファイン HER2キット (POLY)
- BondポリマーシステムHER2テスト
in-situ Hybridization (ISH)
- パスビジョンHER-2 DNAプローブキット
- ヒストラHER2 FISHキット
- ヒストラHER2 CISHキット
- ベンタナDISH HER2キット
(5) 推奨される検体固定条件
固定液 : 10%中性緩衝ホルマリン
固定時間 : 6~72時間 (各ガイドラインで異なる)
「乳癌・胃癌HER2 病理診断ガイドライン(第2版)」では6~48時間、 「胃癌取扱い規約 (第15版)」では6~72時間
(6) 結果の解釈
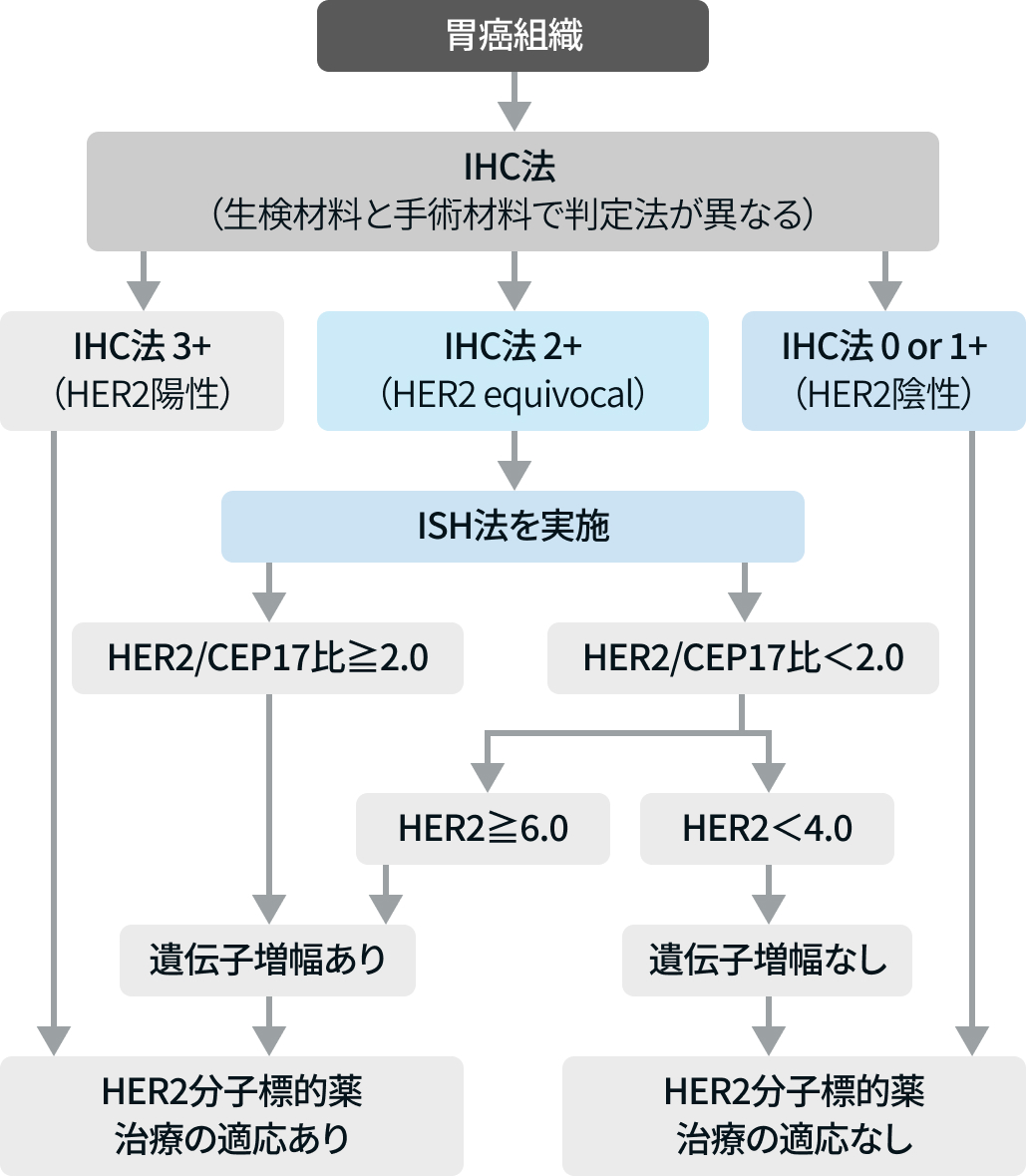
(文献1より引用)
まずは免疫組織化学(IHC)法を実施する。 3+はHER2陽性で「HER2分子標的薬の治療適応あり」 と判断する。 0または1+はHER2陰性で「HER2分子標的薬の治療適応なし」と判断する。 2+の場合は境界域 (equivocal)であり、 ISH法を実施して判断する。
Claudin 18
(1) 該当薬剤
ゾルベツキシマブ (ビロイ®)
(2) 薬事上の位置付け
適用判断に必須 (コンパニオン診断薬)
(3) 使用検体
FFPE組織 (ホルマリン固定パラフィン包埋)
(4) 検査キット
免疫組織化学(IHC)
ベンタナ OptiView CLDN18 (43-14A)
(5) 推奨される検体固定条件
固定液 : 10%中性緩衝ホルマリン
固定時間 : 6~48時間
(6) 結果の解釈
細胞膜に中等度~強い染色が認められる腫瘍細胞の割合で判断する。
CLDN18陽性 : 腫瘍細胞の割合が75%以上
CLDN18陰性 : 腫瘍細胞の割合が75%未満
PD-L1
(1) 該当薬剤
- ニボルマブ (オプジーボ®)
- ペムブロリズマブ (キイトルーダ®)
(2) 薬事上の位置付け
適用判断に考慮が望ましい (体外診断用医薬品*)
*コンプリメンタリー診断薬として使用
(3) 使用検体
FFPE組織 (ホルマリン固定パラフィン包埋)
(4) 検査キット
免疫組織化学(IHC)
- PD-L1 IHC 28-8 pharmDx「ダコ」
- PD-L1 IHC 22C3 pharmDx「ダコ」
(5) 推奨される検体固定条件
固定液 : 10%中性緩衝ホルマリン
固定時間 : 検査キットによって異なる
PD-L1 IHC 28-8 pharmDx 「ダコ」 : 24~48時間
PD-L1 IHC 22C3 pharmDx「ダコ」 : 12~72時間
(6) 結果の解釈
PL-D1発現率の測定には、 CPS (combined positive score) が用いられる。
詳細は各添付文書等を確認されたい
▼PD-L1 IHC 28-8 pharmDx 「ダコ」
ニボルマブと化学療法の併用療法を行う胃癌患者の特定のための補助に用いる。 🔗添付文書

▼PD-L1 IHC 22C3 pharmDx「ダコ」
ペムブロリズマブと化学療法併用を行う胃癌患者の特定のための補助に用いる。 🔗添付文書

▼各検査と薬剤選択について
ニボルマブまたはペムブロリズマブの使用を検討する場合に、 それぞれに対応する PD-L1検査キットを用いて PD-L1の発現を検討することが理想的だが、 日常臨床で両検査を実施することは難しいと想定される。
現時点では、 胃癌ではコンプリメンタリー検査であることから、 両PD-L1検査キットを用いた結果は、 いずれの薬剤 (ニボルマブ・ペムブロリズマブ) の投与を考慮する上でも参考になり得ると考えられる。 ただし、 それぞれのPD-L1検査キットのカットオフが違う点には注意が必要である。
MSI/MMR
(1) 該当薬剤
- ペムブロリズマブ (キイトルーダ®)
がん化学療法後に増悪した進行・再発のMSI-Hを有する標準的な治療が困難な固形癌が対象
(2) 薬事上の位置付け
適用判断に必須 (コンパニオン診断薬 2次治療~)
(3) 使用検体
FFPE組織 (ホルマリン固定パラフィン包埋) またはMSIは血漿も可能
(4) 検査キット
MSI-H : PCR
- MSI検査キット (FALCO)
MSI-H : 次世代シークエンス解析 (NGS)
- FoundationOne CDx がんゲノムプロファイル
- Guardant360 CDx がん遺伝子パネル
dMMR : 免疫組織化学(IHC)
- ベンタナ OptiView PMS2 (A16-4)
- ベンタナ OptiView MSH2 (G219-1129)
- ベンタナ OptiView MSH6 (SP93)
- ベンタナ OptiView MLH1 (M1)
(5) 推奨される検体固定条件
固定液 : 10%中性緩衝ホルマリン
固定時間 : 検査キットによって異なる
MSI検査キット (FALCO) : 6~48時間
ベンタナ各種 : 6~72時間
(6) 結果の解釈
▼MSI (FALCO)
5種類のMSIマーカー (BAT‑26、 NR‑21、 BAT‑25、 MONO‑27、 NR‑24) の中で、 MSI+と識別されたマーカーの数で判定する。
陽性 (MSI-H) : MSI+のマーカーが2つ以上
陰性 : MSI+のマーカーが1つorなし
▼dMMR (ベンタナ)
4種類のMMRタンパク質 (MLH1、 MSH2、 MSH6、 PMS2) の消失・発現で判定する。
dMMR : MMRタンパク質の1つ以上が消失
pMMR* : MMRタンパク質がすべて発現
*ミスマッチ修復機能保持
免疫染色結果から予想される機能欠損遺伝子を以下に示す。
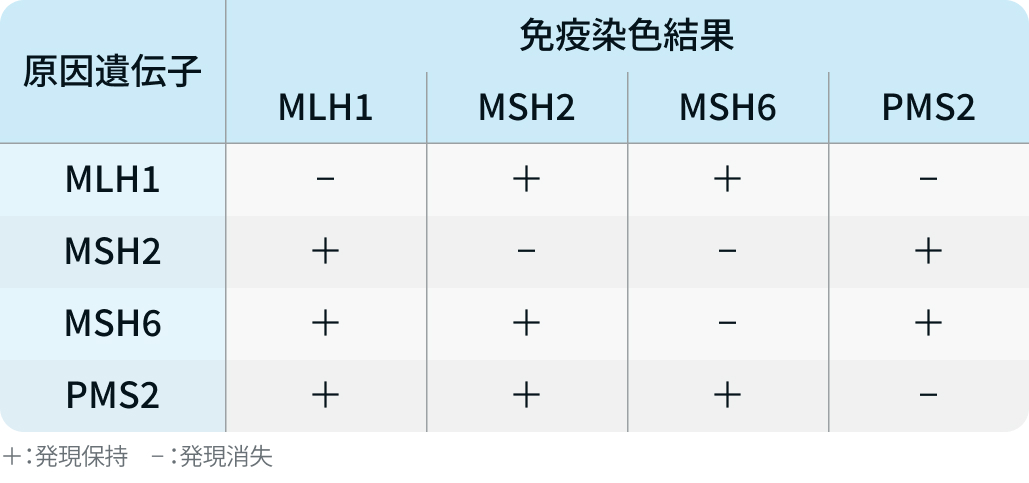
<出典>
1) 日本胃癌学会 : 「切除不能進行・再発胃癌バイオマーカー検査の手引き」 第1.1版.
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。