新薬承認情報
1年前
シクロホスファミド「造血幹細胞移植におけるGVHDの抑制」への適応追加 -2月の変更承認情報まとめ-
5剤を一部変更承認
医薬品医療機器総合機構 (PMDA) は、 2024年2月に5種類の医薬品が厚生労働省から承認を受けたと発表した。 すべて一部変更承認である。
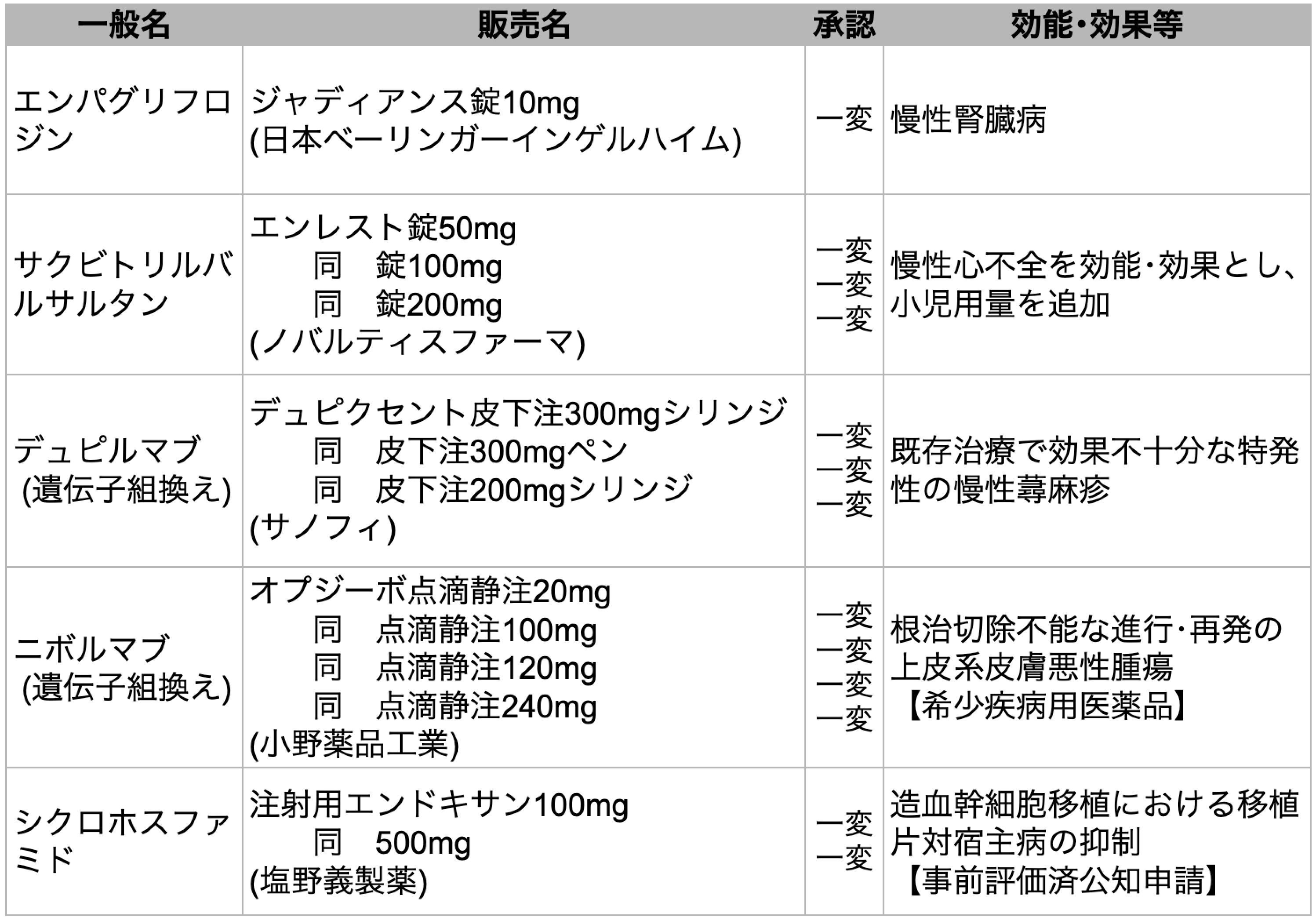
エンパグリフロジン
SGLT2阻害薬エンパグリフロジン (商品名ジャディアンス) は、 II型糖尿病、 慢性心不全に続き、 慢性腎臓病 (CKD) に適応が拡大された。
今回の承認は、 CKD患者6,609例 (うち日本人612例) を対象とした第Ⅲ相臨床試験EMPA-KIDNEYの結果に基づく。 同試験ではエンパグリフロジンの投与により、 主要評価項目であるCKDの進行または心血管死のリスクがプラセボ群に比べて有意に低下した (HR 0.72[95%CI 0.64-0.82]、 p<0.000001)。 また、 CKDを対象としたSGLT2阻害薬の臨床試験としては初めて、 副次評価項目の1つであるすべての入院が有意に減少した (HR 0.86[95% CI 0.78-0.95]、 p=0.0025)。
デュピルマブ
抗IL-4/13抗体デュピルマブ(商品名デュピクセント)は、 2型炎症において中心的な役割を果たすタンパク質IL-4およびIL-13の作用を阻害する完全ヒト型モノクローナル抗体製剤である。 今回の 「既存治療で効果不十分な特発性の慢性蕁麻疹」 を効能・効果とする追加承認は世界初となり、 慢性蕁麻疹患者を対象にした第Ⅲ相国際共同試験CUPIDの結果に基づく。同薬の適応症は、 アトピー性皮膚炎、 結節性痒疹、 気管支喘息、 鼻茸を伴う慢性副鼻腔炎と合わせて5つとなった。
従来、 特発性の慢性蕁麻疹の治療には抗ヒスタミン薬が用いられているが、 症状コントロールが得られない患者は多く他の治療選択肢も限られており、 新しい治療選択肢の開発が望まれていた。
ニボルマブ
抗PD-1抗体ニボルマブ(商品名オプジーボ)は、 根治切除不能な進行・再発の上皮系皮膚悪性腫瘍に適応が拡大された。 上皮系腫瘍として系統別分類される有棘細胞癌、 基底細胞癌、 乳房外パジェット病、 皮膚付属器癌 (汗腺癌、 脂腺癌、 毛包癌等) が対象となる。
今回の承認は、 慶應義塾大学病院による医師主導治験である多施設共同非盲検非対照試験NMSC-PD1 (KCTR-D014) の結果に基づく。 国内において、 根治切除不能な進行・再発の上皮系皮膚悪性腫瘍に対する標準治療はいまだ確立されておらず、 新たな治療選択肢の開発が期待されていた。
なお同薬は2023年5月、 根治切除不能な進行・再発の上皮系皮膚悪性腫瘍を対象に希少疾病用医薬品に指定されている。
シクロホスファミド
抗悪性腫瘍薬シクロホスファミド(商品名エンドキサン)は、 公知申請に係る事前評価の結果に基づき、 造血幹細胞移植における移植片対宿主病の抑制を効能または効果として一部変更承認された。
HLA半合致移植を実施する場合に同薬の適応を考慮し、 投与量および投与スケジュール等については、 「通常、 シクロホスファミド (無水物換算) として、 1日1回50 mg/kgを2~3時間かけて点滴静注し、 移植後3日目および4日目、 または移植後3日目および5日目の2日間投与する。 なお、 患者の状態により適宜減量する」 とされた。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。