新薬承認情報
9ヶ月前
【新発売】アミバンタマブ(ライブリバント®)~EGFR exon20挿入変異陽性NSCLCに対して~

EGFR-MET二重特異性抗体アミバンタマブが、 「EGFR遺伝子エクソン20挿入変異陽性の切除不能な進行・再発の非小細胞肺癌」 に対して2024年9月に承認、 11月20日に薬価収載されました。 HOKUTOレジメンからその概要を紹介します。
薬剤情報
ライブリバント® (添付文書¹⁾/適正使用ガイド*²⁾)
EGFR/MET二重特異性抗体 アミバンタマブ
*ヤンセンファーマ株式会社の外部サイトへ遷移します
効能または効果
EGFR遺伝子エクソン20挿入変異陽性の切除不能な進行・再発の非小細胞肺癌
薬価
350mg7mL1瓶 16万14円
投与スケジュール
【1コース】21日間
【催吐性】 高度催吐性*
【FN発症】低リスク**
*Amivantamabは軽度催吐性、 CBDCA/PEMは高度催吐性 **PAPILLON試験におけるFN発症割合1%と記載されている³⁾
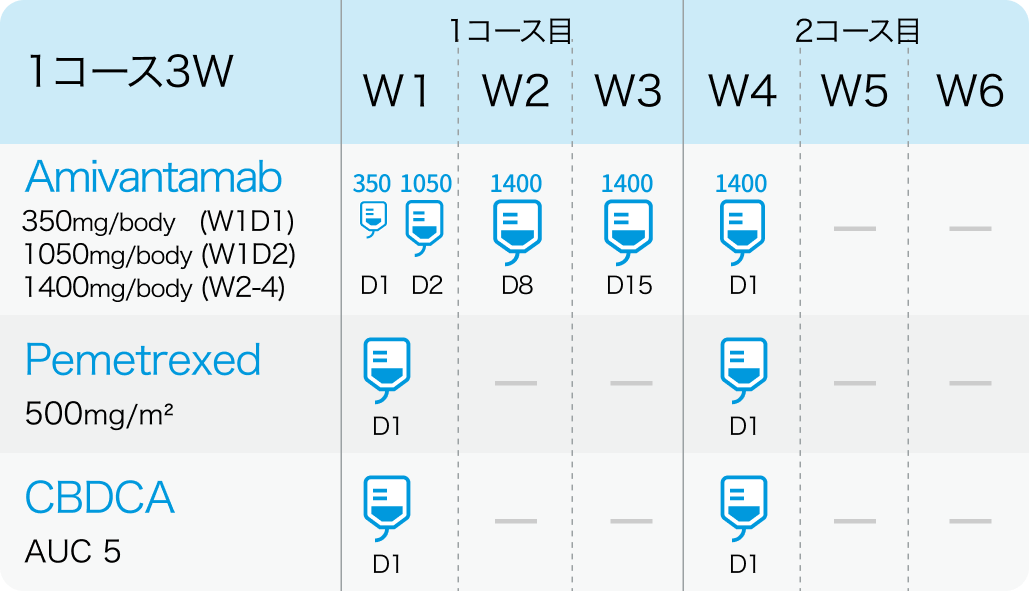
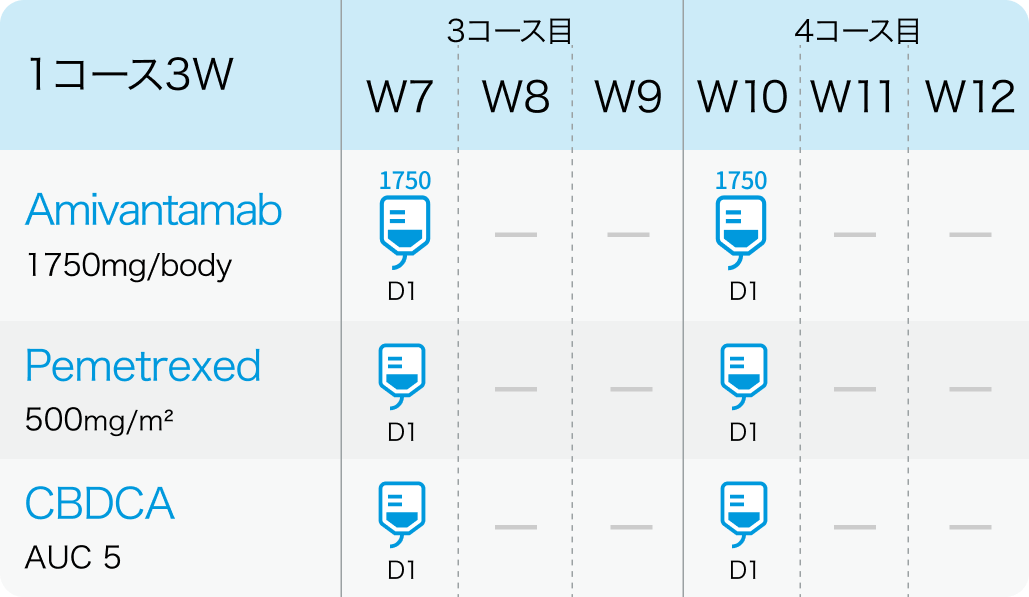
PAPILLON試験³⁾のプロトコル
1、2コース目
3、4コース目
5コース目以降
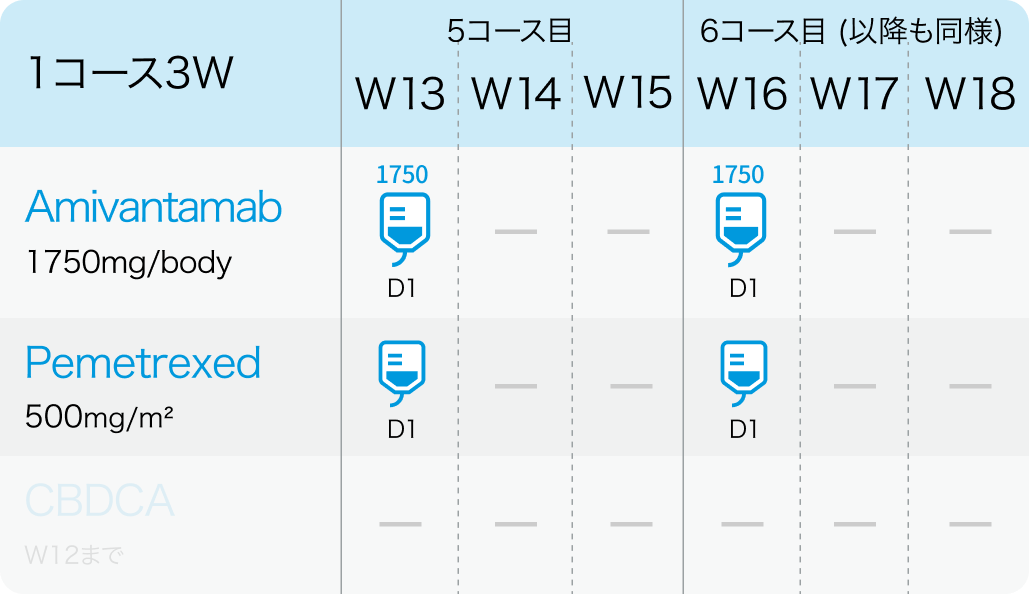
*W1は1週目、 D1は1日目を指す
アミバンタマブ (PDまで継続)
1400mg (≧体重80kgの場合は1750mg) を4週目まで週1回投与する。 ただし、 1週目はDay1 350mg、 Day2 1,050mgの分割投与とする。
その後、 1750mg (≧体重80kgの場合は2100mg) を3コース目以降の各コース Day1に静脈内投与する。 疾患進行が認められるまで維持投与する。
N Engl J Med. 2023 Nov 30;389(22):2039-2051.³⁾より引用
ライブリバント®の投与量及び投与速度
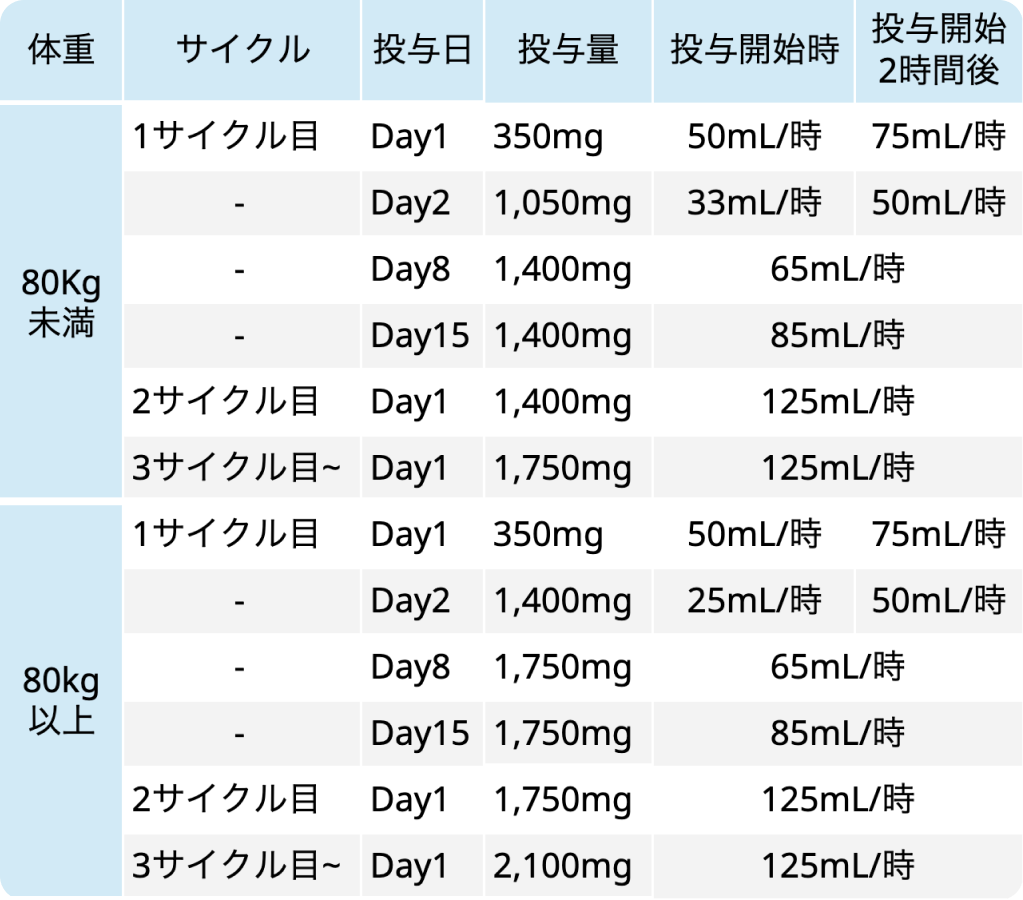
ライブリバント®添付文書¹⁾より引用
ペメトレキセド (PDまで継続)
500mg/m²を各コースのDay 1に静脈内投与する。 疾患進行が認められるまで維持投与する。
N Engl J Med. 2023 Nov 30;389(22):2039-2051³⁾より引用
カルボプラチン (4コースまで)
AUC 5を1-4コースのDay 1に静脈内投与する。
N Engl J Med. 2023 Nov 30;389(22):2039-2051.³⁾より引用
KeyData|臨床試験結果
PAPILLON試験¹⁾
新たに診断されたEGFRエクソン20挿入変異を有する進行性または転移性NSCLC308例を対象として、 Amivantamabと化学療法を併用した場合の有効性と安全性を化学療法単独群と比較した無作為化非盲検第III相試験
【有効性】Amivantamab+化学療法群
- ORR : 73%
- mPFS : 11.4ヵ月
- 2年OS : 72%
【安全性】主な有害事象 (カッコ内 Grade3~4)
- 好中球数減少 58.9% (33.1%)
- 爪囲炎 56.3% (6.6%)
- 発疹 53.6% (11.3%)
- 貧血 50.3% (10.6%)
- 輸液関連の反応 41.7% (1.3%)
- 低Alb血症 41.1% (4.0%)
- 便秘 39.7% (0%)
- 白血球数減少 37.7% (11.3%)
- 悪心 36.4% (0.7%)
- 血小板数減少 36.4% (9.9%)
- 食欲低下 35.8% (2.6%)
- ALT増加 33.1% (4.0%)
- AST増加 31.1% (0.7%)
- ざ瘡様皮疹 31.1% (4.0%)
- 末梢浮腫 29.8% (1.3%)
- 口内炎 25.2% (1.3%)
- COVID-19 23.8% (2.0%)
- 下痢 20.5% (3.3%)
- 低K血症 21.2% (8.6%)
- 嘔吐 21.2% (3.3%)
- 無力症 19.9% (5.3%)
- 発熱 15.9% (0%)
- 倦怠感 15.2% (0.7%)
- γ-GTP増加 13.9% (2.6%)
- 咳嗽 13.9% (0%)
N Engl J Med. 2023 Nov 30;389(22):2039-2051³⁾より引用
レジメンの特徴と注意点
遺伝子パネル検査・コンパニオン診断
2024年8月に「Guardant360® CDxがん遺伝子パネル」 が、 9月には「オンコマイン Dx Target Test マルチ CDxシステム」が、 アミバンタマブに対する適応を取得。 その他の最新情報については、 日本肺癌学会の各種手引きやHOKUTO編集部のまとめコンテンツを参照すること。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
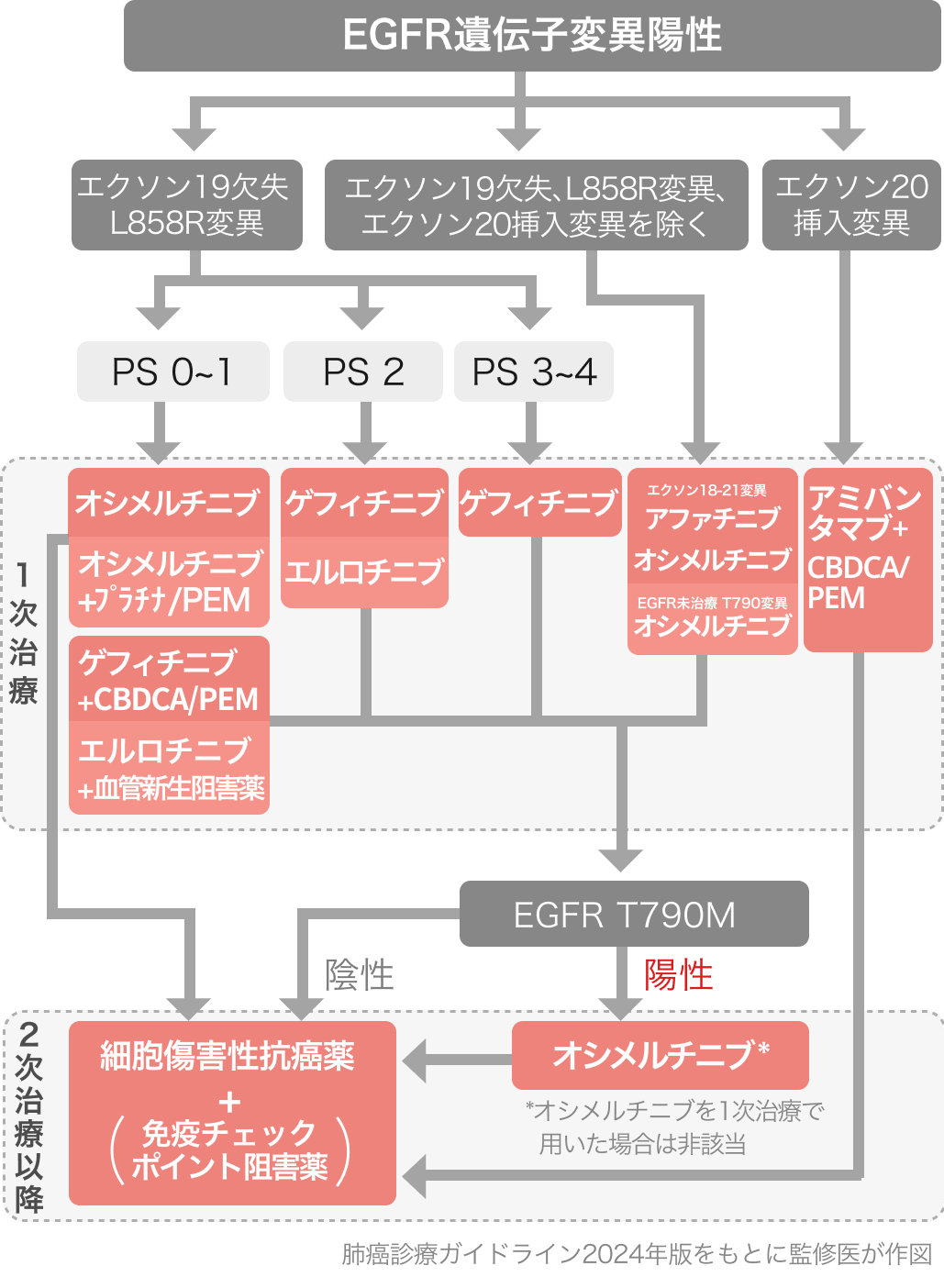
肺癌診療ガイドライン2024年版の記載
2023年では「エクソン20挿入変異の1次治療としてEGFR-TKI療法を行わないように」 との推奨であったが、 2024年版ではPAPILLON試験の結果をもって、 本レジメンが1次治療として強く推奨されることとなった [1B]。
注意すべき有害事象
PAPILLON試験³⁾で報告された、 警告および注意にあたる有害事象とその対応、 減量・中止率は以下のとおりである。
インフュージョンリアクション
大部分が初回注入時に発症し、 発症時間中央値は注入開始1時間と報告されている。 IRRを予防するための前投薬として、 1サイクル目の第1日目及び第2日目は、 副腎皮質ホルモン剤、 抗ヒスタミン剤及び解熱鎮痛剤を投与し、 必要に応じてH2受容体拮抗剤や制吐剤を投与する。 1サイクル目の第8日目以降は、 抗ヒスタミン剤及び解熱鎮痛剤を投与し、 必要に応じて副腎皮質ホルモン剤、 H2受容体拮抗剤や制吐剤を投与する。
次項のPAPILLON試験³⁾における前投与薬規定を参照
AE発生率 : 42% (うち Grade3は1.3%)
減量患者 : 報告なし
中止患者 : 0.7%
皮膚障害
従来の抗EGFR療法と同様に、 ざ瘡様皮疹、 爪囲炎、 皮膚亀裂などの皮膚障害が高率に発現する。 保清・保湿を行い、 ステロイド外用薬を適切に塗布する。 皮膚科と連携して対応する。
AE発生率 : 89% (うち Grade3は19%)
減量患者 : 19%
中止患者 : 2%
間質性肺疾患 (ILD)
疑われた場合は休薬、 発現時は中止する。
PAPILLON試験では本レジメン使用群の2.6%にGrade3が発現し、 全患者で投与中止となった。
AE発生率 : 2.6% (Grade3)
中止患者 : 全患者
参考 : PAPILLON試験³⁾の前投与薬規定
必須のアミバンタマブ投与前投薬*¹ ²
【Cycle1 Day1】グルココルチコイド
デキサメタゾン20mg IV 45~60分前
【Cycle1 Day2】グルココルチコイド
デキサメタゾン10mg IV 45~60分前
or mPSL 40mg IV 45~60分前
【すべてのCycle】抗ヒスタミン剤
ジフェンヒドラミン 25~50mg (or同等薬剤) IV 15~30分または 経口30~60分前
【すべてのCycle】解熱剤
アセトアミノフェン 650~1,000mg (or同等の薬剤) IV 15~30分 または 経口 30~60分前
任意の投与前投薬*¹
【Cycle 1 Day 8以降】グルココルチコイド*³
デキサメタゾン10mg or mPSL 40mg IV 45~60分または経口 60~90分前
【任意のCycle】H2遮断薬
ラニチジン50mg (or同等薬剤) IV15~30分前
【任意のCycle】制吐剤
オンダンセトロン8~16mg (or同等薬剤) 経口またはIV 15~30分前
※1 : 上記表中の薬剤が使用できない場合、 ガイドライン等に従い類似薬を同程度の用量で代替することができる。
※2 : 必須の薬剤が併用禁忌の患者は、 治験担当医師が代替薬を探索すること。 代替薬が上記の目的に適していない場合、 患者は該当する薬剤を服用しなくてもよい。
※3 : Cycle 1 Day 1又はCycle 1 Day 2にインフュージョン・リアクションが認められた患者には、 臨床的に必要な場合、 本剤投与前に、 任意の投与前投薬のステロイドをCycle 1 Day 8から開始して投与してもよい。
適正使用ガイド²⁾より引用 : 社内資料 : アミバンタマブの非小細胞肺患者に対する臨床成績 (61186372NSC3001試験) (CTD2.7.6.1) (承認時評価資料)
出典
1) ヤンセンファーマ株式会社. ライブリバント®点滴静注 電子添文 2024年9月作成 (第1版) [最終確認: 2024/11/26]
2) ヤンセンファーマ株式会社. ライブリバント®点滴静注 適正使用ガイド電子添文 2024年9月作成 [最終確認: 2024/11/26]
4) 日本肺癌学会. 肺癌診療ガイドライン-悪性胸膜中皮腫・ 胸腺腫瘍含む-2024年版
関連コンテンツ
概要や関連する論文・コンテンツをまとめてお届け
岡山大学病院新医療研究開発センター臨床研究部 堀田勝幸氏
最新情報は、PMDA公式サイトでご確認ください
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。