臨床試験データベース
2年前
【BiTS試験】大腸癌に対する隔週TAS-102+ベバシズマブ

切除不能な進行・転移性大腸癌患者において、 トリフルリジン・チピラシル (TAS-102) +ベバシズマブの隔週投与の効果と安全性を検証した単群コホートの第Ⅱ相試験BiTSの結果より、 TAS-102+ベバシズマブ併用療法の有効性と安全性が示された。
原著論文
▼解析結果
関連レジメン
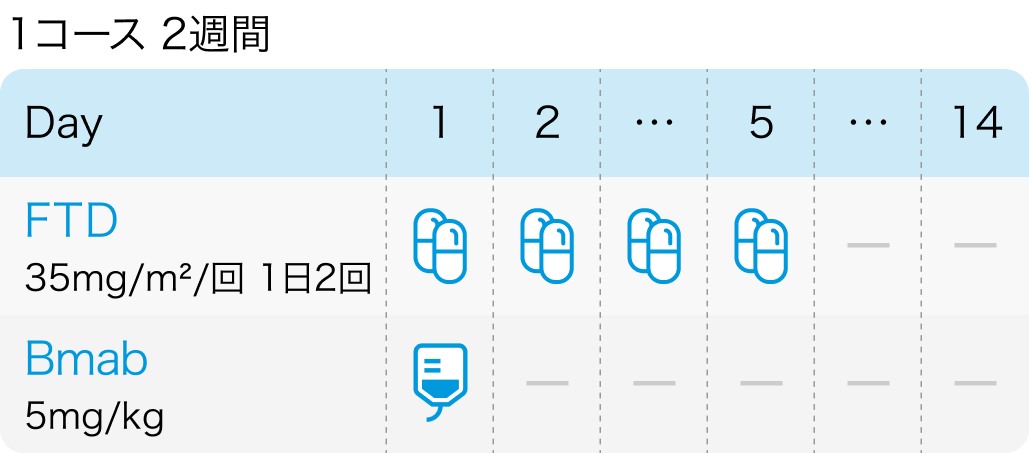
BiTS試験の概要
対象
- 切除不能な進行・転移性大腸癌患者
- 2レジメン以上の治療歴あり
方法
44例に対し、 下記治療を実施
ベバシズマブ5mg/kg day1+TAS-102 35mg/m²⁾を1日2回 day1~5を2週毎投与
評価項目
主要評価項目:16週時の無増悪生存 (PFS) 率
副次評価項目:全生存期間 (OS) 、 PFS、 奏効率 (ORR) 、 安全性
BiTS試験の結果
患者背景
年齢中央値は69歳、 男性24例、 左側原発は70.5%
追跡期間中央値
15.36ヵ月
16週時のPFS率
40.9%
(95%CI 26.3-56.8%)
OS中央値
10.86ヵ月
(95%CI 8.32-13.68ヵ月)
PFS中央値
4.29ヵ月
(95%CI 2.54-5.83ヵ月)
治療成功期間:TTF (中央値)
4.16ヵ月
(95%CI 2.39-5.82ヵ月)
ORR
0%
病勢コントロール率
59.1%
(95%CI 43.3-73.7%)
有害事象 (AE)
- 一般的なGrade3以上のAEは、 高血圧 (40.9%) 、 好中球減少 (15.9%) 、 白血球減少 (15.9%) であった。
- TAS-102の減量は30.4%の患者で行われ、 主な原因は食欲不振であった。
- 投与延期を必要としたのは54.3%で、 主な原因は好中球減少症であった。
- 発熱性好中球減少症に罹患した患者はいなかった。
- 治療関連死亡は認めなかった。
- プロトコール治療中止の原因は、 主に病勢進行 (88.6%) であり、 残り11.4%は有害事象によるものであった。
著者らの結論
切除不能な進行・転移性大腸癌患者に対するTAS-102+ベバシズマブの隔週投与は、 有効な抗腫瘍効果と安全性を示した。
【BiTS試験】大腸癌に対する隔週TAS-102+ベバシズマブの全コンテンツは、医師会員限定でアプリからご利用いただけます*。
*一部のコンテンツは非医師会員もご利用いただけます
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
QRコードから
アプリを
ダウンロード!