新薬承認情報
1年前
【世界初】Dato-DXd、 HR+HER2-進行乳癌に対し国内承認

第一三共は2024年12月27日、 抗TROP2抗体薬物複合体 (ADC) のダトポタマブデルクステカン(Dato-DXd、 商品名ダトロウェイ®) について、 化学療法歴のあるHR陽性かつHER2陰性の手術不能または再発乳癌を効能・効果として世界で初めて日本において承認されたと発表した。
予後不良な再発乳癌への新たな治療選択
早期乳癌の生存率は高いとされる一方、 転移乳癌の予後は不良である。 乳癌患者全体の約7割を占めるホルモン受容体 (HR) 陽性HER2陰性 (IHC 0, IHC 1+またはIHC 2+/ISH-) 乳癌は、 標準治療である内分泌療法の実施後に病勢進行するケースも多く、 新たな治療選択肢が必要とされていた。
TROPION-Breast01試験でPFS改善
今回の承認は、 HR陽性かつHER2低発現または陰性で、 化学療法による前治療歴のある手術不能または再発乳癌を対象に、 2次/3次治療としてのDato-DXd投与の有効性および安全性について、 化学療法投与群と比較評価した第Ⅲ相国際共同無作為化比較試験TROPION-Breast01の結果に基づく。
主要評価項目の1つである全生存期間 (OS) は両群で有意差は示されなかった一方で、 もう1つの主要評価項目である無増悪生存期間 (PFS) は有意な改善を示した (PFS中央値 : 6.9ヵ月 vs 4.9ヵ月、 ハザード比0.63、 p<0.0001) 。
2剤目の抗TROP2 ADC
なお国内では、 抗TROP2 ADCとしてサシツズマブ ゴビテカン (SG、 商品名トロデルビ®) が2024年9月に承認、 11月に販売開始されており、 Dato-DXdは2剤目の抗TROP2 ADCとなる。 ただしSGの適応は 「HR陰性HER2陰性」 であり、 Dato-DXdとは適応が異なる。
薬剤情報
ダトロウェイ® (薬剤情報など掲載準備中)
抗TROP2抗体薬物複合体 (ADC) ダトポタマブ デルクステカン
用法・用量
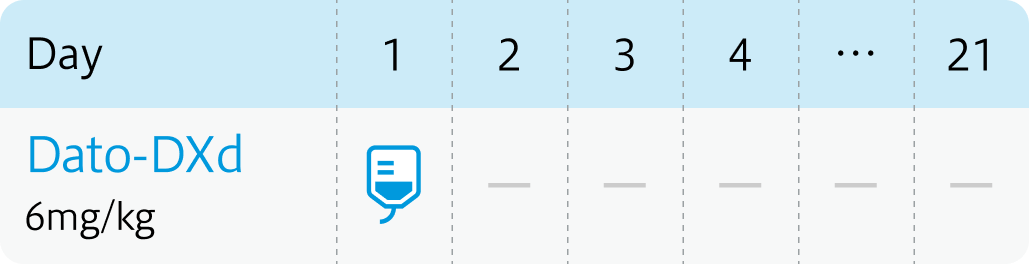
1回6mg/kg (体重) を90分かけて3週間間隔で点滴静注。 初回投与の忍容性が良好であれば2回目以降の投与時間は30分間まで短縮できる。なお患者の状態により適宜減量する。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。