HOKUTO編集部
1年前
【AML編】造血器腫瘍診療ガイドライン2024年版 改訂ポイント

2024年12月、 日本血液学会による『造血器腫瘍診療ガイドライン第3.1版 (2024年版)』が公開された。 今回は、 同ガイドラインのうち急性骨髄性白血病 (AML) の節に関して、 旧版である第3版 (2023年版) からの改訂の主なポイントを聖路加国際病院 血液内科の藤野医師のコメントと共に紹介する。

AML編 主な3つの改訂点

❶ 若年AMLの予後分類がNCCN Ver1.2022から「2022年ELN」 に変更
「CQ1 AMLの治療選択と予後予測のために遺伝子検査は有用か」 の解説において、 2023年版ではNCCNガイドラインVer1.2022の予後分類が記載されていたのに対し、 2024年版では2022年ELNガイドラインの予後分類に変更された。 染色体核型とそれに伴うキメラ遺伝子に基づき、 良好群、 中間群、 不良群の3群に分類される。
2022年ELNガイドラインの予後分類

出典 : Döhner H, et al. Diagnosis and management of AML in adults : 2022 recommendations from an international expert panel on behalf of the ELN. Blood. 2022; 140 (12) : 1345-77.
💬 予後分類における、 大きな変更は寛解導入からキザルチニブが使用可能となりWild-type NPM1 with FLT3-ITDが予後中間群となったことである。 この変更により、 FLT3-ITD変異のあるAMLは予後中間群で統一された。
参考:ELNによるAML分類2022も重要
なお、 第3版 (2023年版) ではあるが、 「ELNによるAML分類 2022」 も昨今の重要な改訂点であったため併せて紹介したい (下図参照)。
ELNによるAML分類 (2022)

Blood. 2022;140(12):1345-1377.をもとに編集部作図
💬 本分類において、 特にTP53 mtationという予後不良の遺伝子異常が独立したことは大きい。 実臨床においてTP53変異のあるAML/MDSは非常に予後不良で、 寛解に入ったとしても短期間しか持たず移植にたどり着けない症例も多い。 同種移植できたとしても再発のリスクが非常に高い病型である。
上記の変更に加えて、 従来は芽球 (blast) が20%以上でないと白血病と言えなかったが、 ELN 2022から10〜19%でも特定の遺伝子異常や、 MDSの特質を持つ病型をMDS/AMLと分類することができるようになったことも大きな改訂*であった (*2023年版)。
❷若年者のFLT3-ITD陽性初発AMLに対し、「化学療法+キザルチニブ併用」 を推奨
2023年5月、 未治療のFLT3-ITD変異陽性AMLに対するFLT3阻害薬キザルチニブ (QUIZ; 商品名 ヴァンフリタ®) が化学療法との併用において、 本邦でも適応追加承認された。
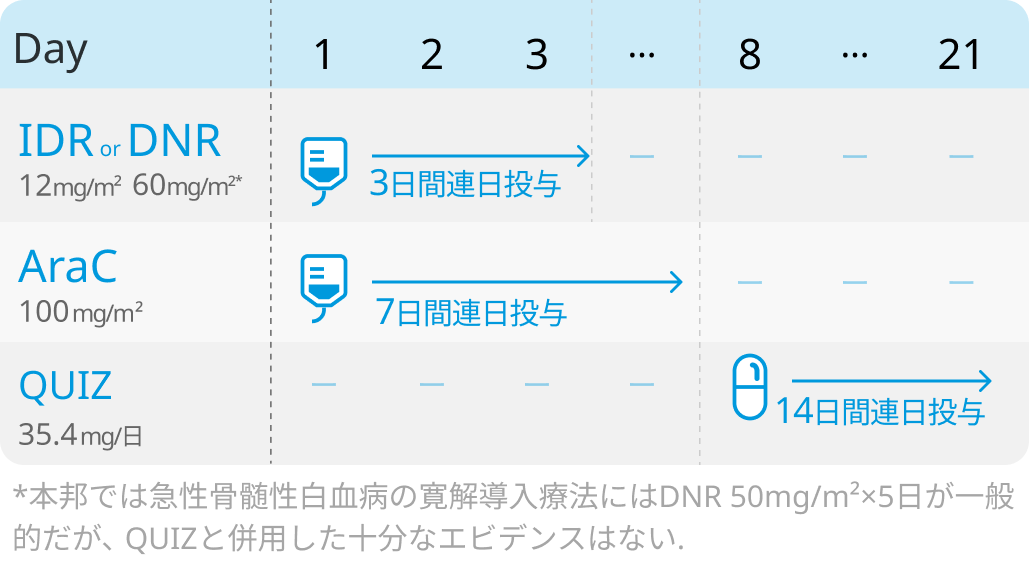
そこで、 2024年版では、「CQ3 若年者 (65歳未満) 初発AMLに対する寛解導入療法としてどのような治療が勧められるか」 のAnswerとして 「FLT3-ITD陽性症例に対して、標準的寛解導入療法とキザルチニブの併用が勧められる」 と追記された。
さらに、「CQ9 FLT3変異陽性AMLに対してどのような治療が勧められるか。 また、 リューコストラットCDx FLT3変異検査を行う場合にどのような注意点があるか」 のAnswerとして、 2023年版では 「FLT3-ITD陽性AMLに対して初発若年例では化学療法により完全寛解に導入し、 引き続いて適切な症例に対して造血幹細胞移植を施行することが勧められる」 であったのに対して、 2024年版ではアンダーライン部分が 「化学療法とキザルチニブを併用して」 に変更された。
この根拠としてCQ3および9の解説では、 未治療FLT3-ITD陽性AML(18-75歳)を対象とした国際共同第Ⅲ相試験 (QuANTUM-First) において、 主要評価項目である全生存期間(OS)中央値が、 標準的寛解導入療法とQUIZ併用群で31.9ヵ月と、 非併用群の15.1ヵ月に比べて有意に優れていた(p=0.0324) 旨が追記された。
HOKUTO関連コンテンツ
Lancet. 2023 May 13;401(10388):1571-1583.
また、 CQ9に関連して、 QUIZが治療の選択肢となったことに伴い、 リューコストラットCDx FLT3変異検査は初発時から実施する必要がある旨がアルゴリズムの本文中に追記された。
💬現在はリューコストラットCDxFLT3変異検査が 「1患者につき1回まで」 しか査定されない。 それによって初診時に検査すると再発時に検査ができなくなることが問題となる。 キザルチニブが寛解導入で併用可能となったことで、 実質は初診時に検査することになる (そうでないと予後に関わる) が、 再発時に新規のFLT3関連遺伝子変異があるかどうかわからなくなるため悩ましい問題である。 今後、 運用される遺伝子検査パネルへの項目組み込みやコンパニオン診断としての活用拡大など期待される。
❸強力化学療法が可能な治療関連・二次性AMLに対して 「CPX-351」 が推奨に
2024年3月、 ダウノルビシン・シタラビン配合リポソーム注射剤 (CPX-351; 商品名 ビキセオス®) が本邦でも承認され、 「CQ7 強力化学療法が可能な高齢者(65歳以上)AMLに対してどのような治療が勧められるか」 のAnswerとして 「治療関連・二次性AMLに対してCPX-351が勧められる」 が追記された。
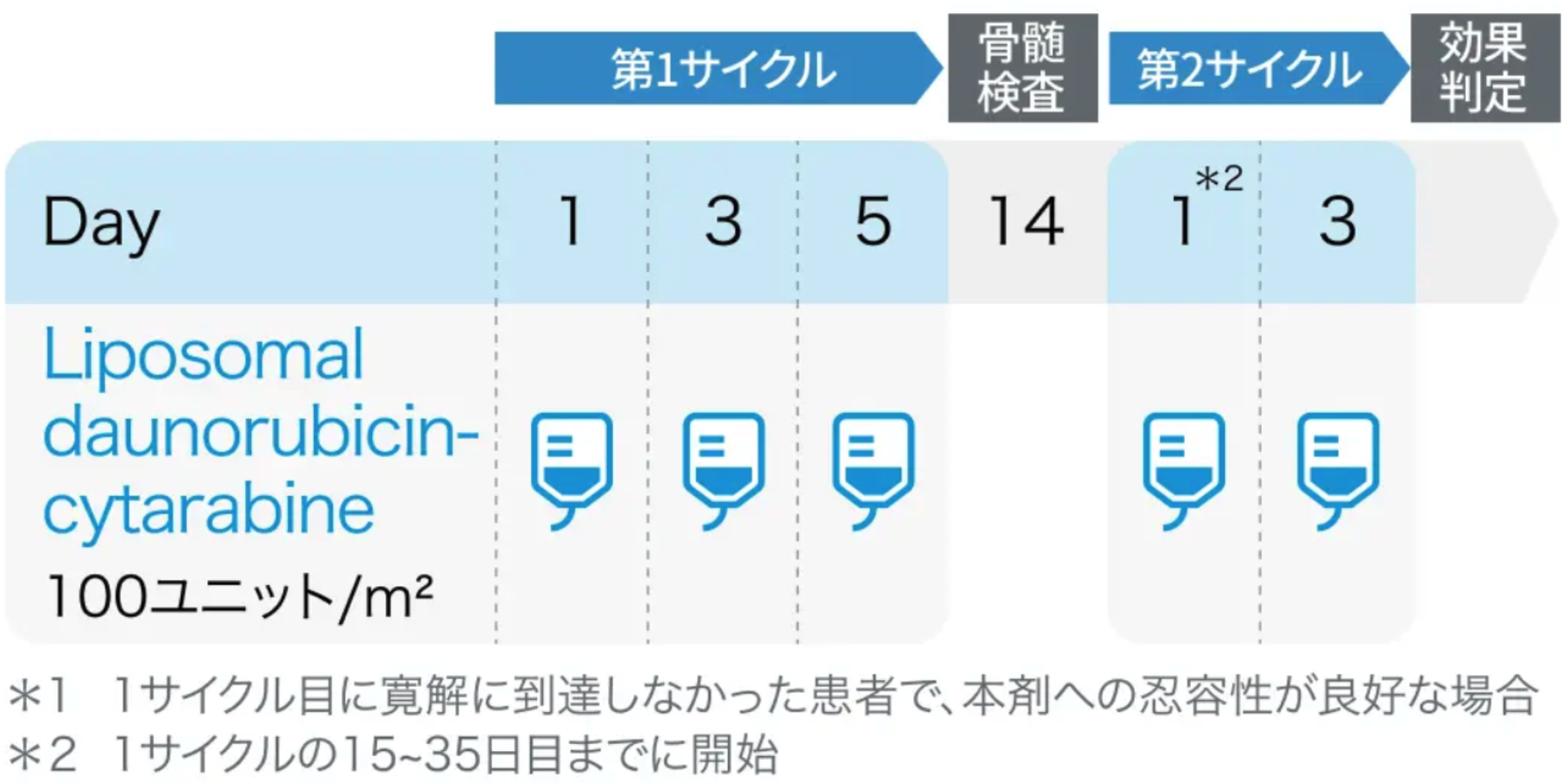
さらに、 「CQ13 治療関連・二次性AMLに対してどのような治療が勧められるか」 のAnswerとして2023年版では 「強力化学療法の適応のある症例に関しては、 化学療法で寛解を目指し、 引き続いて適切な症例に対して造血幹細胞移植を施行することが勧められる。」 であったのに対して、 2024年版ではアンダーライン部分が 「ダウノルビシン・シタラビン配合リポソーム注射剤(CPX-351)」 に変更された。
この根拠として、 CQ7および13の解説では、 60-75歳の未治療の高リスク(治療関連・二次性・予後不良群に属するMDS関連染色体異常を有する)AML症例を対象とした第Ⅲ相試験において、 主要評価項目であるOS中央値が、 初回治療としてシタラビンおよびダウノルビシンの併用療法(7+3療法)群で5.95ヵ月であるのに対してCPX-351群で9.56ヵ月と有意な延長を示した (p=0.003) 旨が追記された。
該当する臨床試験はこちら
J Clin Oncol. 2018 Sep 10;36(26):2684-2692.
また、 CQ13の解説では、 同種造血幹細胞移植を実施した症例において、 移植実施時点を起点としたOS中央値は、 7+3療法群で10.25ヵ月であるのに対してCPX-351群は未到達であり、 有意な延長が認められた [HR 0.51(95%CI 0.28-0.90)]旨が追記された。
該当する臨床試験はこちら
Blood Adv. 2022 Sep 13;6(17):4989-4993.
💬CPX-351は、 高齢者AMLに対する有力な治療選択肢であるが、「高リスクAML」 の定義がELN2022のAML予後分類とは異なる定義なので注意すること。 60~75歳で以下のリスクに当てはまる患者がCPX-351に関連する高リスクAMLである。

日本血液学会の公式サイトに遷移します。
関連コンテンツ
HOKUTO掲載レジメン
キザルチニブ併用寛解導入療法 (FLT3-ITD変異陽性例)
Liposomal daunorubicin-cytarabine
ダウノルビシン・シタラビン リポソーム製剤 (ビキセオス®)
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。