臨床試験データベース
2年前
【TRIBE2試験】大腸癌に対するmFOLFOXIRI+ベバシズマブ

前治療歴のない切除不能な転移性大腸癌 (mCRC) 患者において、 殺細胞性抗癌剤の3剤併用レジメン (FOLFOXIRI+ベバシズマブ→病勢進行後に同レジメンを繰り返す) の効果を、 2剤併用レジメンの逐次投与 (FOLFOX+ベバシズマブ→病勢進行後にFOLFIRI+ベバシズマブ) を対照に検証した第Ⅲ相ランダム化比較試験TRIBE2の結果より、 3剤併用レジメンの有効性が示された。
原著論文
▼解析結果
関連レジメン
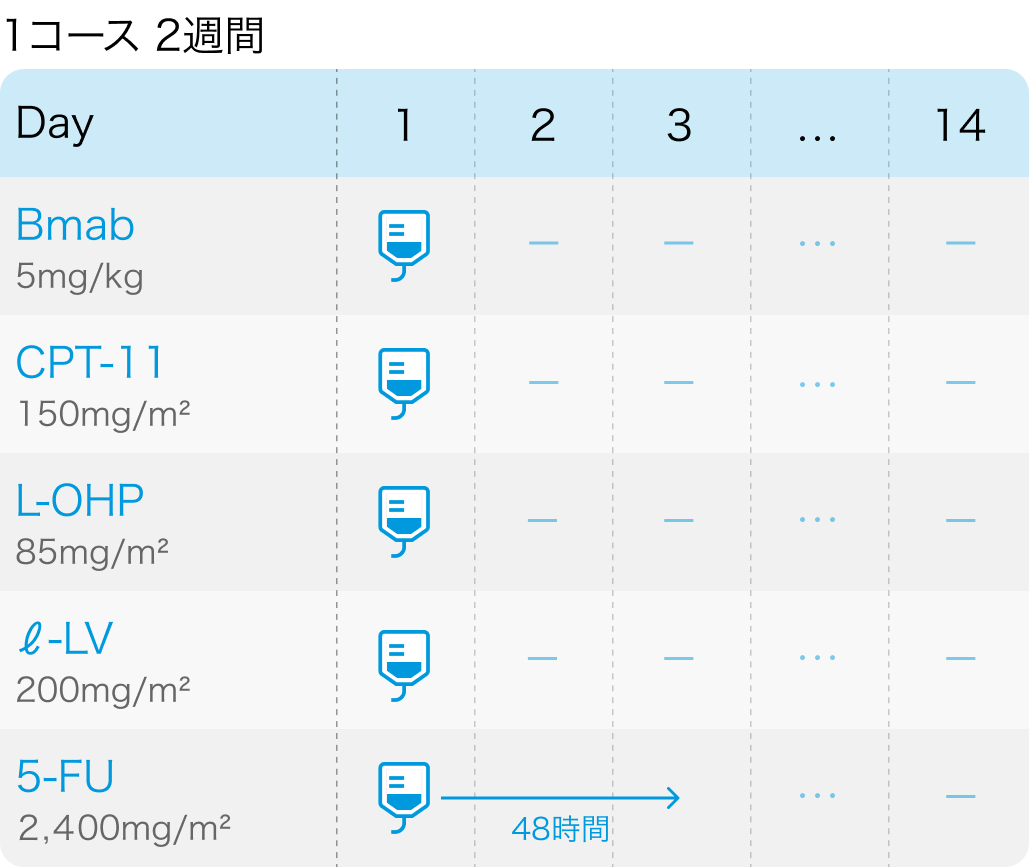
TRIBE2試験の概要
対象
- 前治療歴のない切除不能なmCRC患者
- ECOG PS 0~2の18~70歳、 およびPS 0の71~75歳
方法
679例を以下の2群に1:1で割り付けた。
- 実験群:3剤併用レジメン (339例)
1次治療:FOLFOXIRI (イリノテカン165mg/m²+オキサリプラチン85mg/m²+ロイコボリン200mg/m²+フルオロウラシル3,200mg/m²) +ベバシズマブ5mg/kgを2週毎に8サイクル実施
維持療法:フルオロウラシル+ロイコボリン+ベバシズマブを2週毎に投与
病勢進行後:FOLFOXIRI+ベバシズマブ5mg/kgを2週毎に8サイクル実施
- 対照群:2剤併用レジメンの逐次投与 (340例)
1次治療:mFOLFOX6 (オキサリプラチン85mg/m²+ロイコボリン200mg/m²+フルオロウラシル (400mg/m²をボーラス投与後、 2,400mg/m²を48時間かけて投与))+ベバシズマブ5mg/kgを2週毎に8サイクル実施
維持療法:フルオロウラシル+ロイコボリン+ベバシズマブを2週毎に投与
病勢進行後:FOLFORI (ロイコボリン200mg/m²+イリノテカン180mg/m²+フルオロウラシル (400mg/m²をボーラス投与後、 2,400mg/m²を48時間かけて投与))+ベバシズマブ5mg/kgを2週毎に8サイクル実施
評価項目
主要評価項目
無作為化から1回目のPD後に投与された治療による2回目のPDもしくは死亡までの期間 (PFS2)
副次評価項目
1次治療PFS (PFS1) 、 2次治療PFS、 ORR、 転移巣に対するR0切除、 全生存期間 (OS) 、 安全性
TRIBE2試験の結果
患者背景
- 両群で同様であった。
- 年齢中央値は60~61歳、 男性は53~61%、 ECOG PS0は85~86%、 右側原発は38%
追跡期間中央値
35.9ヵ月
PFS2中央値
- 実験群:19.2ヵ月
(95%CI 17.3-21.4ヵ月)
- 対照群:16.4ヵ月
(95%CI 15.1-17.5ヵ月)
HR 0.74 (95%CI 0.63-0.88)、 p=0.0005
PFS1中央値
- 実験群:12.0ヵ月
(95%CI 11.1-12.9ヵ月)
- 対照群:9.8ヵ月
(95%CI 9.0-10.5ヵ月)
HR 0.74 (95%CI 0.63-0.88)、 p=0.0002
2次治療PFS中央値
- 実験群:6.2ヵ月
(95%CI 5.6-6.6ヵ月)
- 対照群:5.6ヵ月
(95%CI 4.9-6.4ヵ月)
HR 0.87 (95%CI 0.73-1.04)、 p=0.11
ORR
- 実験群:62%
- 対照群:50%
オッズ比 1.61 (95%CI 1.19-2.18)、 p=0.0023
転移巣に対するR0切除
- 実験群:17%
- 対照群:12%
オッズ比 1.55 (95%CI 1.00-2.39)、 p=0.047
OS中央値
- 実験群:27.4ヵ月
(95%CI 23.7-30.0ヵ月)
- 対照群:22.5ヵ月
(95%CI 20.7-24.8ヵ月)
HR 0.82 (95%CI 0.68-0.98)、 p=0.032
有害事象 (AE)
- 1次治療中にAEのため減量を要したのは、 実験群58%、 対照群47%であった。
- 1次治療中に薬物関連のAEにより治療を中止したのは、 各群とも3%であった。
1次治療中の治療関連AE (Grade3、 4) 発現率
- 実験群:68%
- 対照群:46%
著者らの結論
前治療歴のないmCRCにおいて、 FOLFOXIRI+ベバシズマブの併用療法を先行投与し、 病勢進行後に同レジメンを再導入する治療戦略は、 2剤併用療法の逐次投与よりも望ましいと考えられる。
【TRIBE2試験】大腸癌に対するmFOLFOXIRI+ベバシズマブの全コンテンツは、医師会員限定でアプリからご利用いただけます*。
*一部のコンテンツは非医師会員もご利用いただけます
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
QRコードから
アプリを
ダウンロード!