化学療法レジメン
4年前
【New!】セムブリックス® (アシミニブ)|CMLに対する新レジメンを追加しました
ノバルティス ファーマ社 プレスリリースより画像引用
2022年5月25日に薬価収載され即日発売開始となった 新作用機序 STAMP阻害剤である 「セムブリックス (一般名アシミニブ)」 のレジメンを追加しました! リンクからお気に入り登録することでいつでもご利用いただけます.
薬剤情報
投与スケジュール
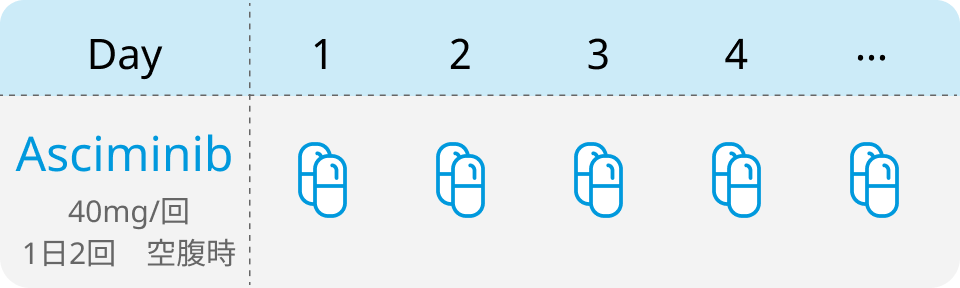
詳細情報は 💊 Asciminibを参照ください.
主な有害事象
ASCEMBL試験¹⁾より引用.
骨髄抑制
- 血小板数減少症 (≧Grade3 19.2%)
- 好中球数減少症 (≧Grade3 15.4%)
- 貧血 (≧Grade3 0.6%)
主な有害事象
- 発現頻度10%を超える有害事象 (骨髄抑制以外) なし
その他重要な有害事象
- 発熱性好中球減少症 (0.6%、 ≧Grade3 0.6%)
- 膵酵素増加 (5.1%、 ≧Grade3 2.6%)
- QT延長 (1.3%、 ≧Grade3 0.6%)
- 血管閉塞性事象 (1.3%、 ≧Grade3 0.6%)
- 高血圧 (3.8%、 ≧Grade3 1.9%)
- 頭痛 (9.0%、 ≧Grade3 0.6%)
- 悪心 (6.4%、 ≧Grade3 0.0%)
- 光線過敏症 (頻度不明)
特徴と注意点
適応
- 前治療薬に抵抗性又は不耐容のCML.
特徴
- ABLミリストイルポケットを特異的に標的とするSTAMP (Specifically Targeting the ABL Myristoyl Pocket) 阻害薬.
- 2剤以上のTKIに抵抗性又は不耐容の慢性期CML患者に使用する.
- BCR-ABL1遺伝子にT315I変異を持つ患者への1回40mg 1日2回投与は、 有効性および安全性が確立していない.
- 骨髄抑制のモニタリングのため、 投与開始後最初の3ヵ月は2週間毎、 その後は1ヵ月毎に血液検査を実施する.
- 膵炎のモニタリングのため、 1ヵ月毎、 また患者の状態に応じて血清リパーゼ及び血清アミラーゼを測定する.
- QT間隔延長に対しては、 必要に応じて心電図検査及び電解質検査を行い、 電解質の補正を行う.
- 光線過敏症が現れることがあるため、 晴天時の外出は日焼け止めを用いるよう指導する.
好中球減少症または血小板減少症発現時の投与量調節基準


無症候性の血清リパーゼまたは血清アミラーゼ増加発現時の投与量調節基準
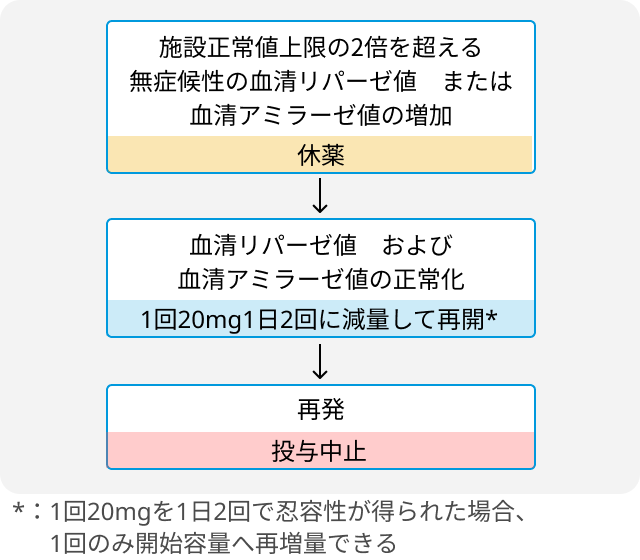
その他有害事象と投与量調節基準

関連する臨床試験の結果
MMR: Major Molecular Response (分子遺伝学的大奏効) 、 CCyR: Complete Cytogenic Response (細胞遺伝学的完全寛解) 、 MCyR: Major Cytogenic Response (細胞遺伝学的大奏功) 、 OS: Overall Survival (全生存) 、 PFS: Progression Free Survival (無増悪生存) .
ASCEMBL試験¹⁾
概要
- 対象:2剤以上のTKIによる前治療があり、 直近のTKIによる治療に抵抗性又は不耐容な慢性期CML患者.
- 多施設共同、 ランダム化、 非盲検、実薬 (Bosutinib) 対象国際共同第III相試験.
- Asciminib 40mg 1日2回 vs Bosutinib 500mg 1日1回に、 2:1割り付け.
結果
- 観察期間中央値:14.9ヵ月
- MMR達成率 (24週時点):Asciminib群 25.5% vs Bosutinib群 13.2%.
※MMR達成率の差:12.2% (95%CI 2.19-22.30、 p=0.029).
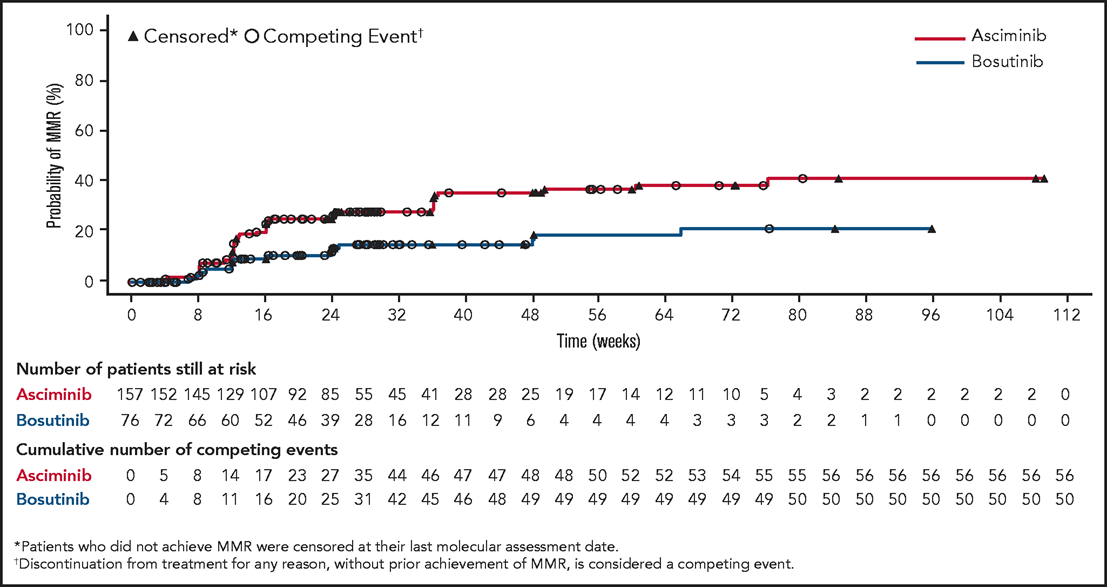
Blood. 2021 Nov 25;138(21):2031-2041.より画像引用
- CCyR達成率 (24週時点):Asciminib群 40.8% vs Bosutinib群 24.2%.
※CCyR達成率の差:17.3% (95%CI 3.62-30.99).
- MCyR達成率 (24週時点) : Asciminib群 40.4% vs Bosutinib群 28.0%.
※MCyR達成率の差:12.4% (95%CI -9.4-34.1).
- 治療ライン別MMR到達率 (24週時点)
- 3rd line:Asciminib群 29.3% vs Bosutinib群 20.0%.
- 4th line:Asciminib群 25.0% vs Bosutinib群 13.8%.
- ≧5th line:Asciminib群 16.1% vs Bosutinib群 0.0%.
参考文献
最終更新:2022年5月27日
執筆担当:北里大学病院薬剤部 宮島律子
監修医師:伊勢原協同病院血液内科 扇屋大輔
こちらの記事の監修医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
QRコードから
アプリを
ダウンロード!