HOKUTO編集部
11ヶ月前
【特集】初のEGFR-MET二重特異性抗体アミバンタマブが承認

2024年9月24日、 EGFR-MET二重特異性抗体アミバンタマブが、 化学療法 (カルボプラチンおよびペメトレキセド) との併用で、 EGFR exon20挿入変異陽性の切除不能な進行・再発NSCLCを適応として承認されました。 本稿ではアミバンタマブの概要や、 関連する論文・コンテンツをまとめてお届けいたします。
アミバンタマブとは
商品名 : ライブリバント®点滴静注350mg
EGFR-MET二重特異性抗体
*ヤンセンファーマ株式会社の外部サイトへ遷移します
効能または効果
EGFR exon20挿入変異陽性の切除不能な進行・再発の非小細胞肺癌
用法および用量
カルボプラチンおよびペメトレキセドとの併用において、 3週1サイクルとし、 以下の用法および用量で点滴静注する。 なお、 患者の状態により適宜減量する。
1、2コース目
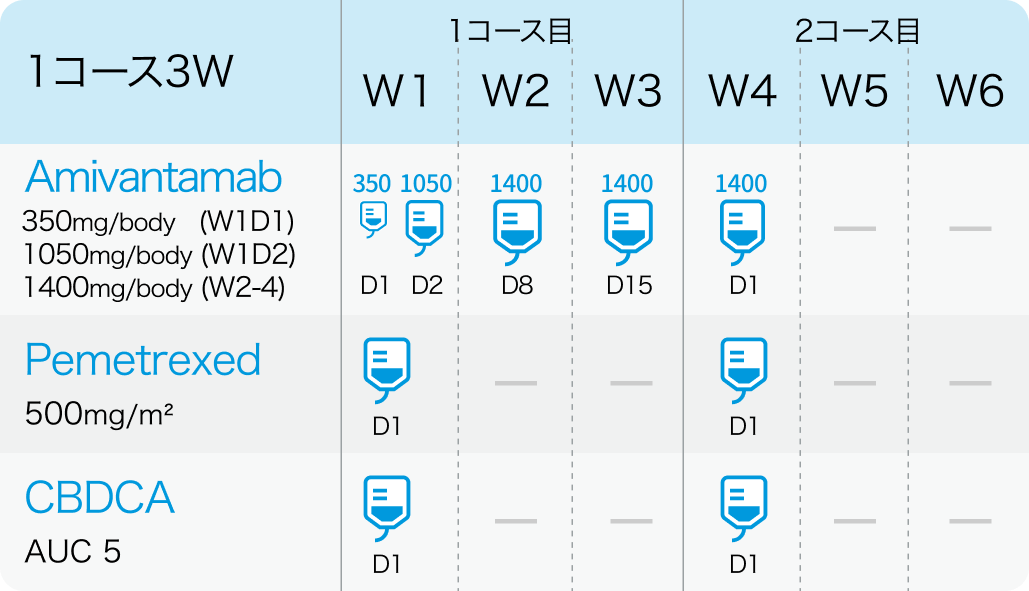
3、4コース目
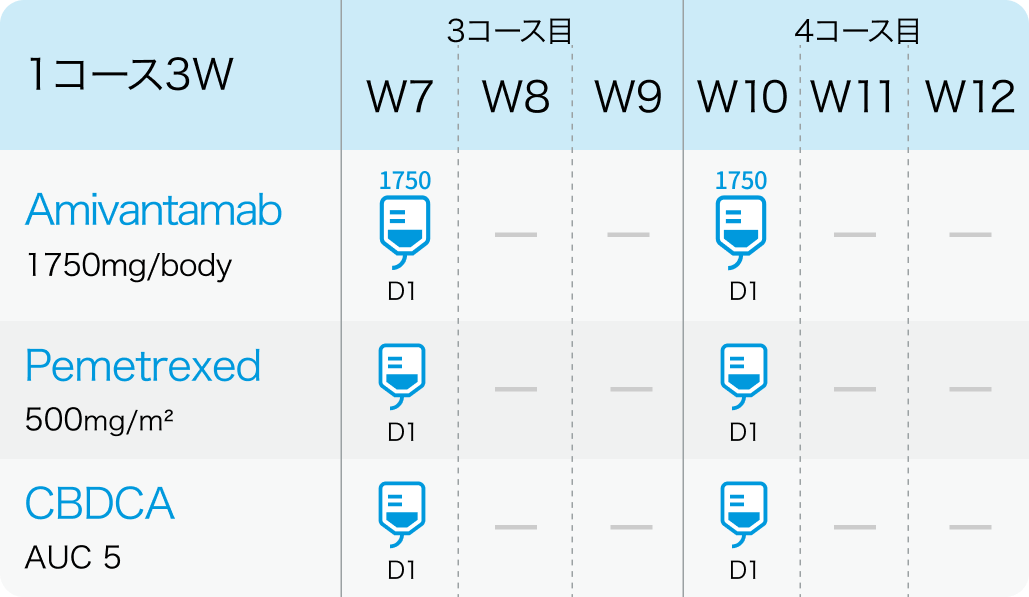
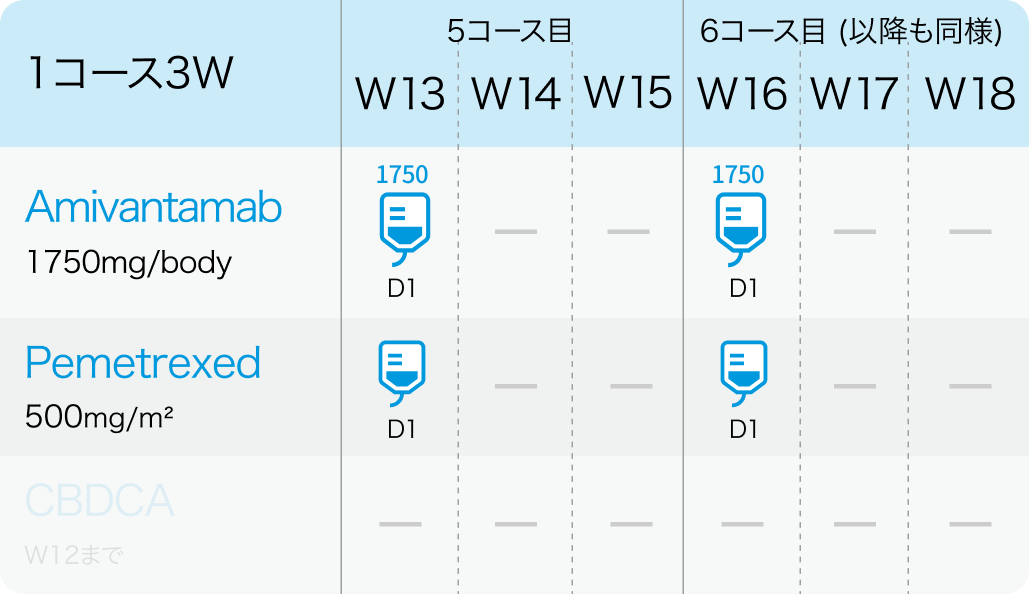
5コース目以降
初のEGFR-MET二重特異性抗体、 ラゼルチニブとの併用等も申請中
アミバンタマブは、 これまで化学療法以外に治療選択肢がなかったEGFR exon20挿入変異陽性の切除不能な進行・再発NSCLCに対する本邦初のEGFR-MET二重特異性抗体であり、 新たな治療選択肢として期待されている。今回の承認は、 第III相非盲検無作為化比較試験PAPILLONの結果に基づく。
国内では、 ①EGFR遺伝子変異陽性の手術不能/再発NSCLCに対する第3世代EGFR-TKI・ラゼルチニブ (国内未承認) との併用療法、 ②第3世代EGFR-TKIによる前治療無効の手術不能/再発性のEGFR遺伝子変異陽性NSCLC (化学療法と併用) ――でも承認申請中となっている。
PAPILLON試験
NEJM掲載論文
N Engl J Med. 2023 Oct 21.
全身療法歴がなく、 上皮成長因子受容体 (EGFR) exon20挿入変異陽性の進行非小細胞肺癌 (NSCLC) を対象に、 二重特異性抗体アミバンタマブの有効性と安全性を第Ⅲ相国際共同無作為化比較試験PAPILLONで検討した結果、 アミバンタマブ+化学療法群は化学療法単独群に比し、 無増悪生存期間 (PFS) を有意に改善した。
PFSの結果
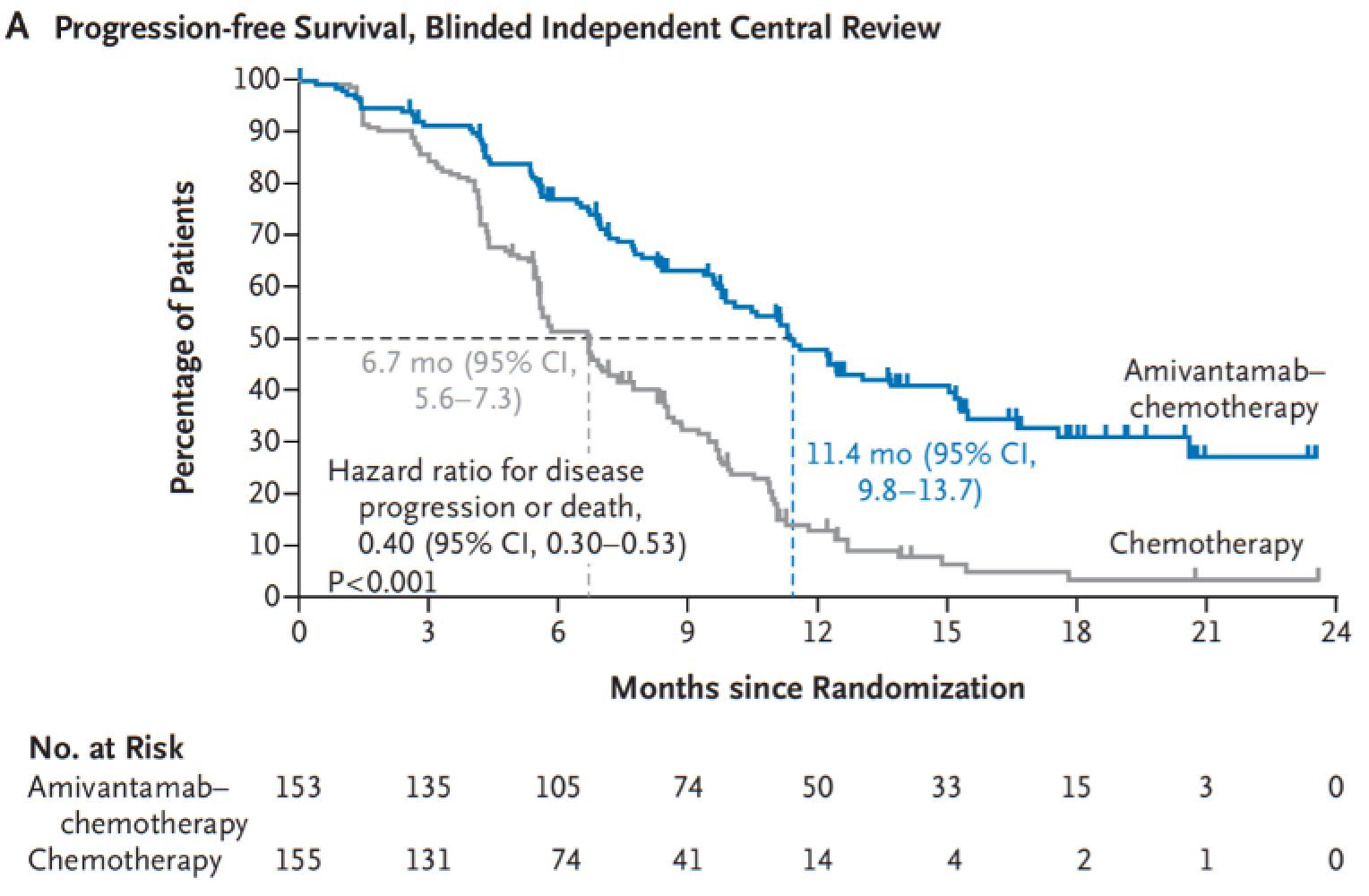
(吉田達哉氏提供[出典 : NEJM, 2023. 389(22): p. 2039-2051] )
コンパニオン診断も8・9月に承認済
【肺癌】9月27日更新
アミバンタマブのコンパニオン診断として、 「Guardant360® CDx がん遺伝子パネル」 が8月22日付けで、 「オンコマイン Dx Target Test マルチ CDxシステム」 が9月9日付けで国内承認されている。
アミバンタマブに関するその他の臨床試験
第Ⅲ相試験MARIPOSA
EGFR exon19欠失変異またはexon21置換変異を有する局所進行性または転移性NSCLCの一次治療において、 アミバンタマブ+ラゼルチニブ併用療法を、 オシメルチニブおよびラゼルチニブそれぞれの単剤療法と比較評価する第III相非盲検無作為化比較試験。
N Engl J Med. 2024 Jun 26.
IASLC/WCLC 2024
Ann Oncol. 2024 Sep;35(9):805-816.
第Ⅲ相試験PALOMA-3
EGFR遺伝子変異を有する進行性または転移性NSCLCを対象として、 ラゼルチニブ+アミバンタマブ皮下投与の併用療法を、 アミバンタマブ静脈内投与と比較評価する第III相非盲検無作為化比較試験。
EGFR変異進行NSCLCへのアミバンタマブ、 皮下注 vs 静注
J Clin Oncol. 2024 Jun 10:JCO2401001.
専門医・薬剤師による解説
解説 : 国がん中央病院 呼吸器内科医長 吉田達哉先生
解説 : がん専門薬剤師 やくごろう
関連するコンテンツ
専門医監修 化学療法レジメン
アミバンタマブ+ペメトレキセド+カルボプラチン
1、2コース目

3、4コース目

5コース目以降

出典
¹⁾ ヤンセンファーマ株式会社. ライブリバント®電子添文 (2024年9月作成)
[最終閲覧 : 2024/10/4]
²⁾ ヤンセンファーマ株式会社. ライブリバント®適正使用ガイド (2024年9月作成)
[最終閲覧 : 2024/10/4]
【特集】初のEGFR-MET二重特異性抗体アミバンタマブが承認の全コンテンツは、医師会員限定でアプリからご利用いただけます*。
*一部のコンテンツは非医師会員もご利用いただけます
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
QRコードから
アプリを
ダウンロード!