新薬承認情報
1年前
スキリージ 「潰瘍性大腸炎」 等への適応追加-6月の変更承認情報まとめ-
25剤を承認 (うち新規有効成分11剤)
医薬品医療機器総合機構 (PMDA) は、 2024年6月に25種類の医薬品が厚生労働省から承認を受けたと発表した。
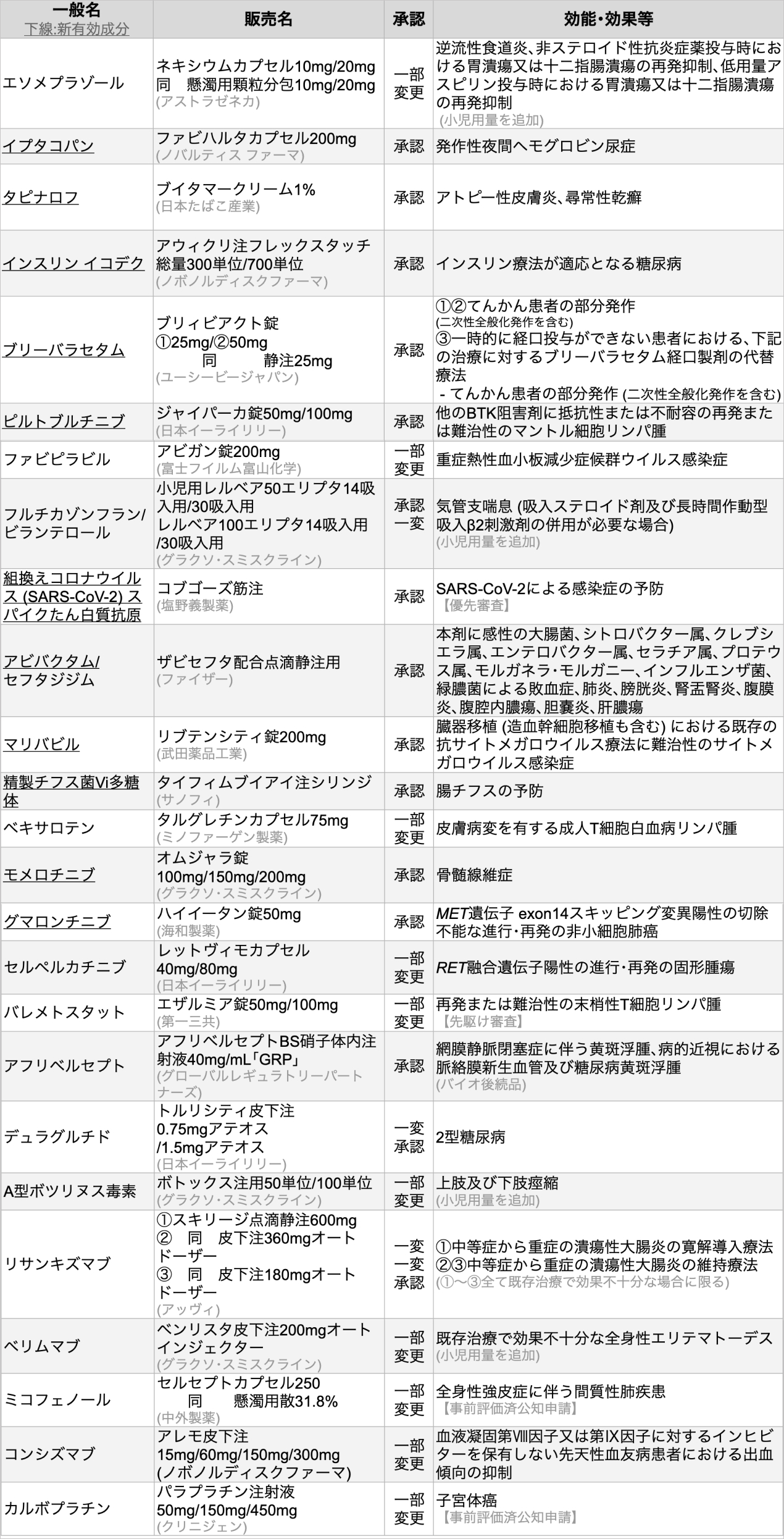
リサンキズマブ
抗IL-23p19抗体リサンキズマブ (商品名スキリージ) は、 中等症から重症の潰瘍性大腸炎の寛解導入療法/維持療法 (いずれも既存治療で効果不十分な場合に限る) を効能・効果として承認された。 今回の承認は、 中等症~重症の潰瘍性大腸炎を対象として日本も参加した第Ⅲ相多施設共同二重盲検プラセボ対照無作為化比較試験COMMAND、 および第Ⅲ相多施設共同二重盲検プラセボ対照無作為化比較試験INSPIREの結果に基づく。
なお国内では、 同薬は既に既存治療で効果不十分な尋常性乾癬、 乾癬性関節炎、 膿疱性乾癬、 乾癬性紅皮症、 中等度から重症の活動性クローン病、 掌蹠膿疱症の6疾患を適応症として承認されている。
エソメプラゾール
プロトンポンプ阻害薬 (PPI) エソメプラゾール (商品名ネキシウム) は、 再発・再燃を繰り返す逆流性食道炎、 非ステロイド性抗炎症薬 (NSAIDs) 投与時における胃潰瘍または十二指腸潰瘍の再発抑制、 低用量アスピリン (LDA) 投与時における胃潰瘍または十二指腸潰瘍の再発抑制として、 小児に対する用法・用量が追加承認された。
今回の承認は、 1~14歳の日本人小児で、 逆流性食道炎の初期治療で改善が認められた、 あるいはNSAIDsまたはLDAの長期投与を要する胃潰瘍または十二指腸潰瘍の既往歴がある患者を対象に行われた第Ⅲ相多施設共同オープンラベル並行群間試験の結果に基づく。
セルペルカチニブ
RET受容体型チロシンキナーゼ阻害薬セルペルカチニブ (商品名レットヴィモ) は、 RET融合遺伝子陽性の進行・再発の固形腫瘍」 を効能・効果として追加承認された。
現在、 同薬は既にRET融合遺伝子陽性の切除不能な進行・再発非小細胞肺癌、 根治切除不能な甲状腺癌/甲状腺髄様癌に適応されており、 今回の承認でRET融合遺伝子陽性の固形腫瘍に対し、 臓器横断的な承認が追加された。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。