HOKUTO編集部
8ヶ月前
【疑問】80歳超の初発DLBCL、 治療は何を選ぶ?

臨床的疑問の解決方法の概念を7つのStepに分けて解説する本連載、 第3回では高齢の悪性リンパ腫の患者を例に解説します。
本記事は2024年11月11日に配信したものを再配信しています。

📝 今回担当する患者さんはこちら
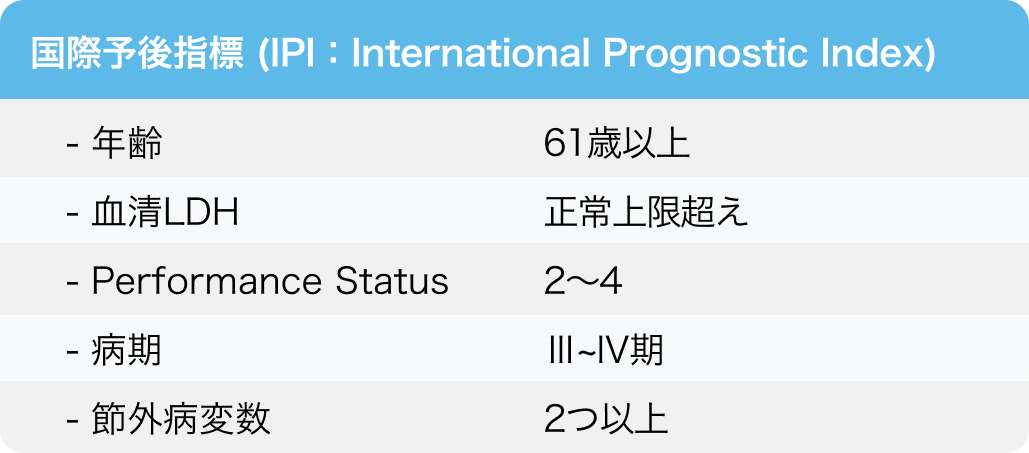
・81歳女性
・初発びまん性大細胞型B細胞リンパ腫 (DLBCL)
・ステージ3 (多発リンパ節)
・血清LDH : 正常上限超え
・IPI 3 (年齢、 ステージ、 LDH)
Step 1 : 疑問を抱く
80歳超の高齢DLBCLではR-CHOPの減量が必要?
あなたは初発のDLBCLの患者さんを担当しました。 これまで、 初発のDLBCLの患者さんに対する標準治療はR-CHOP療法であったため、 この患者さんに対してもR-CHOP療法を行うことにしました。
ところが、 治療開始前に行われたカンファレンスで、 上級医から 「この患者さんに対する標準治療は本当にR-CHOP療法でよいですか?減量は考慮しましたか?」 と質問されました。
初発DLBCLは化学療法で根治が狙える疾患であり、 むやみな減量は根治性を下げる可能性があるため、 減量はむしろ悪ではないか?と考えたのですが、 上級医の質問の意図はなんだったのでしょうか?
R-CHOP療法 : リツキシマブ+シクロフォスファミド+ドキソルビシン+ビンクリスチン+プレドニゾロン
Step 2 : PICOの活用
減量R-CHOP療法の治療効果は?
この症例は、 以下のように要約できるでしょう。

それでは、 まずはガイドラインに記載があるかの確認から始めましょう。
Step 3 : ガイドラインの確認
「造血器腫瘍診療ガイドライン」 は?
「造血器腫瘍診療ガイドライン2023年版」 を確認すると、 PICOで提起した臨床的疑問に対する回答は 「80歳以上の超高齢者に対しては、 用量あるいはコース数を減らしたR-CHOP療法は妥当な治療選択肢の1つである。 」 とわかります¹⁾。

文献1より引用
これにより、 上級医が言っていた 「R-CHOP療法の減量は考慮したのか?」 の質問の意図が分かりました。
ただ、 ガイドラインはあくまで 「妥当な治療選択肢の一つである」 という記載に留まっており、 「R-CHOP療法の減量が必須」 とは言っていません。 また、 減量したR-CHOP療法が唯一無二の標準治療とまでは言い切っていませんし、 どれくらい減量すればよいかの記載はありません。
ガイドラインはあくまで一般論の記載に留まることが多いため、 情報が不足している場合もあります。 こうしたときは、 引用されている文献を確認しましょう。
Step 4 : 引用文献の確認
R-miniCHOP療法の前向き臨床試験は?
「造血器腫瘍診療ガイドライン2023年版」では、 Groupe d’Etude des Lymphomes de l’Adulte (GELA) で行われたR-miniCHOP療法が唯一の前向き臨床試験として引用されていました²⁾。
この研究では、 未治療、 80歳以上のDLBCL患者を対象にR-miniCHOP療法を行うと、 2年のPFSは47 (38-56)%、 2年のOSは59 (49-67)%、 治療関連死は8.1%と報告されています。
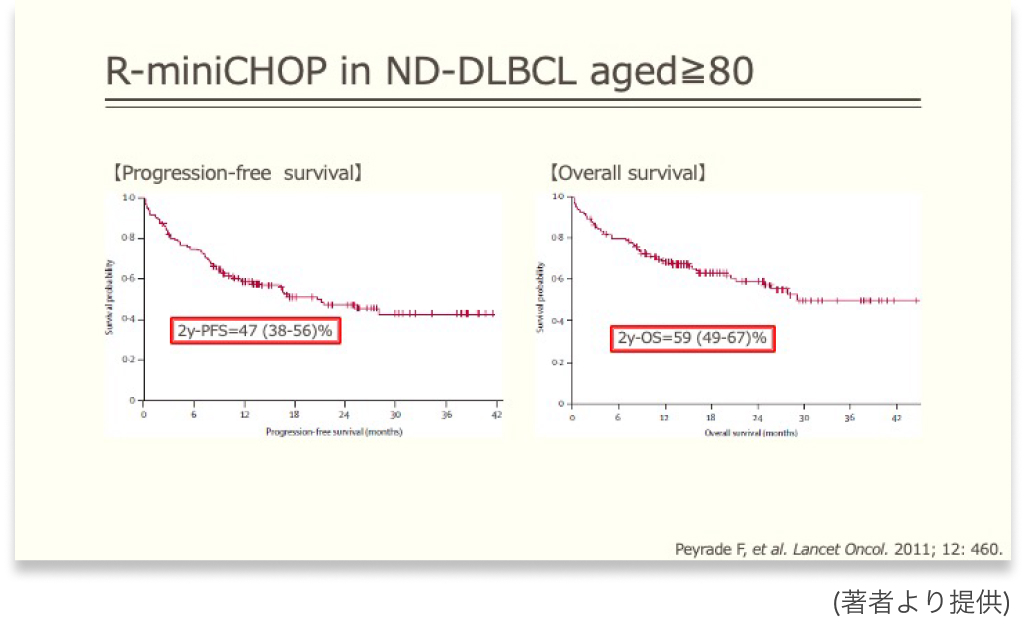
初発のDLBCLは化学療法で根治が狙える疾患のため、 減量どころか50%への減量も許容されないのでは?と思いがちですが、 「治療関連死が8.1%」という数字を見ると、 安全な化学療法の実施、 それに引き続いて根治が目指せることを考えると、 「50%」という減量率は思いのほか妥当な数字にみえてきます。
R-CHOP vs R-miniCHOPの比較は?
残念ながら、 前向きの比較試験はこれまで行われていないですが、 比較的規模の大きい後ろ向きの報告は散見されます。
一例として英国からのレジストリ解析の報告を紹介します。 全体で9,186例、 うち80歳以上の高齢者は2,983例が登録されており、 標準量のR-CHOP療法とR-miniCHOP療法の比較が行われています³⁾。
両群の患者背景には大きな差はない中で、 3年の全生存率は両群ともに54%、 OSのKaplan-Meier曲線もほぼ重なっているようにみえます。
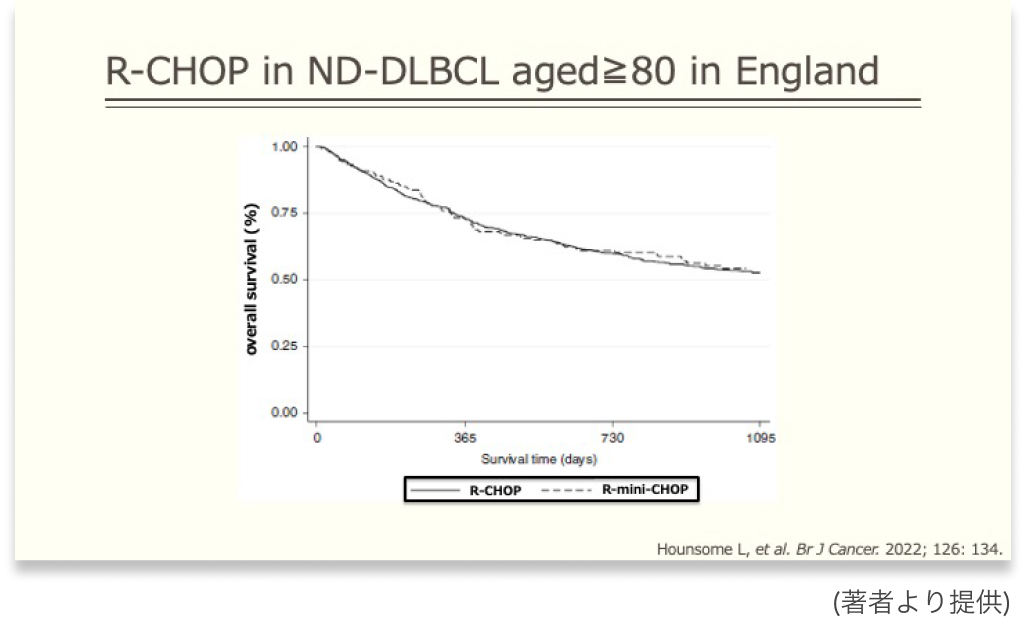
あくまで後ろ向き試験の結果であり、 エビデンスレベルは高くありませんが、 他にエビデンスレベルの高い報告も存在しないため、 現時点では治療方針の決定には参考になるデータの1つとなるでしょう。
ただ、 「造血器腫瘍診療ガイドライン2023年版」の推奨も、 「80歳以上のDLBCLでは全例がR-miniCHOP療法が標準治療」 と言っているわけではありません。
例えばシニアオリンピックに出場するような81歳の高齢者と、 数多くの併存症を抱え、 DLBCLに罹患する前からPS 2の79歳の高齢者がいたとして、 前者にR-miniCHOP療法、 後者にfull doseのR-CHOP療法を推奨できるでしょうか?
実際、 前者のような高齢者がDLBCLに罹患されたならば、 初回からR-miniCHOP療法、 すなわち50%の減量は治療強度を下げ過ぎている印象を持ちますし、 後者のような高齢者ではむしろ治療強度を下げないと治療に耐えられない印象を持ちます。
70~80歳 vs 81歳以上の比較は?
英国の大規模病院で2009~2014年に治療を受けた、 70歳以上の初発のDLBCL患者計177例を対象として、 後ろ向きにR-CHOP療法の治療成績を検討した報告⁴⁾を紹介します。
81歳以上でRDI*≧80%の群とRDI<80%の群を比較すると3年PFSは29% vs 66% (p=0.02) であり、 RDI≧80%を維持することでかえってPFSを悪化させていました。
*relative dose intensity
一方、 70~80歳ではRDI≧80%とRDI<80%の群を比較すると3年PFSが74% vs 13% (p=0.003) であり、 RDI≧80%を維持することがPFSの改善に寄与していました。
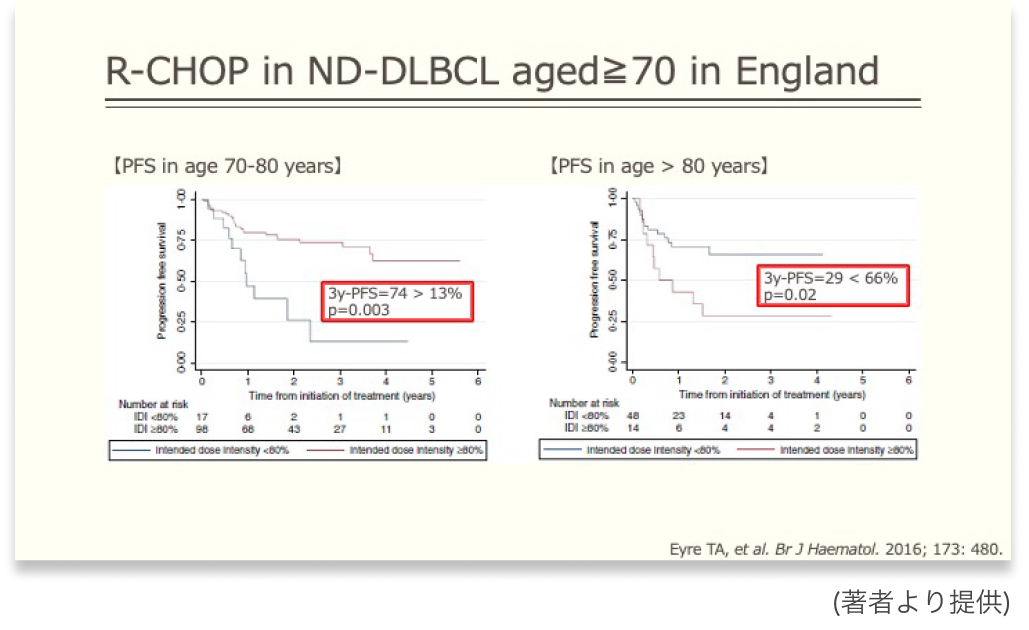
こちらも後ろ向きの解析ではあるものの、 多変量解析でもPFSに有意に影響する因子として報告されており、 ある程度のインパクトを持つ結果です。
健康な81歳DLBCL患者の治療強度は?
さて、 先ほどの 「シニアオリンピックに出場するような81歳の高齢者」 がDLBCLに罹患した場合、 初回治療の治療強度をどのように設定すればよいでしょうか?
暦年齢だけで考えれば、 これまでの複数の後ろ向き報告をみても減量すべきと思われますが、 忍容性が良好ならば治療強度をできる限り維持した方が、 治療成績が良好なことは言うまでもありません。 おそらくこの81歳の方は、 先ほどの79歳の高齢者よりも治療に対する忍容性が良好であろうことは想像に難くないでしょう。 これまでのエビデンスを総合すると、 50~80%程度のR-CHOP療法が妥当な治療選択肢でしょう。
このように、 暦年齢は 「単なる連続変数」 でしかなく、 症例ごとに適切な治療強度を設定することが、 難しいですが重要です。
Step 5 : 情報のアップデート
減量pola-R-CHP療法は治療選択肢?
ところで「造血器腫瘍診療ガイドライン2023年版」の「高齢者DLBCLに対する標準治療は何か」 というCQの推奨には、「18~80歳でIPI 2以上の患者に対しては、pola-R-CHP療法も標準治療の1つとして勧められる」とも記載されています。

文献1より引用
この患者さんはIPI 3ですから、 80歳までであればpola-R-CHP療法も標準治療の1つとなりますが、81歳では、 用量あるいはコース数を減らしたpola-R-CHP療法は妥当な治療選択肢の1つとならないのでしょうか?
pola-R-CHP療法 : ポラツズマブベドチン+リツキシマブ+シクロフォスファミド+ドキソルビシン+プレドニゾロン
新たに出てきた臨床的疑問をPICOで整理すると、 以下のようになります。

第III相試験 「POLAR BEAR試験」 は?
本稿執筆時はまだ結果が報告されていませんが、 このデザインの臨床試験 「POLAR BEAR試験」 がすでに進行中で、 安全性パートのみ報告されています。
欧州の計37施設で行われたランダム化試験で、 81歳以上、 ないし75~80歳かつ簡略化高齢者総合機能評価 (sCGA) でfrailに該当した未治療DLBCL計300例を対象として、 pola-R-miniCHP療法とR-miniCHOP療法を比較したものです。
計127例の安全性データのみが2023年の欧州血液学会で発表されており⁵⁾、 R-miniCHOP療法と比較してpola-R-miniCHP療法において消化器毒性の発現頻度は高くなるものの、 grade 3~4の血液毒性や感染症、 末梢神経障害の発現頻度は変わらなかったと報告されています。
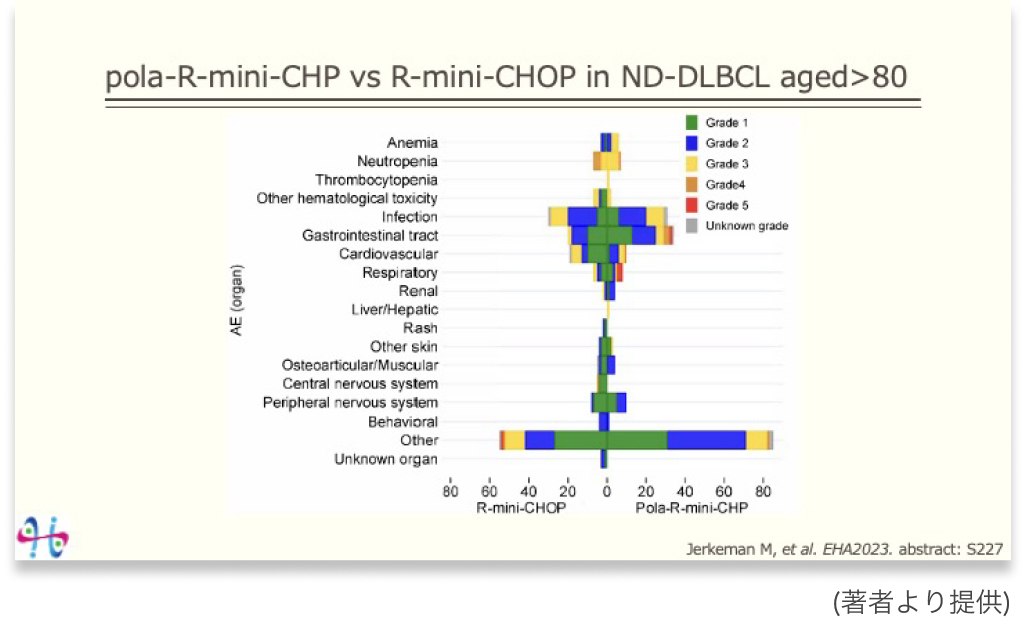
PICOに対する解答は、 まだ試験結果の報告を待つほかないのですが、 この安全性の結果とPOLARIX試験の結果から、 有効性の結果を類推することはできないでしょうか?
Step 6 : 適格性と安全性の確認
一般論として、 標準治療が確立している状況下において新規治療が治療選択肢となる場合には、 有効性と安全性の双方から新規治療の妥当性を検討する必要があります。 順に考えてみましょう。
高齢DLBCLに対するpola-R-miniCHP療法の有効性をどう考える?
POLAR BEAR試験では有効性についてはまだ報告されていないため、 18~80歳を対象としたPOLARIX試験を確認します。
詳しくは第2回を確認していただきたいのですが、 簡潔には標準治療であるR-CHOP療法と比較して、 pola-R-CHP療法が有意にPFSを延長しました。
初発のDLBCLに対する予後予測スコアであるIPIにおいて、 最も予後に与える影響が強い因子は 「年齢>60歳」 ですが、 POLARIX試験におけるPFSのサブ解析をみてみると、 60歳以上群の2年PFSは74.1% vs 71.9%、 HR 0.9 (0.6-1.5)、 60歳未満群で2年PFSは77.9% vs 69.5%、 HR 0.7 (0.5-0.9)と報告されており、 少なくとも加齢に伴ってpola-R-CHP療法の効果が落ちるということはなさそうですし、 むしろ高齢者のほうがpola-R-CHP療法の恩恵を受けられるような傾向がみられます。
なお、 pola-R-miniCHP療法はポラツズマブベドチンを減量しないレジメンであり、 80歳以上の患者でもポラツズマブベドチンの減量により治療効果の増強が相殺される心配はありません。
高齢DLBCLに対するpola-R-miniCHP療法の安全性をどう考える?
こちらはPOLAR BEAR試験が参考になります。 POLARIX試験でも同じような結果が報告されていますが、 「pola-R-miniCHP療法はR-miniCHOP療法と比較して副作用はマネジメント可能であった」 と報告されています⁵⁾。
以上より、 80歳を越える高齢DLBCLでは、 R-miniCHOP療法と比較してpola-R-miniCHP療法は有効性が期待できそうな結果が類推され、 かつ安全性が問題なさそうな結果が報告されていますので、 新たな治療選択肢として挙げることに論理的な矛盾はないでしょう。
"81歳以上"の患者にはpola-R-miniCHP療法は施行可能?
「造血器腫瘍診療ガイドライン2023年版」の推奨をあらためて確認すると、 「"18~80歳"でIPI 2以上の患者に対しては、 pola-R-CHP療法も標準治療の1つとして勧められる」 と記載されていますが、 "81歳以上"の高齢者に対するpola-R-CHP療法の記載がありません。
この理由は、 POLARIX試験の適格基準が18~80歳を対象としており、 80歳を超える高齢者の安全性が担保されないためと推察されます。 しかし、 だからといって「80歳を超える高齢者ではpola-R-miniCHP療法を行ってはいけない」と言ってよいのでしょうか?
なぜ「80歳超のDLBCLにpola-R-CHPは許容されない」という意見がある?
「造血器腫瘍診療ガイドライン2023年版」にも、 「80歳以上の超高齢者に対しては、 用量あるいはコース数を減らしたR-CHOP療法は妥当な治療選択肢の1つである。」 という記載がありますが、 日本を含めて80歳を越える高齢DLBCLに対しては、 full doseのR-CHOP療法はむしろ推奨されないというのが世界的コンセンサスになりつつあります。
すなわち、 POLARIX試験の標準治療を"full dose"のR-CHOP療法に設定した時点で、 80歳以上の超高齢者では"full dose"のR-CHOP療法は標準治療ではないため、 臨床試験からは除外することが当然となります。
POLARIX試験に80歳を越える高齢者が登録されておらず、 安全性のデータがないため、 「80歳を超える高齢DLBCLに対してはpola-R-CHP療法は倫理的に許容されない」 といった意見を時折耳にしますが、 これはあくまで 「臨床試験の建付けの問題で、 80歳を超える高齢者をPOLARIX試験から除外せざるを得なかったから」 であって、 「pola-R-CHP療法が安全に施行できないから」 という理由ではありません。
実際、 われわれ血液内科医は、 80歳を超える高齢DLBCLに対しては、 正直この程度の限られたエビデンスを根拠として用量あるいはコース数を減らしたR-CHOP療法を行っていますし、 上述の81歳のシニアオリンピックに出場するような高齢者には、 ガイドラインで減量が推奨されていたとしても、 "full dose"のR-CHOP療法を行うこともあるでしょう。
繰り返しになりますが、 ガイドラインはあくまで一般論の記載に留まることが多いですし、 ガイドライン発刊後のエビデンスは当然記載されないため、 新たな治療選択肢が出てくればその都度その治療がどの対象に推奨されるか、 自身で考える癖をつけましょう。
Step 7 : エビデンスの実行と評価
80歳超の高齢DLBCLに対して、 治療強度をどのように決定する?
ここまでは 「どのレジメンを実施するか」 を記載してきましたが、 最後に 「治療強度をどのように決定するか」 にを解説します。
RDI維持には「初回の用量設定」と「治療経過中の用量調整」が重要
一般論として、 化学療法のRDIを維持することはがん治療医の至上命題であり、 特に根治セッティングにおいては可能な限り臨床試験で報告された治療強度を厳密に守ることが必要です。このことは、 Step 4で記載した報告⁴⁾で、 70~80歳ではRDIの維持がPFSと相関することが報告されていることからも一目瞭然です。 RDIを維持するためには、 初回治療の用量設定、 および2サイクル目以降の治療経過中の用量調整の双方が重要となります。
「臓器障害を有する場合」 や 「薬物相互作用がある場合」 は用量調整が必要
大前提として、 「むやみな減量や治療の遅延をしてはならない」 のは言うまでもありません。 その中で、 科学的根拠に基づいて用量が設定できるケースとして、 臓器障害を有する場合が挙げられます。
抗がん薬に限らず、 薬剤ごとに肝障害や腎障害における推奨用量はエビデンスがありますので、 治療前および治療経過中に臓器障害を呈した場合には、 そのつど論文やUpToDate等で推奨用量を確認しましょう。
また、 抗がん薬同士、 あるいは支持療法との薬物相互作用も検討が必要です。 こちらもLexicomp*等で投与前に確認し、 適切な用量調整を行いましょう。
*UpToDate®︎内にある、薬物相互作用を調べるためのツール

CGAが治療強度設定の参考になる
その上で、 「80歳以下は全例でfull dose、 80歳を越える高齢者は全例で減量」 など、 杓子定規に決めることも適切ではありません。 実際、 Step 5で紹介したPOLAR BEAR試験でも、 75~80歳かつsCGAでfrailに該当した未治療DLBCLも臨床試験の選択基準に設定していますし、「造血器腫瘍診療ガイドライン2023年版」にも、 CGAを用いた臨床試験の記述も含まれています。
悪性リンパ腫に限らず、 こうした高齢者機能評価ツールを用いた臨床試験は複数のがん種で多数行われているのですが、 現時点において実臨床で推奨できるほどのエビデンスは出ていません。 ただし、 CGA自体は高齢者の機能評価における重要性は確立しており、 初回投与時の治療強度を検討する際の参考にはなりますので、 少なくともどういった項目がCGAに含まれているかどうかくらいは確認しておくと役立つかもしれません。
「忍容性があるならfull dose、 なければ50%の減量」が原則
こういったいくつかの要素を考慮したとしても、 症例を問わない推奨用量の設定は不可能ですので、 症例ごとに減量すべきか、 減量するとしてどの程度減量するかはその都度検討するほかありません。 原則として「減量せずとも忍容性があるならfull dose、 そもそも推奨されるレジメンに対する忍容性が危ぶまれるのであれば50%の減量」を限度とすることが一般的です。
その間として、 80%、 75%、 70%とさまざまな減量の程度がありますが、 「どのような患者背景で、 どの程度の減量が許容限度か」 の判断にはある程度経験を要しますし、 その経験則をもってしても推奨用量を完全に設定することは不可能ですので、 経験豊富なスタッフとのカンファレンスが重要となるでしょう。
2サイクル目以降の用量調整は総合的に判断
次に、 2サイクル目以降の用量調整についてですが、 治療開始後の用量調整に関しては役に立つエビデンスはほとんどないため、 ある程度総合的に判断することになります。
まず、 治療開始後に臓器障害が生じた、 あるいは新たな併用薬を開始した場合には、 上述したようにエビデンスに基づいた減量休薬、 薬物相互作用を確認する点は同じです。 また、 使用しているレジメンの引用文献やプロトコルに、 生じた臓器障害や有害事象に応じて次コースからの減量休薬について言及されている場合がありますので、 そちらを参考にしましょう。
使用している薬剤が単剤であれば、 製薬企業が作成した適正使用ガイドなども参考になるでしょう。
減量・休薬について
ここからは、 初回治療で生じた副作用や治療経過を参考にした次コースからの減量休薬について解説していきます。 まず、 使用しているレジメンが単剤か、 あるいは多剤併用化学療法かによって考慮すべき因子が変わってきます。 なぜなら、 治療後に生じた副作用には、 基本的に被疑薬があるからです。
被疑薬が明確な場合
例えば、 切除不能進行胃がんに対してパクリタキセル療法を実施中に化学療法誘発性末梢神経障害 (CIPN) を呈した場合には、 パクリタキセルが被疑薬であることは言うまでもないですが、 未治療DLBCLに対してR-CHOP療法を実施中にCIPNを呈した場合、 被疑薬はどの薬剤になるでしょうか?パクリタキセルと同じく微小管阻害薬に該当し、 R-CHOP療法に含まれる薬剤の中でCIPNを呈するとなれば、 答えはビンクリスチンということになります。 CIPNのように、 一部の作用機序の薬剤で特徴的な副作用を呈する場合は理解しやすいため、 被疑薬、 および呈した場合の減量休薬の方法まで理解しておくと有用です。
被疑薬が不明確 (複雑) な場合
その一方で、 未治療DLBCLに対してR-CHOP療法を実施中にgrade 4の好中球減少を呈した場合、 被疑薬はどの薬剤になるでしょうか?プレドニゾロンではないでしょうし、 リツキシマブも単剤ではgrade 4の好中球減少は呈さないだろうと思われますが、 シクロホスファミド、 ドキソルビシン、 ビンクリスチンはすべて好中球減少の発現が知られていますので、 被疑薬が単一ではない印象をもちます。 なおかつ、 多剤併用化学療法の場合はそれぞれの薬剤で投与量も異なりますので、 薬剤の種類と各薬剤の投与量まで留意しなければならないため、 被疑薬の特定は困難を極めます。
参考になる情報として、 各薬剤の用量制限毒性 (DLT) が挙げられます。 先ほどのR-CHOP療法の場合、 詳細な各薬剤のDLTの説明は複雑すぎるため省略しますが、 幸いにもドキソルビシンを使用しないR-CVP療法との比較にてドキソルビシンが骨髄抑制の被疑薬になり得ることが知られていますので、 ドキソルビシンが単独の被疑薬ではないものの、 好中球減少に寄与する部分が比較的大きいと言えるかもしれません。
ただし、 一言にgrade 4の好中球減少といっても、 FNを併発したのか、 持続期間がどの程度だったのか、 他の血液および非血液毒性の発現およびその重症度などによって、 患者さんの生体内でどの薬剤が過剰量となっているかを推定することが重要となります。
減量・休薬時に気を付けるポイント
実際に減量や休薬をするとなった場合に、 気を付けるべき点について列挙していきます。
まず単剤の場合ですが、 出現した副作用が使用薬剤に起因することを特定することは当然ですが、 減量や休薬で軽減できるものかどうかも確認する必要があります。
例えば、 ドキソルビシンによる好中球減少であれば減量によって発現頻度や重症度は軽減すると思いますが、 よほどの減量をしない限り脱毛は必発するでしょう。 すなわち、 そもそも脱毛が許容できない患者さんであればドキソルビシン含有レジメンを選択すべきではないでしょうし、 ひとまず脱毛が出現してしまえば減量や休薬をしても治療期間内に改善することはありません。
このように、 使用している使用薬剤と、 出現した副作用に因果関係があるか、 用量反応性があるか、 減量休薬で改善が期待できるかどうかを検討することが重要です。 投与中の薬剤による副作用が発現した場合、 減量や休薬で重症度が軽減するものであれば、 早めの減量休薬をすることで、 投与中の薬剤をできる限りRDIを維持することにつながるでしょう。
次に多剤併用レジメンの場合ですが、 上述したようにそもそも被疑薬を特定することが困難なため、 各症例やレジメンごとに個別に考えるほかありません。 ただし、 単剤と異なり多剤併用レジメンを使用する場合のみ、 新たに考慮しなければならない要因があります。 それは、 副作用を発現していない薬剤のRDIです。
例えば、 未治療DLBCLに対してR-CHOP療法を実施していたとして、 grade 3のCIPNが出現したとします。 この場合、 ビンクリスチンが被疑薬となりますので、 ビンクリスチンを休薬してR-CHP療法としてCIPNがgrade 1以下に改善するまで継続することになるでしょう。
一方で、 今回の患者さんに"full dose"のR-CHOP療法を実施するとどのような経過を辿るでしょうか。 仮想症例のため一概には言えませんが、 高齢化に伴う各臓器の代謝・排泄機能が低下していることが想定されるため、 血液・非血液毒性ともに発現頻度、 重症度、 持続時間が長くなるでしょう。 その結果、 2コース目開始時点で血液毒性からの回復が不十分となり、 1コース21日間隔での投与が維持できないことが予想されます。
こうなってしまった場合、 血液毒性からの回復が得られるまで2コース目の投与日を延期することになるのは言うまでもないのですが、 各薬剤のRDIはどうなるでしょうか。 シクロホスファミド、 ドキソルビシン、 ビンクリスチンは骨髄抑制の被疑薬であるため、 RDIが低下することは致し方ないのかもしれませんが、 リツキシマブとプレドニゾロンのRDIはどうでしょうか。 両薬剤は基本的に骨髄抑制の被疑薬である可能性は低いため、 シクロホスファミド、 ドキソルビシン、 ビンクリスチンの用量調整をしなかったことで、 結果的に2コース目の投与が延期されてしまった、 すなわちRDIが低下、 治療効果を落としたことになります。 これは多剤併用化学療法をしている場合のみ想定しなければならない事由ですが、 担当医としては避けなければならない事象です。
そのため、 多剤併用化学療法を実施する場合には、 自身が設計した投与スケジュールで治療を実施した場合に、 次コースが予定通り実施できるかを逆算し、 支障になりそうな投与設計になっていると予想されれば、 予め想定される副作用の被疑薬のみ減量しておくことが必要になります。 だからこそ、 POLAR BEAR試験ではpola-R-CHP療法で骨髄抑制の被疑薬と想定されるシクロホスファミド、 ドキソルビシンを半量に減量したpola-R-miniCHP療法が選択されたと理解できるでしょう。
さいごに
今回は、 81歳以上で初発のDLBCL患者の治療で留意する点を解説しました。
81歳以上の高齢者はどうしても臨床試験から除外されることが多いため、 治療方針の立案が難しいですが、 かといって治療を行わないわけにはいきません。
限られたエビデンスから、 新規のエビデンスをどのように外挿するかを考慮して、 超高齢者であっても新規のエビデンスの利益を享受できるように工夫しましょう。
<出典>
1) 日本血液学会 : 造血器腫瘍診療ガイドライン2023年版.
2) Lancet Oncol. 2011 May;12(5):460-8.
3) Br J Cancer. 2022 Jan;126(1):134-143.
4) Br J Haematol. 2016 May;173(3):487-91.
5) HemaSphere 7(S3):p e91359ec, August 2023.
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。