新薬承認情報
26日前
ライブリバント 「EGFR変異陽性進行NSCLC」 に適応-3月の変更承認情報まとめ-
新薬含む22剤を承認
医薬品医療機器総合機構 (PMDA) は、 2025年3月に22種類の医薬品が厚生労働省から承認を受けたと発表した (うち新規有効成分7剤)。
アミバンタマブ・ラゼルチニブ
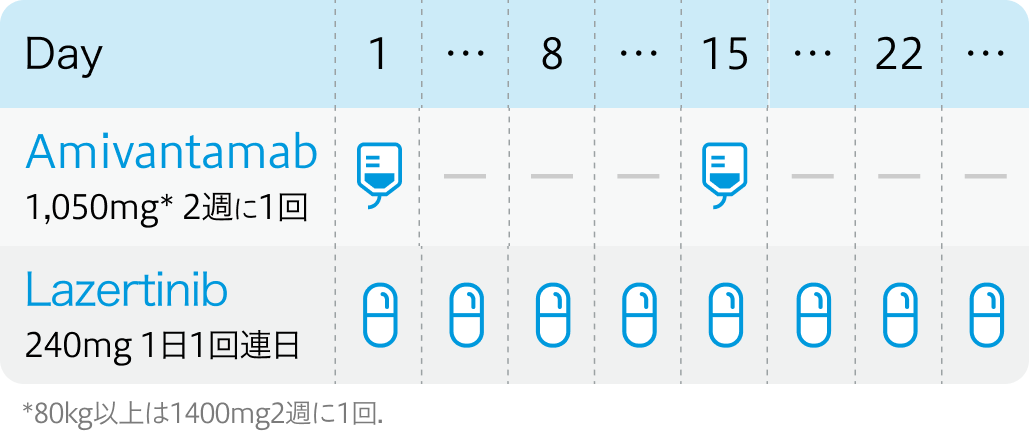
EGFR-MET二重特異性抗体アミバンタマブ (ライブリバント®) は、 EGFR遺伝子変異陽性の切除不能な進行・再発非小細胞肺癌 (NSCLC) に対する1次治療として、 EGFR阻害薬ラゼルチニブ (ラズクルーズ®) との併用療法で新たに承認された同併用療法は、 EGFRおよびMETの両方を同時に抑制する、 化学療法を用いない唯一の分子標的治療レジメンとなる。
今回の承認は、 第III相試験MARIPOSAに基づく。 オシメルチニブ単剤群と比較し、 併用群では30%の病勢進行または死亡リスクの減少 (PFS中央値: 16.6ヵ月対23.7ヵ月) が示された。 OS中央値は1年以上の延長が見込まれている。
1サイクル目
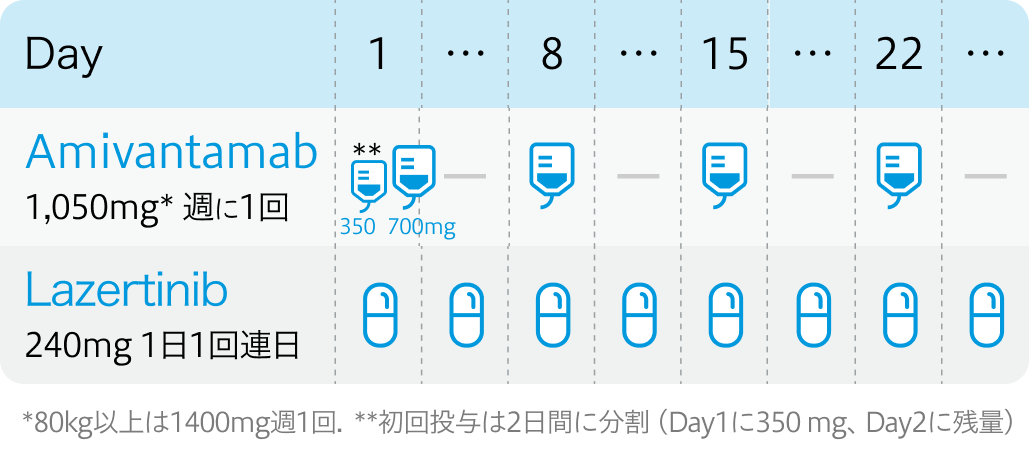
2サイクル目以降
<関連> 肺癌世論調査:EGFR変異陽性IV期非小細胞肺癌の1次治療は?医師458人が回答!
EGFR変異陽性Ⅳ期NSCLCの1次治療の選択、 今後どのレジメンを選びますか?(MARIPOSAレジメンが承認された場合)

デュピルマブ
抗IL-4/13抗体デュピルマブ (デュピクセント®) は、 慢性閉塞性肺疾患 (COPD) に対し、 国内で初めて適応を取得した。 COPDに対する生物学的製剤での適応取得は初となる。
今回の承認は、 長時間作用性β2刺激薬 (LABA)、 長時間作用性抗コリン薬 (LAMA)、 吸入ストロイド薬 (ICS) 併用療法で効果不十分な40歳以上のCOPD患者931例 (うち日本人13例) を対象とした国際第III相試験の結果に基づく。 デュピルマブ投与により、 主要評価項目であるCOPD増悪イベントの年間発現率が有意に改善した (p=0.0005)。
デュルバルマブ
抗PD-L1抗体デュルバルマブ (イミフィンジ®) は、 限局型小細胞肺癌 (LD-SCLC) に対する根治的化学放射線療法後の維持療法として、 免疫療法として国内で初めて承認された。
今回の承認は、 LD-SCLC患者を対象とした国際第III相試験ADRIATICの結果に基づく。 同試験では、 デュルバルマブ群はプラセボ群と比較して死亡リスクを27%低下させ (HR : 0.73、 95%CI : 0.57~0.93、 p=0.0104)、 OS中央値を大幅に延長した。 また無増悪生存期間 (PFS) も有意に改善された (HR : 0.76、 95%CI : 0.61~0.95、 p=0.0161)。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。