HOKUTO編集部
1ヶ月前
本邦初、 体重に応じた投与が可能な二重特異性抗体テクベイリが発売 : 多発性骨髄腫

Johnson & Johnson (ヤンセンファーマ) は3月19日、 B細胞成熟抗原 (BCMA) およびCD3を標的とする二重特異性抗体テクリスタマブ (商品名 テクベイリ®皮下注30mgおよび153mg) について、 「再発または難治性の多発性骨髄腫 (標準的な治療が困難な場合に限る) 」 を効能・効果として、 同日に発売した旨を公式サイトで発表した。
テクリスタマブ (テクベイリ) とは
本邦で初かつ唯一の体重に応じた投与が可能な二重特異性抗体
多発性骨髄腫は、 再発を繰り返し、 その度に別の治療を行わなければならなくなる患者も多く、 依然としてアンメットニーズの高い疾患である。 再発して症状の再燃を繰り返す度に症状は悪化し、 治療が奏効する可能性は低くなり、 奏効持続期間も短くなる傾向にある。
テクリスタマブは投与前の希釈が不要な皮下注製剤であり、 再発または難治性の多発性骨髄腫において、 本邦で初めてかつ唯一の体重に応じた投与が可能なBCMAおよびびCD3を標的とするT細胞リダイレクト二重特異性抗体である。
T細胞表面に発現するCD3受容体および骨髄腫細胞表面に発現するBCMAの両方に結合し、 免疫系を活性化させる。
製品概要
製品名 : テクベイリ®皮下注30mg、 テクベイリ®皮下注153mg
一般名 : テクリスタマブ (遺伝子組換え)
効能又は効果 : 再発または難治性の多発性骨髄腫 (標準的な治療が困難な場合に限る)
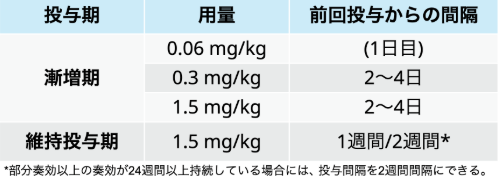
用法及び用量 : 通常、 成人にはテクリスタマブ (遺伝子組換え) として、 漸増期は、 1日目に0.06mg/kg、 その後は2~4日の間隔で0.3mg/kg、 1.5mg/kgの順に皮下投与する。 その後の継続投与期は、 1.5mg/kgを1週間間隔で皮下投与する。 なお、 継続投与期において、 部分奏効以上の奏効が24週間以上持続している場合には、 投与間隔を2週間間隔とすることができる。
包装 : テクベイリ®皮下注30mg 3mL [1バイアル]、 テクベイリ®皮下注153mg 1.7mL [1バイアル]
薬価 : テクベイリ®皮下注30mg : 30mg 3mL 1瓶 21万6,930円、 テクベイリ®皮下注153mg : 153mg 1.7mL 1瓶108万1,023円
製造販売承認日 : 2024年12月27日
薬価基準収載日 : 2025年3月19日
発売日 : 2025年3月19日
製造販売元 : ヤンセンファーマ株式会社
開発の背景
MajesTEC-1試験・MMY1002試験で持続的な奏効と良好な安全性プロファイル
テクリスタマブの承認は、 免疫調節薬、 プロテアソーム阻害薬および抗CD38モノクローナル抗体製剤を含む少なくとも3つの標準的な治療歴を有する、 成人の再発または難治性の多発性骨髄腫患者を対象に同薬の有効性および安全性を評価した海外第Ⅰ/Ⅱ相MajesTEC-1試験および国内第Ⅰ/Ⅱ相MMY1002試験の結果に基づく。
いずれの試験においても、 テクリスタマブは深く持続的な奏効および良好な安全性プロファイルを示した。
MajesTEC-1試験¹⁾
追跡期間中央値30.4ヵ月における奏効率 (ORR) が63%で、 うち46%が完全奏効 (CR) 以上を達成し、 奏効は時間の経過とともに深くなることが示された。
また、 奏効期間 (DOR)、 無増悪生存期間 (PFS)、 全生存期間 (OS) それぞれの中央値は、 24.0ヵ月、 11.4ヵ月、 22.2ヵ月であった。
有害事象 (全Grade、 Grade3/4) として、 好中球減少症 (72%、 66%)、 貧血 (55%、 38%)、 血小板減少症 (42%、 23%)、 リンパ球減少症 (36%、 35%)、 感染症 (79%、 55%) などが報告された。 Grade5の感染症22件のうち、 18件はCOVID-19によるものであった。
MMY1002試験²⁾
追跡期間中央値14.3ヵ月におけるORRは76.9%であり、 CR以上が65.4%であった。 DOR、 PFS、 OSの中央値はいずれも未到達であり、 12ヵ月時点のDOR率、 PFS率、 OS率はそれぞれ89.7%、 75.2%、 76.2%であった。 また微小残存病変 (MRD) 10-5の評価が可能であった患者のMRD陰性率は83.3%であった。 なお安全性に関する所見は、 MajesTEC-1試験の結果と一貫しており、 新たなシグナルは認められなかった。
出典
関連コンテンツ
テクリスタマブ (テクベイリ®) | 多発性骨髄腫 > 再発難治性
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。