新薬承認情報
11ヶ月前
イムデトラ 「SCLC」 等への適応追加-24年12月の承認情報まとめ-
25剤を承認、 うち新規有効成分14剤
医薬品医療機器総合機構 (PMDA) は、 2024年12月に25種類の医薬品が厚生労働省から承認を受けたと発表した。 (うち新有効成分は14剤)
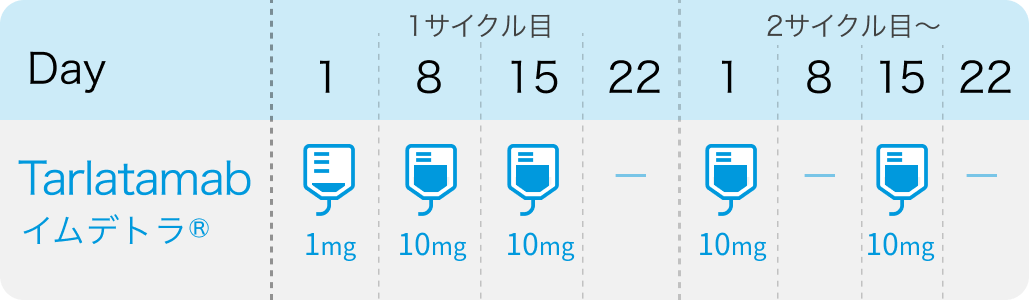
タルラタマブ
タルラタマブ (商品名イムデトラ) は、 デルタ様リガンド3 (DLL3) 標的の二重特異性T細胞誘導抗体。 二重特異性T細胞誘導抗体の国内承認は、 2018年に再発または難治性のB細胞性急性リンパ性白血病に対する治療薬として承認されたブリナツモマブに続き、 2剤目となる。
今回の承認は、 プラチナ製剤を含む癌化学療法後に増悪した進行・再発の小細胞肺癌 (SCLC) を対象にした第II相国際共同非盲検試験DeLLphi-301の結果に基づく。 同試験において、 主要評価項目である盲検下独立中央評価 (BICR) に基づくタルラタマブ10mg投与群の客観的奏効率 (ORR) は40% (95%CI 29–52%)、 無増悪生存期間 (PFS) 中央値は4.9ヵ月 (同2.9–6.7ヵ月)、 全生存期間 (OS) 中央値は14.3ヵ月 (同10.8ヵ月–未到達) だった。
>> 関連レジメン
(HOKUTO編集部の関連コンテンツに遷移します)
エフルエルダ
エフルエルダは高用量4価インフルエンザ (A/B型) HAワクチン。 同薬一株当たりの抗原量は標準用量インフルエンザワクチンの4倍となり、 インフルエンザに伴う深刻な合併症 (入院、 肺炎、 心臓発作、 脳卒中等) リスクが高い高齢者のために開発された。
同薬における有効性を検証した、 海外で実施された無作為化比較試験の結果、 高齢者のインフルエンザ発症率に関して、 主要評価項目である同薬の標準用量ワクチンに対する相対的ワクチン有効性は 24.2%だった。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。