臨床試験データベース
2年前
【NAPOLI-1試験】膵臓癌に対するNal-IRI+5-FU/LV

ゲムシタビンベースの治療歴のある転移性膵管腺癌患者において、 ナノリポソーム化イリノテカン (Nal-IRI) 、 フルオロウラシル (5-FU) 、 ロイコボリン (LV) の併用療法とNal-IRIの単剤療法を、 5FU/LVの併用療法を対照に検証した第Ⅲ相ランダム化比較試験NAPOLI-1の結果より、 Nal-IRI+5-FU/LV併用療法の全生存期間 (OS) に対する有効性が示された。
原著論文
▼中間解析結果
▼追跡結果
NAPOLI-1 phase 3 study of liposomal irinotecan in metastatic pancreatic cancer: Final overall survival analysis and characteristics of long-term survivors. Eur J Cancer. 2019 Feb:108:78-87. PMID: 30654298
関連レジメン
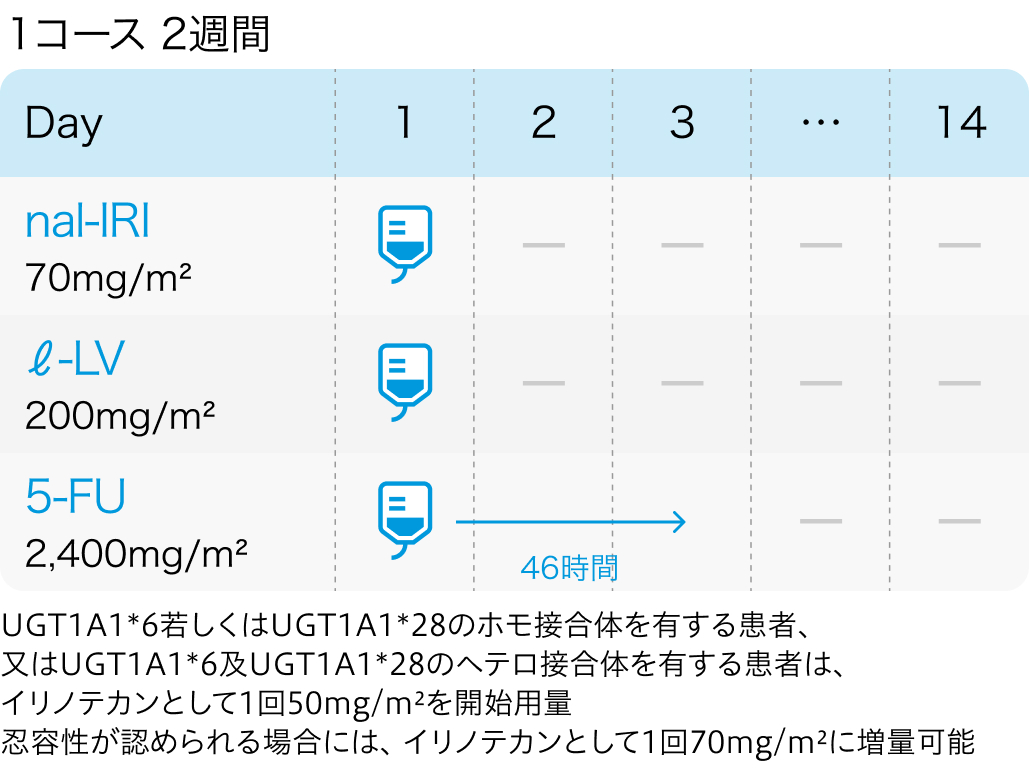
NAPOLI-1試験の概要
対象
ゲムシタビンベースの治療歴のある転移性膵管腺癌患者
方法
417例を以下の3群に1:1:1で割り付けた。
- Nal-IRI+5-FU/LV群 (117例)
Nal-IRI 80mg/m²+LV400mg/m²+5-FU 2400mg/m² (46時間かけて) を2週間毎に投与
- Nal-IRI単剤群 (151例)
Nal-IRI 120mg/m²を3週毎に投与
- 5-FU/LV対照群 (149例*)
LV200mg/m²+5-FU 2000mg/m² (24時間かけて) を週1回、 4週投与後2週休薬。 6週サイクル
当初はNal-IRI単剤群 (33例) と5-FU/LV対照群 (30例) のみであったが、 プロトコールが改定され、 Nal-IRI+5-FU/LV群が追加された。 改訂後に5-FU/LV対照群に組み入れられた119例が、 5-FU/LV併用対照群としてNal-IRI+5-FU/LV群との比較に使用されている。
評価項目
- 主要評価項目:OS
- 副次評価項目:無増悪生存期間 (PFS) 、 治療成功期間 (TTF) 、 奏効率 (ORR) 、 血清CA19-9奏効率*、 QOL、 安全性
*治療期間中に少なくとも1回、 ベースラインからCA19-9量が50%以上減少
NAPOLI-1試験の結果
患者背景
3群間で同様であった。
OS中央値
- Nal-IRI+5-FU/LV群:6.2ヵ月
(95%CI 4.8-8.4ヵ月)
- 5-FU/LV対照群:4.2ヵ月
(95%CI 3.3-5.3ヵ月)
HR 0.75、 p=0.039
- Nal-IRI単剤群:4.9ヵ月
(95%CI 4.2-5.6ヵ月)
- 5-FU/LV対照群:4.2ヵ月
(95%CI 3.6-4.9ヵ月)
HR 1.07、 p=0.568
OS率 (6ヵ月時、 12ヵ月時)
- Nal-IRI+5-FU/LV群:53%、 26%
- Nal-IRI単剤群:39%、 11%
- 5-FU/LV対照群:35%、 15%
PFS中央値
- Nal-IRI+5-FU/LV群:3.1ヵ月
(95%CI 2.7-4.2ヵ月)
- 5-FU/LV対照群:1.5ヵ月
(95%CI 1.4-1.8ヵ月)
HR 0.57、 p=0.0001
- Nal-IRI単剤群:2.7ヵ月
(95%CI 2.1-2.9ヵ月)
- 5-FU/LV対照群:1.6ヵ月
(95%CI 1.4-1.8ヵ月)
HR 0.81、 p=0.105
TTF中央値
- Nal-IRI+5-FU/LV群:2.3ヵ月
(95%CI 1.6-2.8ヵ月)
- 5-FU/LV対照群:1.4ヵ月
(95%CI 1.3-1.4ヵ月)
HR 0.6 (95%CI 0.45-0.78)、 p=0.0002
- Nal-IRI単剤群:1.7ヵ月
(95%CI 1.5-2.7ヵ月)
- 5-FU/LV対照群:1.4ヵ月
(95%CI 1.3-1.4ヵ月)
HR 0.82 (95%CI 0.65-1.03)、 p=0.1
ORR
- Nal-IRI+5-FU/LV群:17%
(95%CI 10-24%)
- 5-FU/LV対照群:1%
(95%CI 0-2%)
p<0.0001
- Nal-IRI単剤群:6%
(95%CI 3-11%)
- 5-FU/LV対照群:1%
(95%CI 0-4%)
p=0.020
病勢コントロール率
- Nal-IRI+5-FU/LV群:52%
(95%CI 43-61%)
- Nal-IRI単剤群:44%
(95%CI 36-52%)
- 5-FU/LV対照群:26%
(95%CI 19-33%)
CA19-9奏効率
- Nal-IRI+5-FU/LV群:29%
- 5-FU/LV対照群:9%
p=0.0006
- Nal-IRI単剤群:24%
- 5-FU/LV対照群:11%
p=0.024
QOL
- ベースライン時、 QOL指標 (global health status、 functional scale、 symptoms score) の中央値は治療群間で同等であった。
- 6週と12週の時点で、 治療群間に有意差はなかった。
有害事象 (AE)
- Grade3、 4の好中球減少性敗血症 (発熱性好中球減少症を含む) の発現は、 Nal-IRI+5-FU/LV群では3%、 Nal-IRI単剤群では4%、 5-FU/LV対照群では報告されなかった。
- 治療関連AEによる投与量の遅延・減量、 投与中止に至った患者はNal-IRI+5-FU/LV群で73%、 Nal-IRI単剤群で56%、 5-FU/LV群で37%であった。
著者らの結論
ゲムシタビンベースの治療歴のある転移性膵管腺癌患者において、 Nal-IRI+5-FU+LVの併用療法は、 5-FU+LVの対照療法と比較し、 OSを有意に改善することが示された。
【NAPOLI-1試験】膵臓癌に対するNal-IRI+5-FU/LVの全コンテンツは、医師会員限定でアプリからご利用いただけます*。
*一部のコンテンツは非医師会員もご利用いただけます
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
QRコードから
アプリを
ダウンロード!