HOKUTO編集部
1年前
【消化器癌】2024年8月の関連論文Check up! HERALD、 DESTINY-CRC02など

解説医師

2024年8月の注目論文
今年の8月は久しぶりにお盆の時期に家族と夏休みを過ごし、 日々の妻の献身に感謝すると同時に、 息子の成長を実感することができ有意義であった。 ただ外出するにも気温が高く、 熱中症に気をつけながらの休暇であった。
今月は、
❶第Ⅱ相試験HERALD
HER2増幅を有する固形癌におけるトラスツズマブ デルクステカン (T-DXd) の有効性・安全性の検証
❷第Ⅱ相試験DESTINY-CRC02
HER2陽性大腸癌におけるT-Dxdの至適投与量の検証
❸第Ⅲ相試験BFR14
進行消化管間質腫瘍 (GIST) におけるイマチニブ継続と休止に関する長期追跡結果
の3論文を取り上げる。
❶cfDNAで同定されたHER2増幅固形癌へのT-DXdで高い奏効割合
Trastuzumab Deruxtecan in Advanced Solid Tumors With Human Epidermal Growth Factor Receptor 2 Amplification Identified by Plasma Cell-Free DNA Testing: A Multicenter, Single-Arm, Phase Ⅱ Basket Trial. J Clin Oncol. 2024 Aug 1:JCO2302626. PMID: 39088783
▼背景
HER2は乳癌や胃癌における癌薬物療法では重要な標的の一つであるが、 HER2増幅は他の固形癌においても約2~3%で報告されている。 また、 HER2増幅の評価にCell-free DNA (cfDNA) を用いたリキッドバイオプシーの技術が現在開発されており、 この技術を用いて同定されたHER2増幅を有する固形癌を対象に、 一部の癌腫で有効性が証明されている抗体薬物複合体T-DXdの有効性と安全性を評価する多施設共同単群の第Ⅱ相試験であるHERALDが実施された。
▼試験デザイン
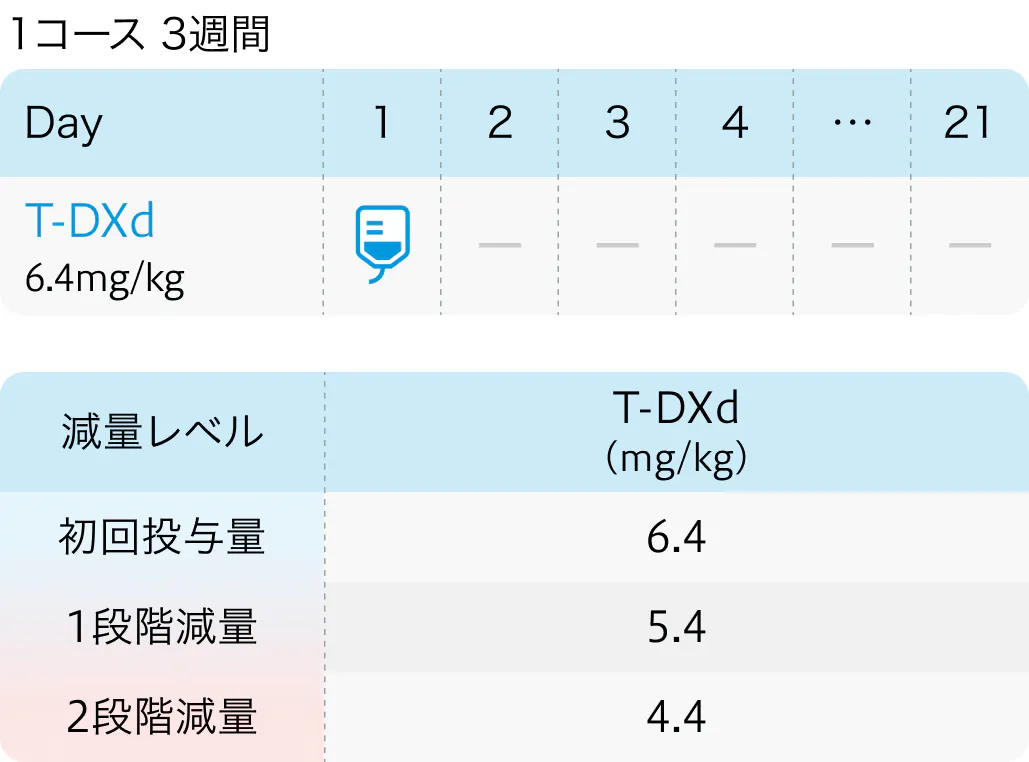
HERALDには、 リキッドバイオプシーで同定されたHER2増幅を有する進行または再発の固形癌が登録され、 試験治療としてT-DXd 5.4mg/kg、 3週ごとの投与が不応・不耐まで継続された。 なお主要評価項目は奏効割合と設定された。
▼試験結果
4,734例がcfDNA検査受けて、 252例がHER2増幅を有すると同定された。 HERALDには、 その中で62例 (16癌種) が登録され、 HER2コピー数中央値は8.55 (範囲2.4~73.9) であった。
主要評価項目である奏効割合は56.5% (95%CI 43.3~60.0%) であった。 奏効例は13の癌種で認められ、 KRAS変異を有する大腸癌やPIK3CA変異を有する子宮内膜癌、 HER2陰性胃癌でも奏効が認められた。 無増悪生存期間 (PFS) 中央値は7.0ヵ月 (同4.9~9.7ヵ月)、 奏効期間中央値は8.8ヵ月 (同5.8~11.2ヵ月) と報告された。
間質性肺炎は全Gradeで16例 (26%) に報告された。
Grade 1で14例、 Grade 2で1例、 Grade 3で1例
▼結論
本試験から、 cfDNA検査で同定されたHER2増幅を有する進行固形癌において、 T-DXdは高い奏効割合と持続する奏効が認められた。
💬My Opinions
治療選択肢が限られる癌種でも奏効割合が高い
本試験は、 乳癌や胃癌で用いられているT-DXdを、 HER2遺伝子異常を有する他の固形癌に拡大させて有効性と安全性を検討した第Ⅱ相試験である。 まず目を引くのはその高い奏効割合である。 本試験に登録された癌種で頻度が高いのは、 食道癌 (19%) や大腸癌 (16%)、 唾液腺癌 (11%)、 子宮内膜癌(10%)であり、 大腸癌を除くと治療選択肢がいまだに限られている癌種が多く、 これらの癌種において今後T-DXdが実臨床で使用可能になることが期待される。
適切な有害事象管理で忍容性は維持可能
本邦ではT-DXdの開発において間質性肺炎の頻度が高かったことから、 本試験でも間質性肺炎による重篤化が懸念されたが、 間質性肺炎による死亡例はなく、 Grade 3以上も1例のみであった。 間質性肺炎全体の頻度は26%であったが、 適切な有害事象管理を行うことで実臨床でも十分忍容性は保たれると考えられる。
❷HER2陽性大腸癌におけるT-DXdの至適投与量は5.4mg/kg
Trastuzumab deruxtecan in patients with HER2-positive advanced colorectal cancer (DESTINY-CRC02): primary results from a multicentre, randomised, phase 2 trial. Lancet Oncol. 2024 Aug 5:S1470-2045(24)00380-2. PMID: 39116902
▼背景
T-DXdは、 既治療のHER2陽性、 RAS野生型かつBRAF野生型の進行大腸癌に対して、 有望な効果が示唆されている。 そのような中、 RAS変異型や抗HER2抗体既治療例における、 用量最適化とさらなる抗腫瘍効果の評価が希求されている。
国際共同第II相試験であるDESTINY-CRC02では、 既治療のHER2陽性かつRAS野型/変異型の進行大腸癌における推奨用量を確立するため、 T-DXdの2用量 (5.4mg/kgまたは6.4mg/kg) が評価された。
▼試験デザイン
対象は、 既治療のHER2陽性かつRAS野生型/変異型の進行大腸癌で、 全身状態 (PS) が 0-1の症例。
ステージ1においては、 T-DXdの2用量 (5.4mg/kg or 6.4mg/kg) に1:1の割合で無作為に割り付けられ、 ステージ2においては、 5.4mg/kg群のみに割り付けられた。
主要評価項目は奏効割合と設定された。
▼試験結果
DESTINY-CRC02には132例がスクリーニングされ、 122例が登録された。 ステージ1には40例ずつ5.4mg群と6.4mg群の2群に割り付けられ、 ステージ2には5.4mg群に42例が追加で割り付けられた。
男女比 : 男性52%、 女性48%
追跡期間中央値 : 5.4mg群で8.9ヵ月、 6.4mg群で10.3ヵ月
主要評価項目である奏効割合は5.4mg群で37.8% (95%CI 27.3~49.2%)、 6.4mg群で27.5% (95%CI 14.6~43.9%) と中央判定で報告された。
Grade 3以上の治療関連有害事象は、 5.4mg群で41%、 6.4mg群で49%に報告された。
頻度が高かった有害事象は、 5.4mg群で、 好中球減少 (16%)、 貧血 (7%)、 嘔気 (7%)、 白血球減少 (6%) であり、 6.4mg群で、 好中球減少 (26%)、 貧血 (21%)、 血小板減少 (10%)、 白血球減少 (10%) であった。
重篤な治療関連有害事象は、 5.4mg群で13%、 6.4mg群で15%に報告された。
頻度が高かった有害事象 : 5.4mg群で嘔気 (4%)、 6.4mg群で疲労 (5%)、 好中球減少 (5%)、 血小板減少 (5%)であった。
治療期間中に発現した薬剤関連の致死的な有害事象として、 肝不全が5.4mg群で1例報告された。 なお、 薬剤関連の間質性肺炎の全Gradeの発生頻度は5.4mg群では8% (全例がGrade 1~2) であったが、 6.4mg群では13% (うち1例でGrade 5) であった。
▼結論
この結果から、 既治療のHER2陽性かつRAS野生型/変異型の進行大腸癌において、 T-DXdは5.4mg/kg、 3週ごとの投与で、 有望な有効性と良好な忍容性が示され、 同用量が最適と考えられた。
💬My Opinions
長期の治療効果においても5.4mg群が有望
本試験は、 前述のHERALDと同様、 T-DXd単剤の第Ⅱ相試験であるが、 cfDNAによる評価ではなく、 病理組織を用いた評価でHER2陽性/陰性を判定している。 長期の治療効果に関しては、 PFS中央値および全生存期間 (OS) 中央値がそれぞれ、 5.4mg群で5.8ヵ月 (95%CI 4.6~7.0ヵ月)、 全生存期間 (OS) 中央値が13.4ヵ月 (同12.5~16.8ヵ月)、 6.4mg群では5.5ヵ月 (同4.2~7.0ヵ月)、 未到達 (同9.9ヵ月-未到達) と報告され、 こちらも有望な結果であった。
間質性肺炎の発現は限定的
なお有害事象に関してはT-DXdを用いたHERALD同様、 間質性肺炎が懸念されたが発現は限定的であり、 実臨床でも運用可能と考えられる。
❸進行GISTにおけるイマチニブ休止で早期増悪の可能性
Discontinuation versus continuation of imatinib in patients with advanced gastrointestinal stromal tumours (BFR14): exploratory long-term follow-up of an open-label, multicentre, randomised, phase 3 trial. Lancet Oncol. 2024 Aug 7:S1470-2045(24)00318-8. PMID: 39127063
▼背景
進行GISTの症例における、 イマチニブなどのチロシンキナーゼ阻害薬 (TKI) の休止に関して、 長期的な耐性や生存に与え得る影響に関しては明らかでない。 そのため、 イマチニブの休薬を検証する第Ⅲ相非盲検無作為化比較試験であるBFR14が行われ、 今回、 探索的ではあるが長期的な治療成績が得られたので報告する。
▼試験デザイン
同試験では、 フランス内の17施設で登録された18歳以上でPS 0~3の未治療進行GIST患者に対し、 イマチニブ 400mg/dayで投薬を開始し、 完全奏効 (CR) または部分奏効 (PR)、 安定 (SD) が得られた場合、 治療を休止する群と継続する群に1:1ので無作為に割り付けた。
主要評価項目はPFSで、 副次評価項目ではイマチニブ耐性までの期間やOSが設定された。
▼試験結果
イマチニブの1年投与後に、 32例が休止群に、 26例が継続群に割り付けられた。 また、 3年投与後に、 25例が休止群に、 25例が継続群に割り付けられた。 5年投与後には、 14例が休止群に、 13例が継続群に割り付けられた。
観察期間中央値 : 1年で235.2ヵ月、 3年で200.9ヵ月、 5年で164.5ヵ月であった。
主要評価項目であるPFS中央値は、 1年投与後の休止群が6.1ヵ月、 継続群が27.8ヵ月 (HR 0.36、 95%CI 0.20~0.64)、 3年投与後の休止群が7.0ヵ月、 継続群が67.0ヵ月 (同0.15、 0.07~0.32)、 5年投与後の休止群が12.0ヵ月、 継続群が未到達 (同0.13、 0.03~0.58) であった。
副次評価項目であるイマチニブ耐性までの期間の中央値は、 1年投与後の休止群が28.7ヵ月、 継続群が90.6ヵ月 (HR 0.93、 95%CI 0.51~1.71)、 3年投与後の休止群が66.2ヵ月、 継続群が127.3ヵ月 (同0.35、 0.17~0.72)、 5年投与後の休止群が58.6ヵ月、 継続群が未到達 (同0.24、 0.05~1.12) であった。
なおOS中央値は、 1年投与後の休止群が56.0ヵ月、 継続群が105.0ヵ月 (HR 0.84、 95%CI 0.46~1.54)、 3年投与後の休止群が104.0ヵ月、 継続群が134.0ヵ月 (同0.40、 0.20~0.82)、 5年投与後の休止群が未到達、 継続群が110.4ヵ月 (同1.28、 0.41~3.99) であった。
▼結論
これらの結果から、 イマチニブの休止は増悪を認めない進行GISTにおいて推奨できない治療である。 長期フォローアップデータの結果から、 イマチニブの休止は早期の増悪や耐性、 生存期間の短縮につながり得る。
💬My Opinions
奏効例でのイマチニブ休止は適切ではない
進行GISTにおけるイマチニブの休止と継続を比較したBFR14試験の長期フォローアップデータである。 主要評価項目であるPFSでイマチニブ休止のメリットが得られていないのは明確であったが、 さらに長期フォローアップの結果から、 どのタイミングでイマチニブを休薬したとしても、 ほぼ全てのタイミングでイマチニブ休止群のKM曲線が継続群と比較して下にあることからも、 奏効例におけるイマチニブ休止は適切な選択肢でないと考えられる。
臨床での意志決定にインパクトを与える結果
本試験は症例数が限られてはいるが、 希少癌の一種であり、 実臨床における意思決定の際に重要なインパクトを与える結果と考えられる。 現在GISTには本邦ではイマチニブやスニチニブ、 レゴラフェニブ、 ピミテスピブが標準的な治療選択肢であり、 これらを適切なタイミングで使用していくことが実臨床で求められている。
おわりに
9月には欧州臨床腫瘍学会 (ESMO) 2024や国際食道疾患会議 (ISDE) 2024が開かれることから、 KEYNOTE-811試験等、 新たなエビデンスに出会えることを期待している。
関連コンテンツ
海外ジャーナル : HERALD
海外ジャーナル : DESTINY-CRC02
海外ジャーナル : KEYNOTE-811
抗悪性腫瘍薬 > DNAトポイソメラーゼ1阻害薬結合抗HER2ヒト化モノクローナル抗体
抗悪性腫瘍薬 > チロシンキナーゼ阻害薬
胃癌の3次治療レジメン
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。