KIWI (炎症性腸疾患)
5ヶ月前
【第17回KIWI】IBD注目論文 Best of 2024 (第5~4位)

2025年1月に第17回KIWI (Kitasato Institute Webinars on IBD) が開催され、 「Best of 2024」をテーマとして視聴者が推薦したIBD関連の論文TOP 5が発表されました。 本稿では第5位 (同率4本) および第4位に輝いた論文の概要と重要なエッセンスを紹介します。
KIWIとは?
KIWIは、 IBDにまつわるトピックについての教育的なコンテンツをインターネットでライブ配信するウェビナーです。 IBD専門医だけでなく看護師、 薬剤師など、 全ての医療従事者を対象に、 さまざまなレベルの内容を2ヵ月に1回、 ゲストを招き、 対談形式にレクチャーを交えてライブ配信します。

セミナー情報
【日 時】2025年1月10日(金) 19:00~20:30
【テーマ】ベスト・オブ・2024 (PartⅠ)
【ホスト】小林 拓先生
北⾥⼤学北⾥研究所病院炎症性腸疾患先進治療センター
【ゲスト】松浦 稔先生* 松岡 克善先生** 新崎 信一郎先生***
*杏林大学医学部 消化器内科学
**東邦大学医療センター佐倉病院消化器内科
***兵庫医科大学 消化器内科学
第5位※同率4論文
①潰瘍性大腸炎を対象とした抗TL1A抗体の第Ⅱ相試験ARTEMIS-UC
<注目論文>
Phase 2 Trial of Anti-TL1A Monoclonal Antibody Tulisokibart for Ulcerative Colitis. N Engl J Med. 2024 Sep 26;391(12):1119-1129. PMID: 39321363
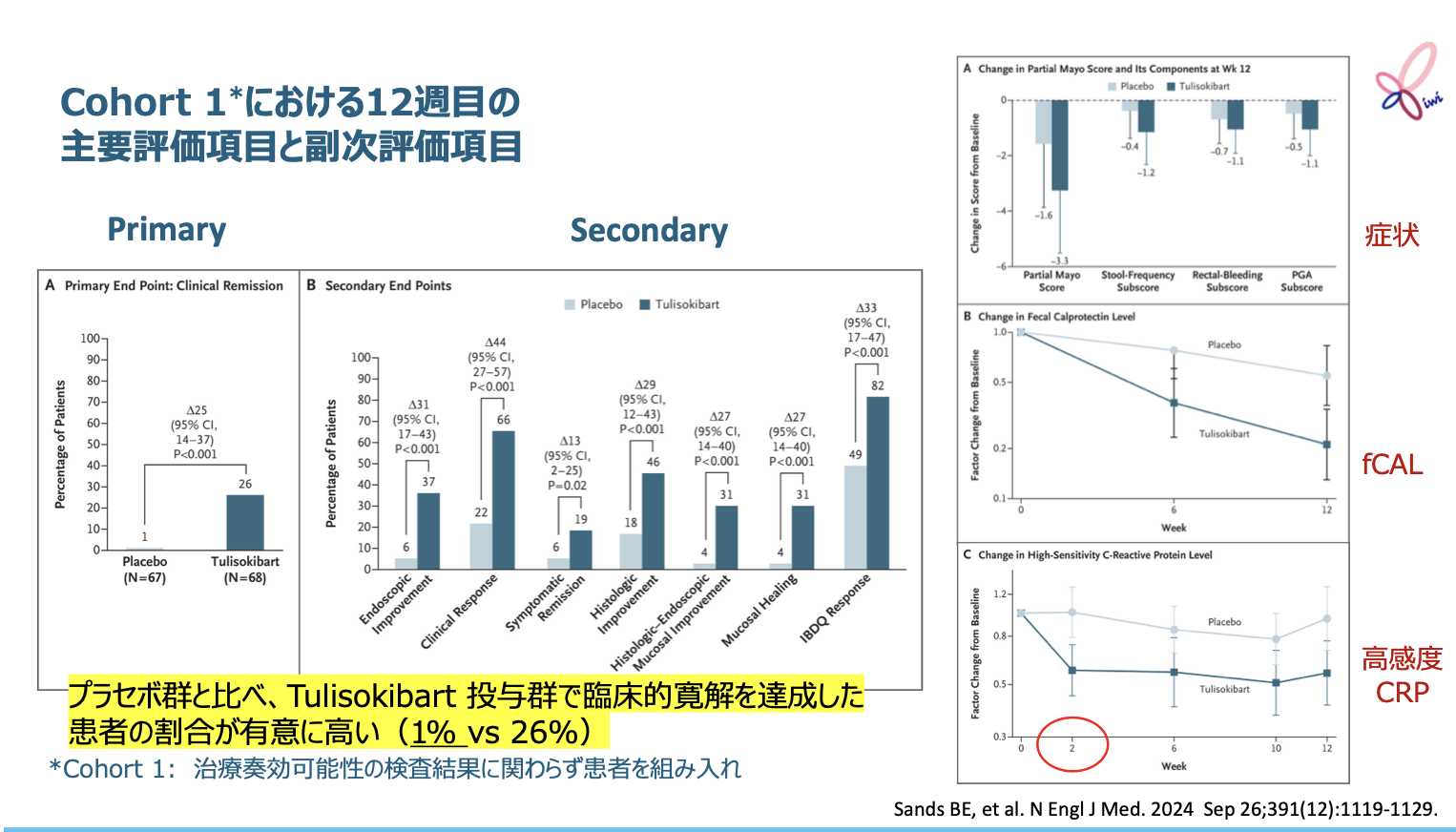
対象・方法
Sandsらは、ステロイド依存性あるいは既存治療で効果不十分な中等症から重症の潰瘍性大腸炎(UC)を対象に、 開発中の抗TL1A抗体tulisokibartの寛解導入療法における有効性および安全性を、 第Ⅱ相二重盲検プラセボ対照無作為化比較試験ARTEMIS-UCで検討した。
治療反応性の高い患者を特定するために開発された遺伝子診断検査を用いて、 コホート1には検査結果に関わらずUC患者135例を組み入れ、 コホート2には検査結果が陽性の患者43例のみを組み入れた。
試験の主な結果
コホート1におけるtulisokibart群の12週時点の臨床的寛解率は26%で、 プラセボ群の1%と比べて有意に高かった(群間差 25%㌽[95%CI 14-37%㌽]、 p<0.001)。
また、 コホート2、 およびコホート1で遺伝子検査が陽性であった患者を統合した75例におけるtulisokibart群の12週時点の臨床的寛解率(32%)は、 プラセボ群(11%)と比べて有意に高かった(群間差 21%㌽[95%CI 2-38%㌽]、 p=0.02)。
有害事象の発現率は、 tulisokibart群とプラセボ群で同程度であった。
<私はこう見る>
抗TL1A抗体の有効性が示された一方で、 12週時点の臨床的寛解率における群間差は、 コホート1と比べて、 コホート1、 2における陽性患者で若干減少しており(25%㌽ vs 21%㌽)、 開発された遺伝子診断検査は治療反応性の高い患者の特定には有用ではないと考えられた。 しかし、 最適な対象集団を特定して治療薬を投与する、 現在のトレンドに沿った試みであり大変興味深い。
関連するHOKUTO記事
【NEJM】活動性UCへのTL1Aモノクローナル抗体tulisokibartが寛解導入に有望
②UCへの各種先進導入療法、 臨床的寛解達成の間接比較
<注目論文>
Comparative Efficacy of Advanced Therapies for Management of Moderate-to-Severe Ulcerative Colitis: 2024 American Gastroenterological Association Evidence Synthesis. Gastroenterology. 2024 Dec;167(7):1460-1482. Epub 2024 Oct 18. PMID: 39425738
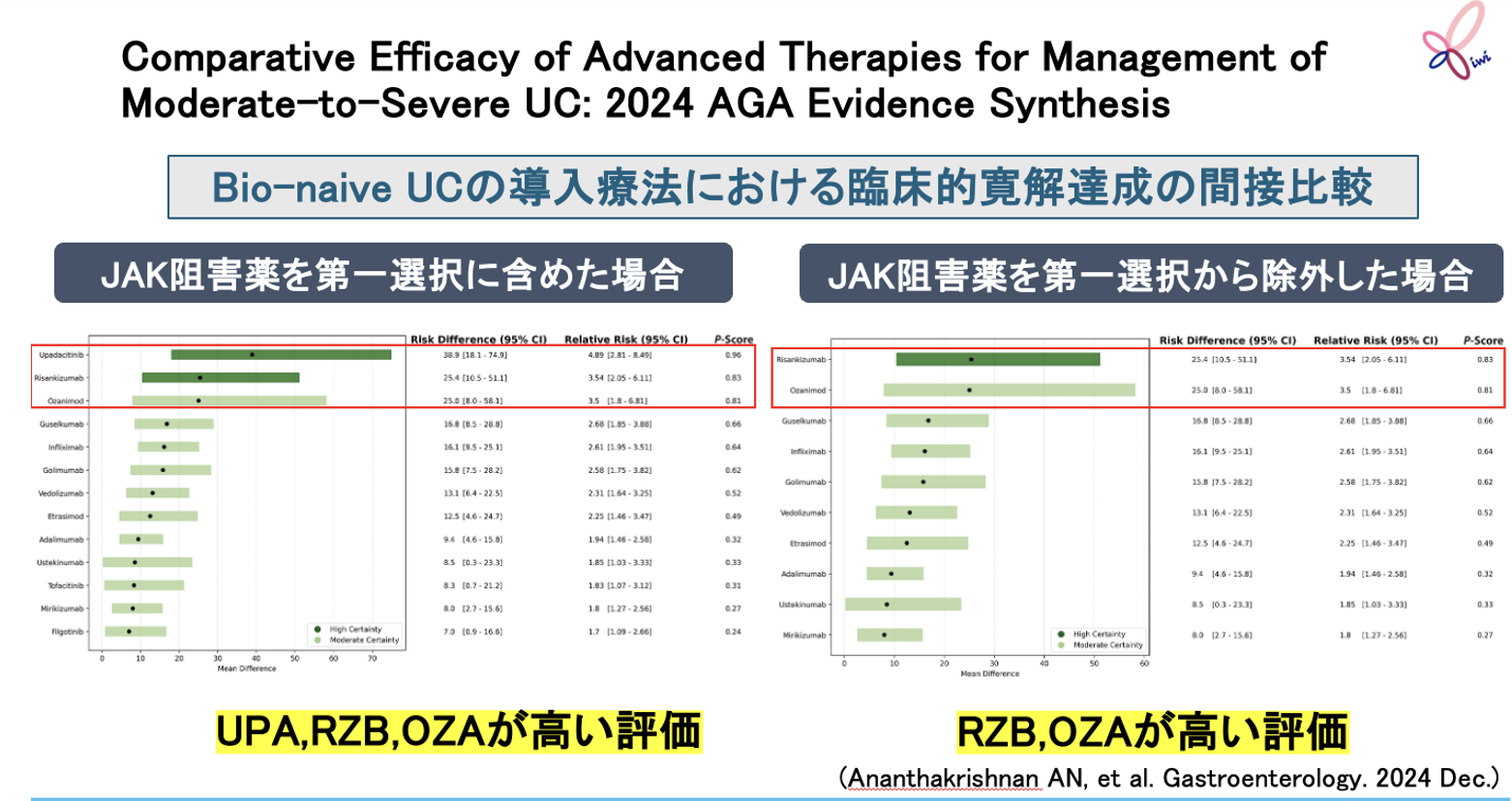
対象・方法
Ananthakrishnanらは、 米国消化器学会(AGA)におけるAGA Living Clinical Practice Guideline*策定のための情報提供を目的として、 複数のデータベースより中等症~重症の成人UCを対象として各種先進治療とプラセボを比較した無作為化比較試験を抽出し、 システマティックレビューおよびネットワークメタ解析により、 各種先進治療の導入療法による臨床的寛解達成を間接比較した。
試験の主な結果
Bio-naive UCの導入療法における臨床的寛解達成において、 JAK阻害薬を第一選択に含めた場合にはウパダシチニブ(UPA)、 リサンキズマブ(RZB)、 オザニモド(OZA)が、 JAK阻害薬を第一選択から除外した場合にはRZB、 OZAの有効性評価が上位となった。
また、 Bio-exposed UCにおいては、 UPA、 ウステキヌマブ、 トファシチニブの有効性評価が上位となった。
<私はこう見る>
米国は、 Bio-naive UCに対する先進治療としてJAK阻害薬を第一選択で使用できないため、 「JAK阻害薬を第一選択から除外した」 場合についても解析が行われている。 現在、 横並びで評価されている先進治療を、 統計的手法を用いて順序付け・差別化を試みた研究だが、 もともと直接比較されていない研究を統計学的に処理するには限界もあり、 この結果をそのまま鵜呑みにはできない。
ただ、 ガイドライン策定のため米国においてこのような研究が行われていることを把握することには一定の意義があるのではないか。
*AGA Living Clinical Practice Guideline
Gastroenterology. 2024 Dec;167(7):1307-1343.
③寛解維持試験でのプラセボ投与による有害性
<注目論文>
Harms with placebo in trials of biological therapies and small molecules as maintenance therapy in inflammatory bowel disease: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2024 Nov;9(11):1030-1040. PMID: 39307146
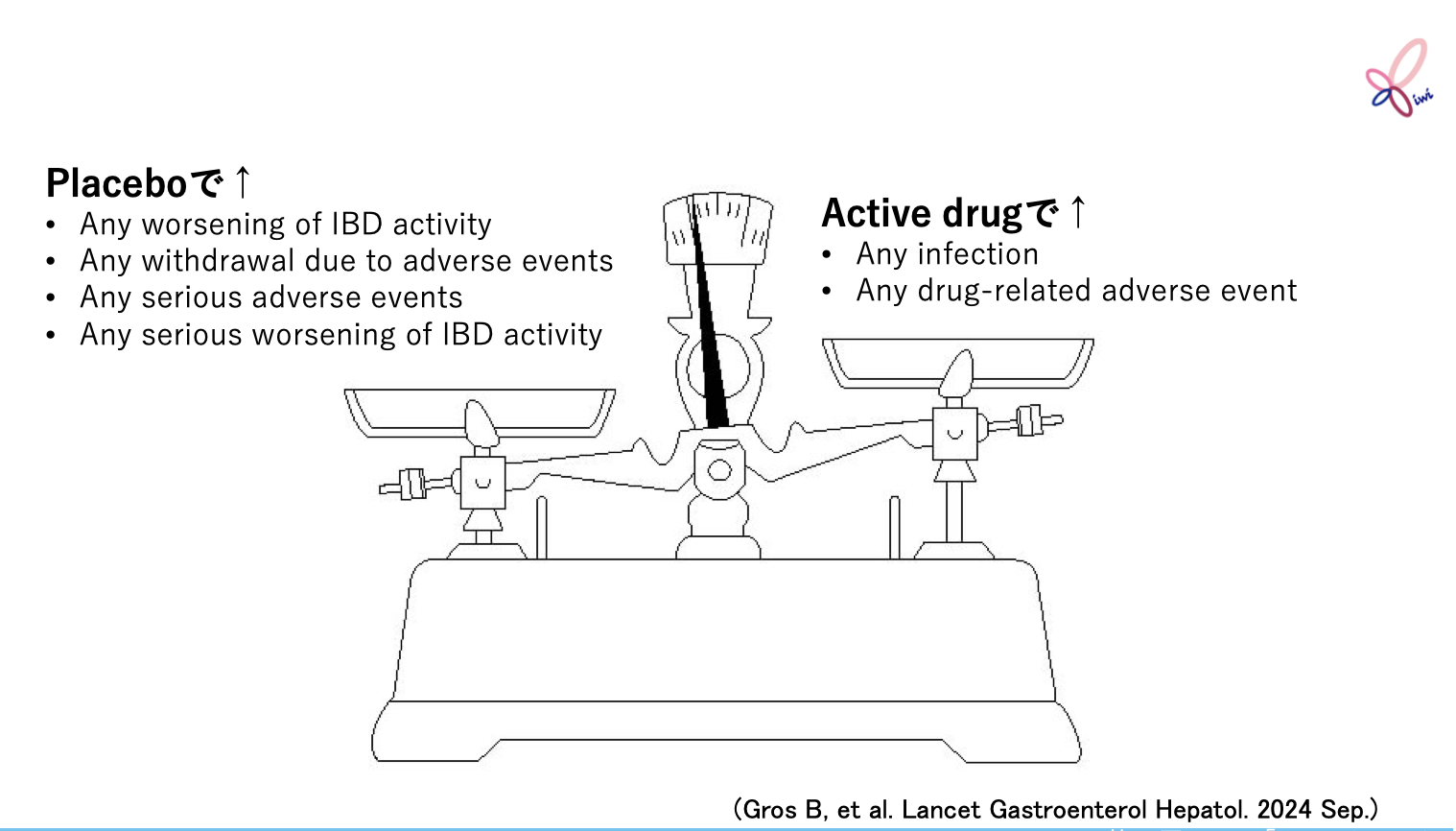
対象・方法
Grosらは、 複数のデータベースを基に、 16歳以上のIBD患者に対する生物学的製剤および低分子薬投与による20週以上にわたる有害事象のデータが報告されているプラセボ対照の寛解維持を目的とした無作為化比較試験45件・43報の文献から1万6,562例を抽出し、 システマティックレビューおよびメタ解析により、 プラセボ投与に伴う潜在的な有害性を調査した。
試験の主な結果
治療中に発現したすべての有害事象、 重篤な感染症、 静脈血栓塞栓症は、 実薬群とプラセボ群で有意差は認められなかった。
プラセボ群では、 IBDの増悪、 有害事象による試験中止、 重篤な有害事象、 重篤なIBDの増悪が実薬群と比べて有意に高かった。 一方で、 実薬群では、 すべての感染症、 薬剤関連の有害事象がプラセボ群と比べて有意に高かった。
<私はこう見る>
このmeta-analysisの対象となった試験は、 いずれも既に上市された薬剤、 つまりIBDに対して有効性・安全性が確認された薬剤の臨床試験であった。 そのため、 プラセボ群では病勢コントロールができずにIBDの増悪が起こり、 関連して有害事象による試験中止などが増加したことで、 このような有害性が示されたと考えられる。 これらを軽減するために、 論文内では早期のオープンラベルへの移行やAdaptive design*の採用が提言されている。
*臨床試験への参加者の蓄積されたデータに基づいて、 試験デザインの1つ以上の側面について、 予め計画された変更を行うことができるデザイン
④クローン病におけるグセルクマブ維持療法の有効性と安全性
本邦承認外の内容を含みます。
<注目論文>
Efficacy and safety of 48 weeks of guselkumab for patients with Crohn's disease: maintenance results from the phase 2, randomised, double-blind GALAXI-1 trial. Lancet Gastroenterol Hepatol. 2024 Feb;9(2):133-146. PMID: 38104569
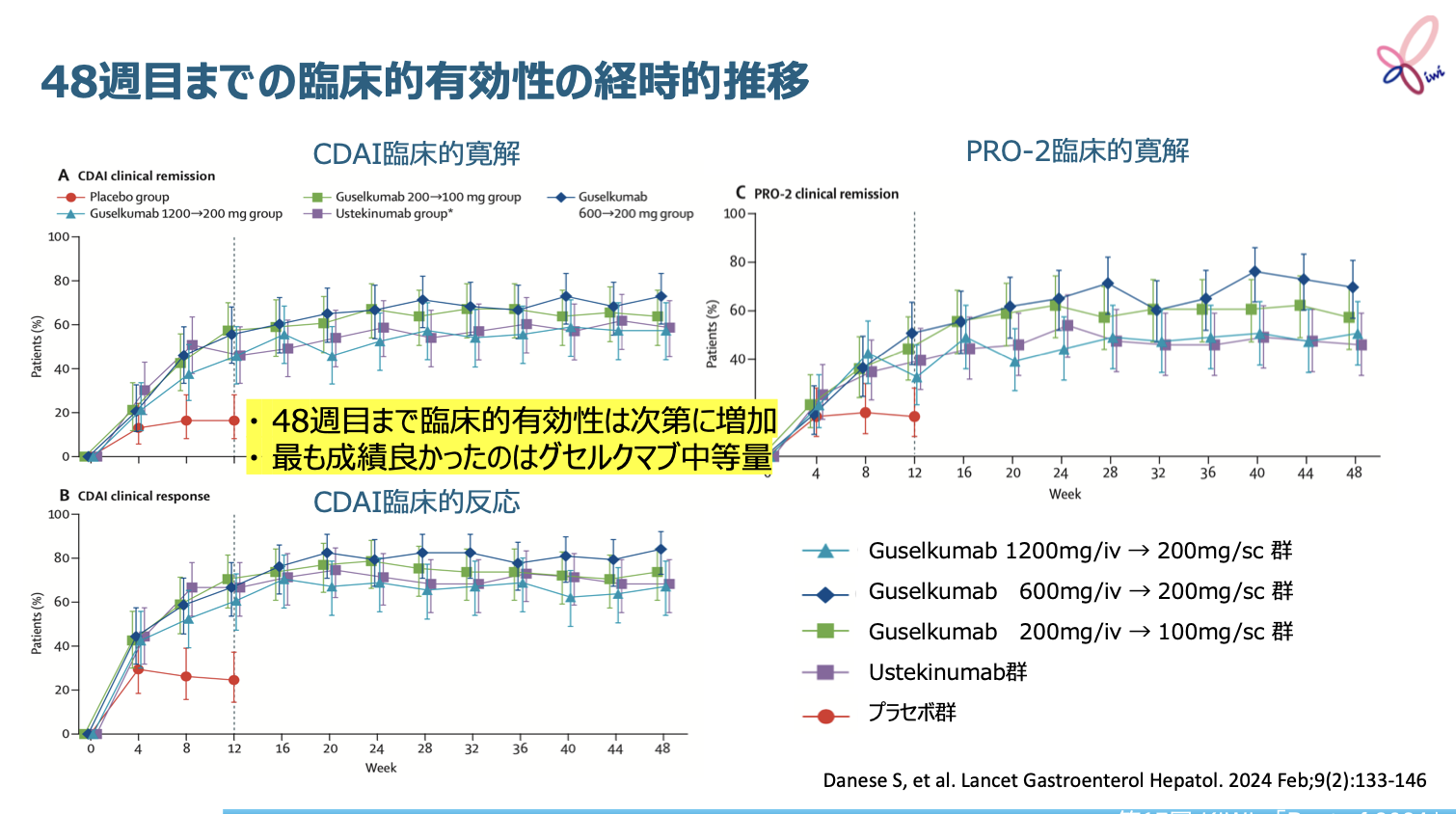
対象・方法
Daneseらは、 中等症~重症の活動性クローン病(CD)を対象に、 抗IL-23p19抗体グセルクマブ*の有効性と安全性を第Ⅱ相多施設共同二重盲検用量設定無作為化比較試験GALAXI-1で検討した。
患者はグセルクマブ投与3群(①導入200mg静注→維持100mg皮下注、 ②導入600mg静注→維持200mg皮下注、 ③導入1,200mg静注→維持200mg皮下注)、 ④抗IL-12/23p40抗体ウステキヌマブ投与群、 ⑤プラセボ群の計5群に無作為割付された。
*グセルクマブ(商品名 トレムフィア®)は、 現在、 成人の中等症から重症の活動期クローン病(既存治療で効果不十分な場合に限る)に係る効能追加を承認申請中
試験の主な結果
48週時点における臨床的寛解(CDAI<150)率は、 グセルクマブ中等量 (600mg静注→200mg、 皮下注) 群で数値上は最も高かった。 内視鏡的改善*率はグセルクマブを投与された3群間で同程度であり、 事後解析で検討された内視鏡的寛解**率でも3群間で数値上の大きな差は認められなかった。
*SES-CDがベースラインから≧50%改善、 またはSES-CD≦2
**SES-CD≦4、 ベースラインから≧2㌽低下、 各サブスコア≦1
<私はこう見る>
現在承認申請中であり、 今後の効能追加でCD治療薬として登場する可能性があるグセルクマブの第Ⅱ相用量設定試験。 他の類似薬でも同様、 抗IL-23p19抗体は必ずしも用量依存性に効果が高まるわけではなく、 最適な用量がある点は興味深い。
関連するHOKUTO記事
【Lancet Gastroenterol Hepatol】クローン病、 グセルクマブの導入期+維持期投与が有効
第4位
ベドリズマブ投与中のチオプリン併用中止の影響
本邦承認外の内容を含みます。
<注目論文>
Effects of Thiopurine Withdrawal on Vedolizumab-Treated Patients With Ulcerative Colitis: A Randomized Controlled Trial. Clin Gastroenterol Hepatol. 2024 Nov;22(11):2299-2308.e5. Epub 2024 May 9. PMID: 38729400
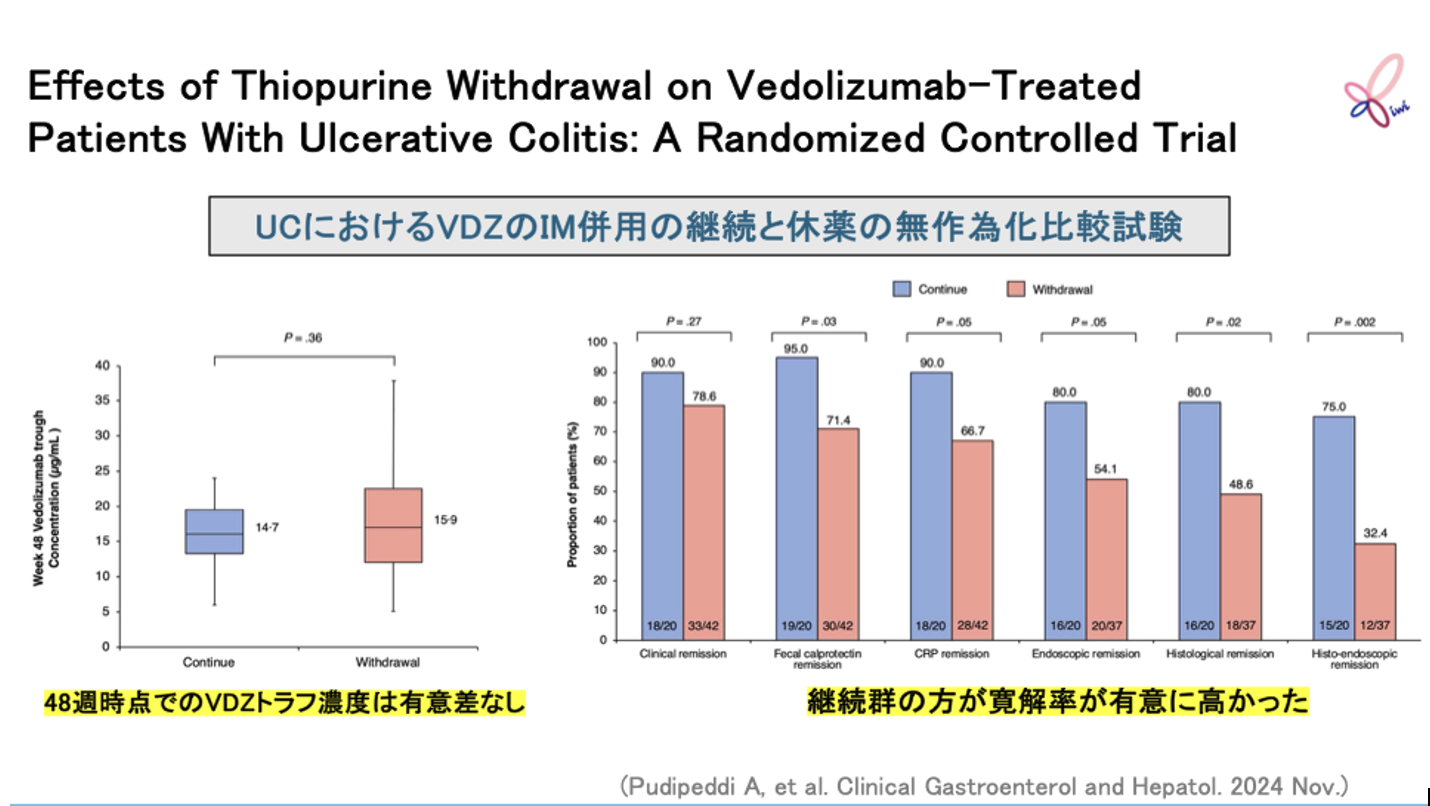
対象・方法
Pudipeddiらは、 オーストラリアにおいてステロイドフリー寛解を6ヵ月以上維持し、 内視鏡的寛解/改善(Mayo内視鏡サブスコア≤1)が認められたUCを対象に、 抗α4β7抗体ベドリズマブ投与中におけるチオプリン製剤併用中止の影響を無作為化比較試験で検討した。
試験の主な結果
48週時点のベドリズマブのトラフ濃度は、 両群で有意差が認められなかった(14.7μg/mL[IQR 12.3-18.5μg/mL] vs 15.9μg/mL[IQR 10.1-22.7μg/mL]、 p=0.36)。
一方で、 チオプリン継続群では、 チオプリン中止群と比べて48週時点の組織学的寛解率(80.0% vs 48.6%、 p=0.02)、 内視鏡的寛解率(80.0% vs 54.1%、 p=0.05)および便中カルプロテクチン寛解率(95.0% vs 71.4%、 p=0.03)が有意に高かった。
<私はこう見る>
オーストラリアでは、 少なくとも3ヵ月間のチオプリンなどの免疫調節薬による治療が無効であった場合にベドリズマブの投与を開始できる。 よって、 本試験では、 ベドリズマブの投与開始時点でほとんどの患者がチオプリン製剤を投与していた。 臨床的寛解率では両群間で有意差が認められないが、 組織的学的、 内視鏡的、 そして便中カルプロテクチンと、 実際の再燃時に所見がみられる順番でチオプリン中止群の寛解率は大幅かつ有意に低下していた。
これらは、 チオプリン製剤が、 無効例においてもベドリズマブとの併用にて一部寛解に寄与する可能性があることを示唆しており、 中止する場合には慎重に検討すべきだろう。
(第3位~第1位の結果はこちら)
関連コンテンツ
潰瘍性大腸炎
クローン病
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。