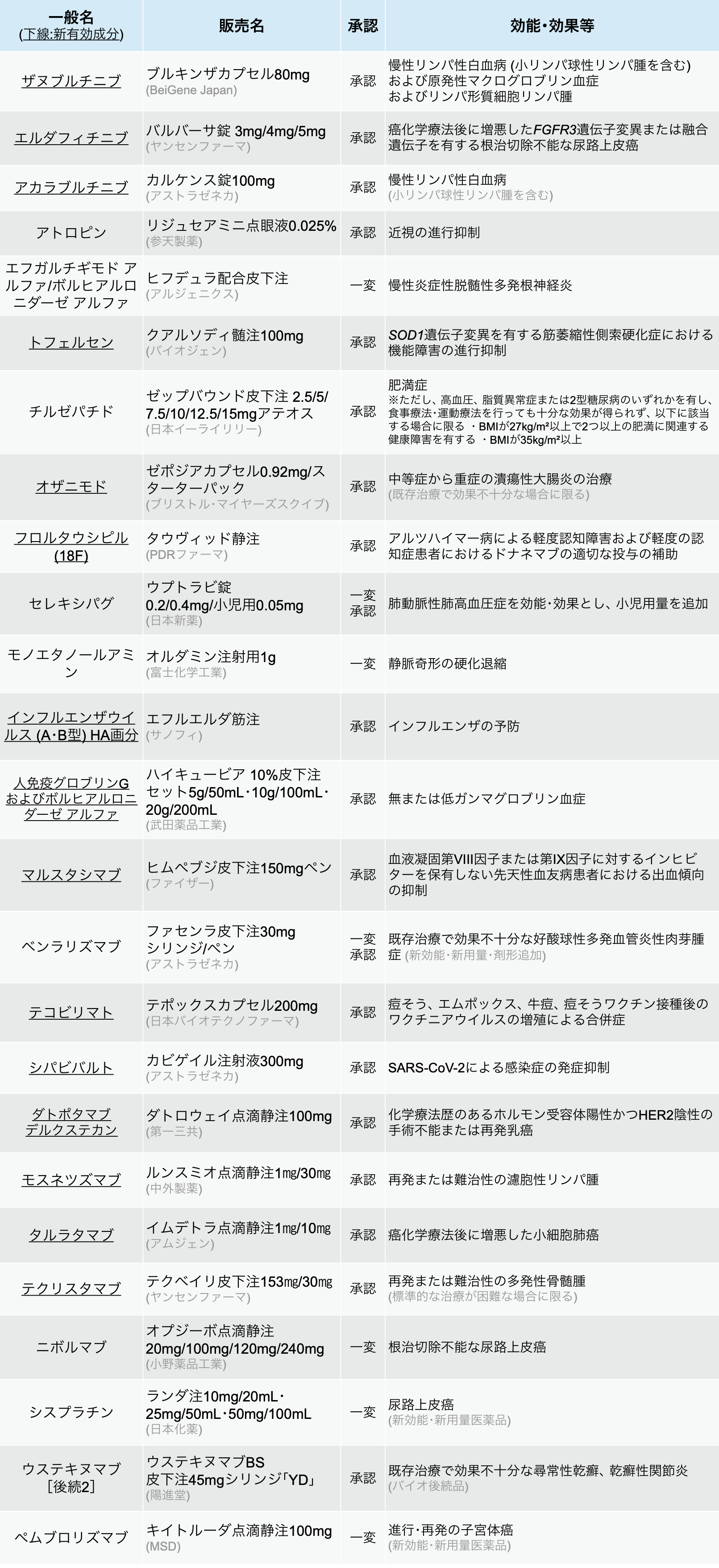
新薬承認情報
6ヶ月前
カルケンス 「CLL」 等への適応追加-24年12月の承認情報まとめ-
25剤を承認、 うち新規有効成分14剤
医薬品医療機器総合機構 (PMDA) は、 2024年12月に25種類の医薬品が厚生労働省から承認を受けたと発表した。 (うち新有効成分は14剤)
ザヌブルチニブ
ブルトン型チロシンキナーゼ (BTK) 阻害薬ザヌブルチニブ (商品名ブルキンザ) は今回、 ①未治療および再発・難治性の慢性リンパ性⽩⾎病(⼩リンパ球性リンパ腫を含む)、 ②未治療および再発・難治性の原発性マクログロブリン⾎症およびリンパ形質細胞リンパ腫ーーに対し、 国内で初めて同時承認された。
今回の承認は、 慢性リンパ性⽩⾎病/⼩リンパ球性リンパ腫を対象とした第Ⅲ相試験ALPINEおよび第Ⅲ相試験SEQUOIA、 ならびに原発性マクログロブリン⾎症/リンパ形質細胞リンパ腫を対象とした第Ⅲ相試験ASPENの結果に基づく。 また、 ⽇本⼈患者を対象とした第I/II相試験BGB-3111-1112においても、 良好な安全性プロファイルが認められた。
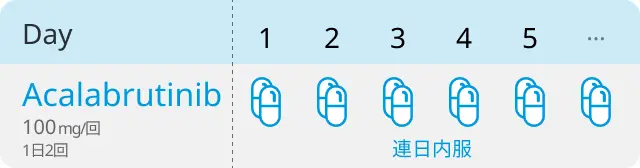
アカラブルチニブ
BTK阻害薬アカラブルチニブ (商品名カルケンス) は、 今回、 消化管のpH条件に関わらず薬物が全て溶出するように改善された溶解性プロファイルを有するフィルムコーティング錠が開発・承認された。 同薬は慢性リンパ性白血病に対する治療薬として同カプセル剤が既に承認されている。 ただしカプセル剤はpH4を超える条件下では溶解性が低いため、 添付文書において、 プロトンポンプ阻害剤 (PPI) との併用は可能な限り避けること等の注意喚起がなされており、 胃内pHを変化させる薬の投与を受けている血液腫瘍患者に対し、 カプセル剤の使用は制限されていた。
今回の承認は、 海外の健康な被験者を対象に、 新剤形となるアカラブルチニブを投与した試験の結果に基づく。 新剤形における安全性・忍容性は良好であり、 既存のカプセル剤形との安全性・忍容性プロファイルに明確な差は認められなかった。
>> 関連レジメン
(HOKUTO編集部の関連コンテンツに遷移します)
ハイキュービア
ハイキュービアは皮下注用人免疫グロブリン10%・ボルヒアルロニダーゼ アルファを組み合わせた促進型皮下注用免疫グロブリン製剤であり、 今回、 国内初かつ唯一の無または低ガンマグロブリン血症の治療薬として承認された。 人免疫グロブリンの投与前にボルヒアルロニダーゼ アルファを投与することで、 より大量の皮下投与が可能となり、 従来の皮下投与製剤の投与頻度 (1週または2週間隔) に比べ、 投与頻度が少ないことが特徴 (3週または4週間隔)。
今回の承認は、 主に有効性、 安全性、 忍容性および薬物動態を評価するために実施された、 原発性免疫不全症の日本人患者を対象とした第Ⅲ相非盲検非対照試験 (TAK-771-3004/TAK-771-3005) の結果に基づく。
マルスタシマブ
抗TFPI抗体マルスタシマブ (商品名ヒムペブジ) は、 固定用量の皮下投与製剤であり、 血液凝固第VIII因子または第IX因子に対するインヒビター非保有の血友病A、 または血友病B患者における出血傾向の抑制において、 定期投与を行うための調製が不要という特徴を有する。
今回の承認は、 成人および青年のインヒビターのない血友病A (先天性血液凝固第VIII因子欠乏) または血友病B (先天性血液凝固第IX因子欠乏) を対象とした第Ⅲ相国際共同試験BASISの結果等に基づく。
ベンラリズマブ
ベンラリズマブ (商品名ファセンラ) は現在、 米国、 欧州、 日本、 中国など、 80ヵ国以上で重症好酸球性喘息の治療薬として承認されている生物学的製剤であり、 好酸球性多発血管炎性肉芽腫症の治療薬としては国内2番目の承認となる。
今回の承認は、 再発または難治性の好酸球性多発血管炎性肉芽腫症を対象に、 ベンラリズマブとメポリズマブを直接比較した第III相試験MANDARAの結果に基づく。 主要評価項目である36週時および48週時の両時点で寛解を達成した患者割合はファセンラ投与群で約60%であり、 メポリズマブに対する非劣性が認められた。
モスネツズマブ
モスネツズマブ (商品名ルンスミオ) は、 CD20/CD3に対するT細胞誘導性二重特異性抗体。 今回、 過去に抗CD20抗体を含む、 少なくとも2つの標準治療歴がある再発または難治性の濾胞性リンパ腫に対する単剤療法が承認された。 治療効果に応じて投与期間があらかじめ約半年または1年間と定められており、 患者の負担軽減が期待されている。
今回の承認は、 国内第I相臨床試験の拡大コホートであるFLMOON-1および、 同じ患者集団を対象とした海外第I/II相試験の成績に基づく。 FLMOON-1試験において、 主要評価項目である独立評価機関評価による完全奏効割合は68.4% (90%CI 47.0-85.3%) だった。
テクリスタマブ
BCMA/CD3標的のT細胞リダイレクト二重特異性抗体テクリスタマブ (商品名テクベイリ) は、 投与前の希釈が不要、 かつ多発性骨髄腫においては日本で初めて体重に応じた投与が可能となる唯一の皮下注製剤。
今回の承認は、 海外で行われた第I/II相試験MajesTEC-1および国内で行われた第I/II相試験MMY1002の結果に基づく。 MMY1002試験における客観的奏効率 (ORR) は76.9%、 厳格な完全奏効 (sCR) 率は61.5%であった。 今回の承認により、 依然として治療選択肢が限られている治癒困難な多発性骨髄腫に対する新たな治療選択肢の提供が期待される。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。