新薬承認情報
10ヶ月前
タグリッソ 「局所進行NSCLC」 への適応追加-5月の変更承認情報まとめ-
10剤を承認 (うち新規有効成分2剤)
医薬品医療機器総合機構 (PMDA) は、 2025年5月に10種類の医薬品が厚生労働省から承認を受けたと発表した。 (新規有効成分2剤)
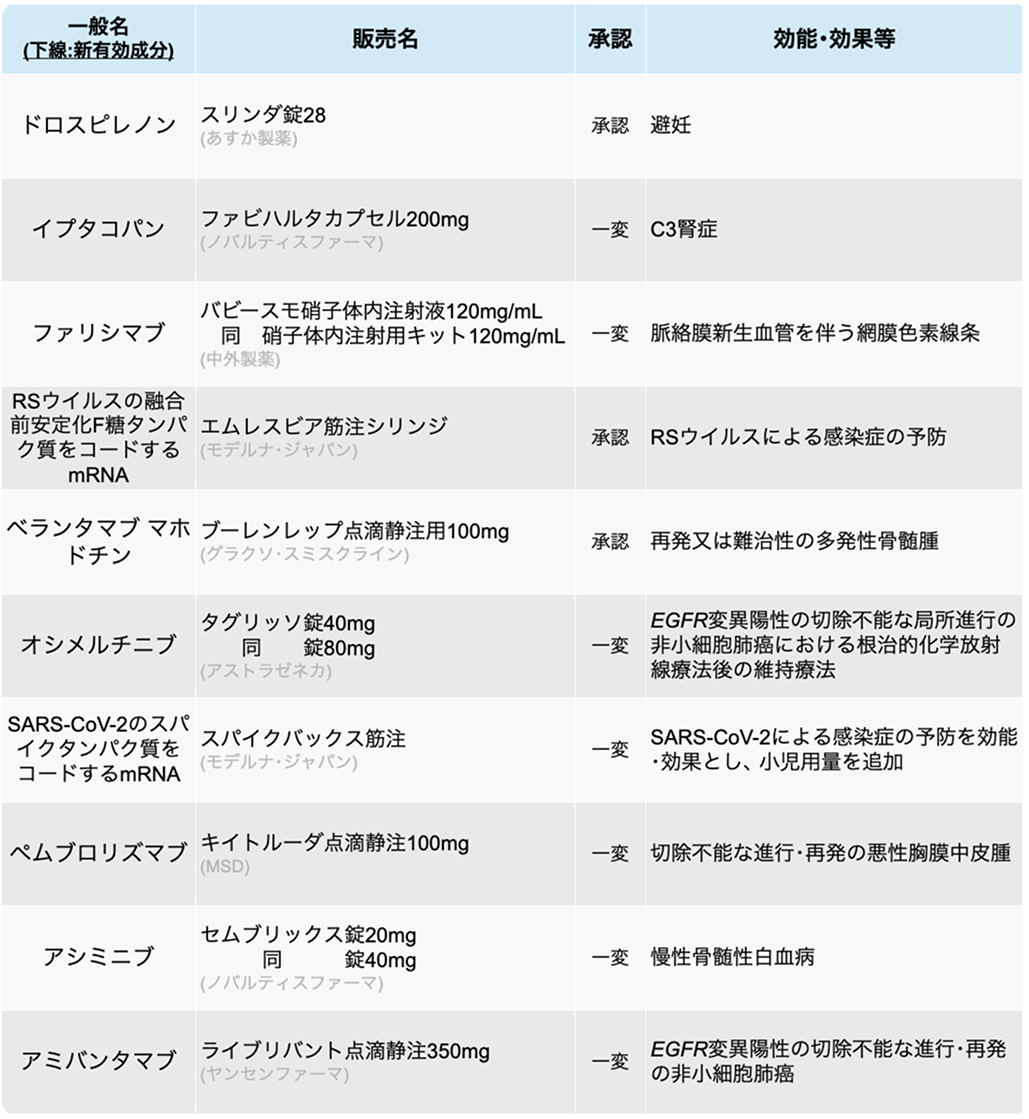
オシメルチニブ
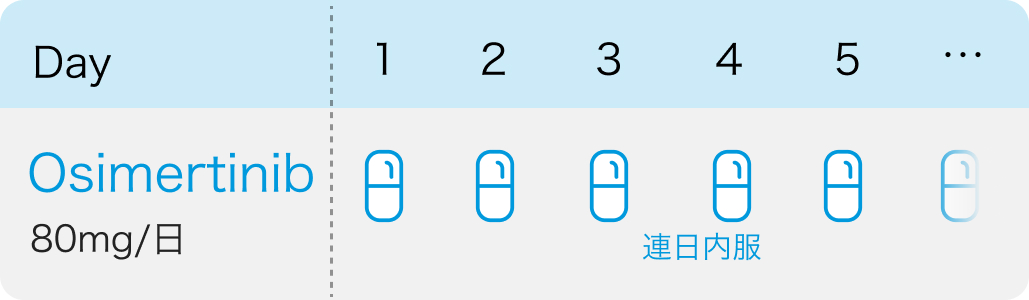
第3世代EGFR-TKIオシメルチニブ (タグリッソ®) は今回、 切除不能な局所進行非小細胞肺癌 (NSCLC) における根治的化学放射線療法後の維持療法として追加承認を取得した。
今回の承認は、 白金製剤を含む根治的化学放射線療法後に病勢進行のない、 切除不能なステージIIIのEGFR遺伝子変異陽性NSCLC患者を対象とした第III相国際共同無作為化比較試験LAURAの結果に基づく。 主要評価項目である無増悪生存期間 (PFS) の中央値は、 オシメルチニブ群では39.1ヵ月であり、 プラセボ群の5.6ヵ月と比較して病勢進行または死亡のリスクを84%低減させた (HR 0.16、 95%CI 0.10–0.24、 p<0.001)。 同試験は現在も進行中であり、 主要な副次評価項目である全生存期間 (OS) を引き続き評価する予定であるという。
アミバンタマブ
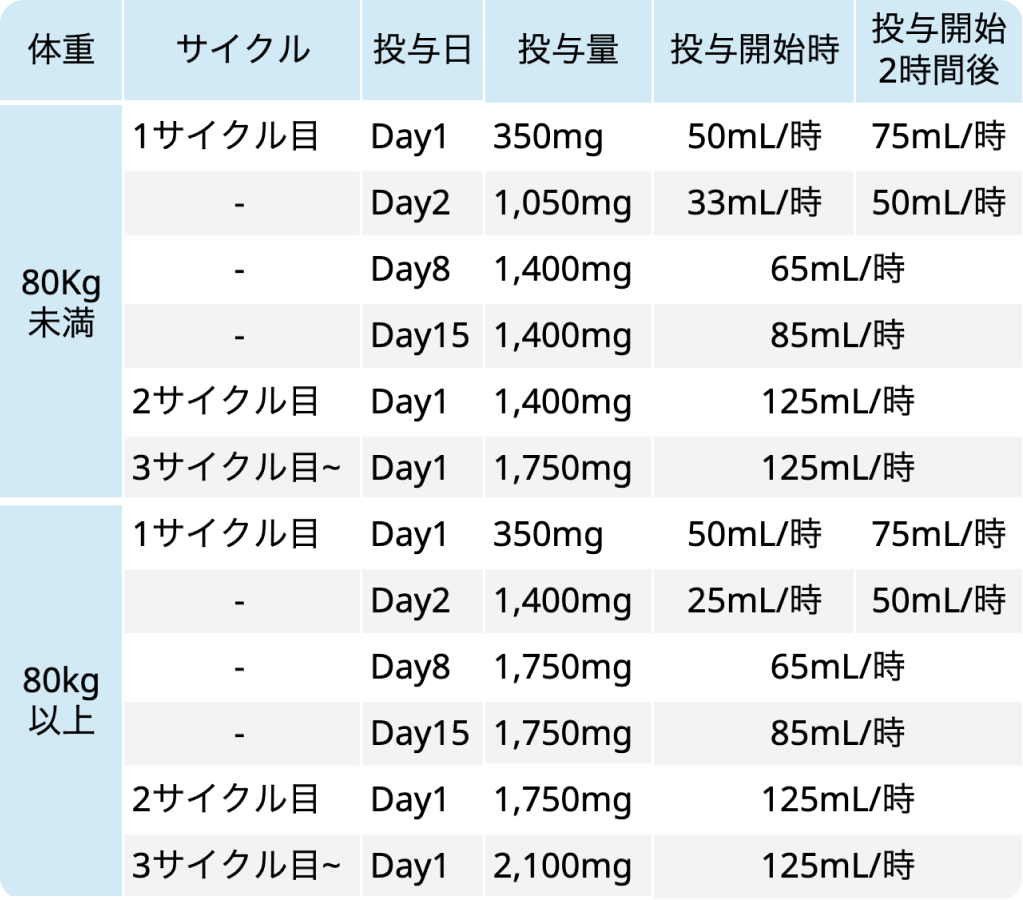
EGFR-MET二重特異性抗体アミバンタマブ (ライブリバント®) は、 オシメルチニブ治療後に病勢進行したEGFR遺伝子変異陽性NSCLCに対し、 化学療法 (カルボプラチン+ペメトレキセド) との併用で承認された。
今回の承認は、 オシメルチニブ単独投与後に病勢進行したEGFR遺伝子変異陽性の局所進行性または転移性NSCLCを対象に、 アミバンタマブ+化学療法併用レジメンの有効性および安全性を評価した第III相国際共同無作為化比較試験MARIPOSA-2の結果に基づく。 主要評価項目であるPFSは、 化学療法単独群と比較して併用療法群で病勢進行または死亡リスクが52%低減した (PFS中央値 6.3ヵ月 vs 4.2ヵ月)。 奏効率 (ORR) は併用療法群で53%、 化学療法単独群で29%だった。
ペムブロリズマブ
抗PD-1抗体ペムブロリズマブ (キイトルーダ®) は今回、 切除不能な進行・再発の悪性胸膜中皮腫に対し追加承認された。
悪性胸膜中皮腫に対する今回の承認は、 化学療法歴のない切除不能な進行・再発例を対象に、 ペムブロリズマブ+ペメトレキセド+プラチナ併用療法の有効性および安全性を評価した第Ⅱ/Ⅲ相国際共同無作為化比較試験KEYNOTE-483、 および同対象 (19例) における国内の第Ib相無作為化比較試験KEYNOTE-A17の結果に基づく。 KEYNOTE-483試験では、 ペムブロリズマブ併用療法により、 OSの有意な改善が示され、 KEYNOTE-A17試験において奏効率は73.7% (95%CI 48.8–90.9%) だった。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。