新薬承認情報
5ヶ月前
エプキンリ 「濾胞性リンパ腫」 等への適応追加-2月の承認情報まとめ-
7剤を承認、 うち新規有効成分1剤
医薬品医療機器総合機構 (PMDA) は、 2025年2月に7種類の医薬品が厚生労働省から承認を受けたと発表した。 (うち新有効成分は1剤)
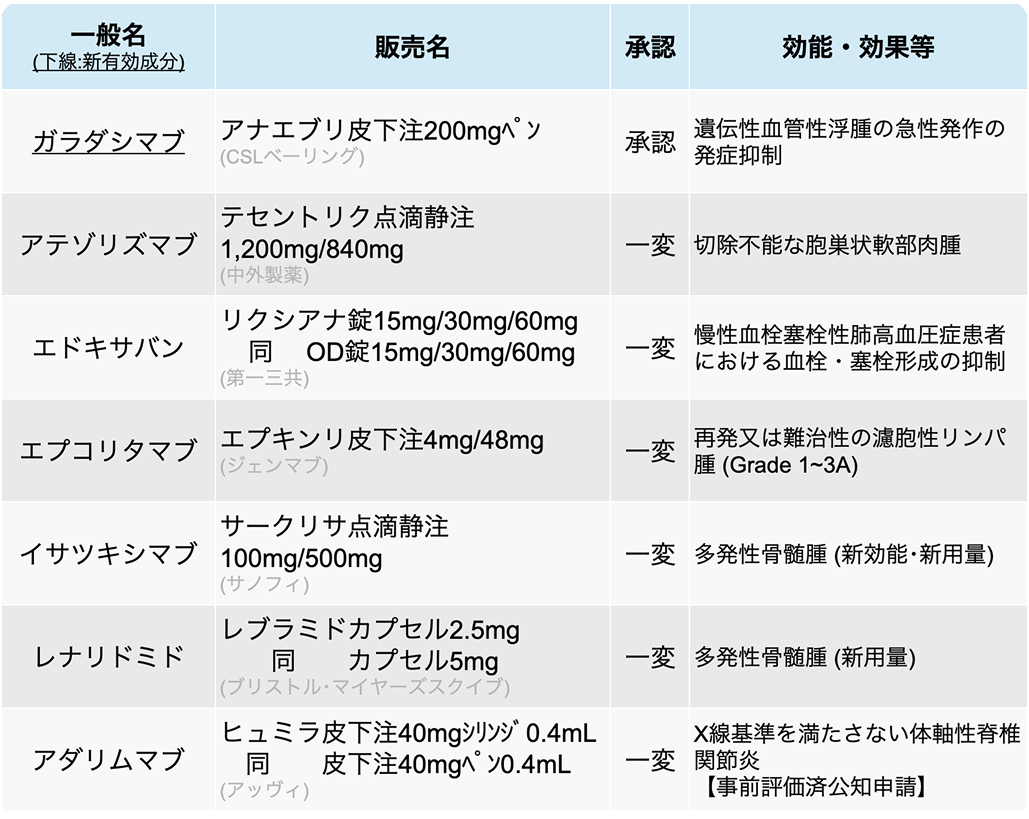
エプコリタマブ
エプコリタマブ (エプキンリ®) は、 再発または難治性の濾胞性リンパ腫 (Grade 1~3A) を効能・効果として、 新たな用法・用量が追加承認された。
今回承認された 「3ステップ漸増」 は、 通常、 成人にはエプコリタマブとして、 28日1サイクルで、 以下の順序で投与する。
1サイクル目
1日目に1回0.16mg→8日目に1回0.8mg→15日目に1回3mg→22日目に1回48mgを皮下投与
2~3サイクル目
1、 8、 15、 22日目に1回48mgを皮下投与
4~9サイクル目
1、 15日目に1回48mgを皮下投与
10サイクル目以降
1日目に1回48mgを皮下投与
イサツキシマブ
抗CD38抗体イサツキシマブ (サークリサ®) は今回、 未治療多発性骨髄腫に対するボルテゾミブ・レナリドミド・デキサメタゾン併用療法 (BLd) へ同薬を追加する新たな併用療法 (IsaBLd) として承認された。 イサツキシマブは、 これまで再発または難治性の多発性骨髄腫に適応を有していたが、 今回の承認により1次治療で処方可能となった。
今回の承認は、 自家造血幹細胞移植不適格で未治療の多発性骨髄腫446例 (うち日本人25例) を対象にした第Ⅲ相非盲検国際共同無作為化比較試験IMROZの結果に基づく。 主要評価項目である無増悪生存期間 (PFS) 中央値はIsaBLd群で未到達、 BLd群で54.34ヵ月であり、 IsaBLd群で有意に改善していた (HR 0.596、 p=0.0005)。
レナリドミド
レナリドミド (レブラミド®) は多発性骨髄腫に対する1次治療において、 イサツキシマブとの併用療法における用量が追加承認された。
ガラダシマブ
ガラダシマブ (アナエブリⓇ) は、 活性化第XII因子 (FXIIa) を特異的に阻害する抗活性化第第XII因子抗体であり、 遺伝性血管性浮腫 (HAE) の急性発作の発症抑制を適応として日本で初めて承認された。 月1回の皮下投与が可能なプレフィルドペン製剤として利便性の向上が期待される。
今回の承認は、 日本人を含むタイプIまたはタイプIIのHAEを対象とした第III相国際共同試験VANGUARDおよび非盲検延長試験の結果に基づく。 VANGUARD試験では、 ガラダシマブの投与により、 1ヵ月あたりのHAE発作回数がプラセボ群と比較して有意に低下した (0.27ヵ月 vs 2.01ヵ月、 p<0.0001)。 また、 安全性プロファイルは良好だった。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。