KIWI (炎症性腸疾患)
10ヶ月前
【KIWI】腸内細菌からIBDを 「治す」 マイクロバイオーム創薬の展望

本コンテンツでは、 「あなたの知らない腸内細菌の世界」をテーマとして2024年11月に開催された第16回KIWI (Kitasato Institute Webinars on IBD) より、 重要なエッセンスを抽出し、 まとめてご紹介します。 多くの先生の臨床の参考となれば幸いです。
KIWIとは?
KIWIは、 IBDにまつわるトピックについての教育的なコンテンツをインターネットでライブ配信するウェビナーです。 IBD専門医だけでなく看護師、 薬剤師など、 全ての医療従事者を対象に、 さまざまなレベルの内容を2ヵ月に1回、 ゲストを招き、 対談形式にレクチャーを交えてライブ配信します。

セミナー情報
【ホスト】小林 拓氏
北⾥⼤学北⾥研究所病院炎症性腸疾患先進治療センター
【ゲスト】鎌田 信彦氏*、 金 倫基氏**
*ミシガン大学医学部 消化器内科/大阪大学免疫学フロンティア研究センター
**北里大学薬学部・大学院薬学研究科 微生物学教室
腸内細菌とIBD (鎌田 信彦氏)
近年、 明らかになった腸内細菌叢の変化
炎症性腸疾患(IBD)患者では腸内細菌叢が乱れていることが以前から知られていたが、 近年、 次世代シークエンサーを用いた遺伝子レベルでの腸内細菌叢の網羅的解析技術が進歩し、 より詳細な変化を捉えることが可能になった。
その結果、 IBD患者では具体的な変化として、 ①多様性の低下 (細菌種の減少、 偏り)、 ②特定の細菌の増減、 ③細菌機能の変化 (個々の細菌およびコミュニティとしての機能の変化) などが生じていることが明らかにされた。 また、 こういった細菌叢・機能の変化は患者の病態や治療有効性・抵抗性などに相関していることも分かってきた。
では、 上記の変化はIBDの 「原因」 なのか、 あるいは 「結果」 なのかーー。 この問いに関しては、 「原因であれば、 腸内細菌叢は治療標的になる可能性がある」 と考えられる。
腸内細菌叢の乱れはIBDの原因に関与か
腸内細菌叢の乱れが 「原因」 に関与していることを示唆する注目の研究を紹介する。
❶未治療小児IBDの腸内細菌叢、 既に乱れあり
<注目論文>
① The treatment-naive microbiome in new-onset Crohn's disease. Cell Host Microbe. 2014 Mar 12;15(3):382-392.
② Compositional and Temporal Changes in the Gut Microbiome of Pediatric Ulcerative Colitis Patients Are Linked to Disease Course. Cell Host Microbe. 2018 Oct 10;24(4):600-610.e4.
<私はこう見る>
初診断・未治療の小児潰瘍性大腸炎、 および小児クローン病を対象にした研究において、 患児の腸内細菌叢の乱れが認められた。 これら研究の対象においては治療修飾や長期にわたる慢性炎症による影響は排除されていたため、 IBDの病態形成のごく初期において既に腸内細菌叢が変化していることが示唆されたといえる。
❷ IBD児とペアの健常双生児の腸内細菌叢はIBD患者と類似
<注目論文>
Healthy Cotwins Share Gut Microbiome Signatures With Their Inflammatory Bowel Disease Twins and Unrelated Patients. Gastroenterology. 2021 May;160(6):1970-1985.
<私はこう見る>
IBDの双生児と、 双生児のペアである健常者 (ハイリスク者)、 血縁関係がないIBD患者、 そして健常者の腸内細菌叢を比較したコホート研究において、 ハイリスク者の腸内細菌叢は、 IBDの双生児および無関係のIBDの腸内細菌叢と近い特徴を示していることが明らかにされた。 この結果から、 腸内細菌叢の乱れはIBD発症に先立って起こり、 病態形成に関与していることが示唆された。
CD患者の腸内細菌叢移植で腸炎が誘発
<注目論文>
Functional Characterization of Inflammatory Bowel Disease-Associated Gut Dysbiosis in Gnotobiotic Mice. Cell Mol Gastroenterol Hepatol. 2016 Mar 3;2(4):468-481.
<私はこう見る>
ヒト化マウス (ヒトの腸内細菌叢をマウスに移植して機能を再現したマウス) を用いたIBDの腸内細菌の機能研究において、 クローン病(CD)患者の腸内細菌叢をIL-10ノックアウトマウスに移植すると、 健常者の腸内細菌叢を移植した場合と比べて重篤な腸炎を誘発した。
これらの研究は、 IBD患者で認められる腸内細菌叢の乱れが病態形成 (腸炎誘導・増悪) に関与していることを示唆している。 この結果から、 乱れた腸内細菌は炎症を制御するための治療標的になりうると考えられる。
腸内細菌からIBDを 「治す」 研究
現在行われている腸内細菌を対象としたIBD病態研究は、 以下4つに大別される。
1.腸内細菌叢の変化を 「見る・知る」 臨床研究
2.疾患・病態や治療との 「相関関係」 を評価する臨床研究
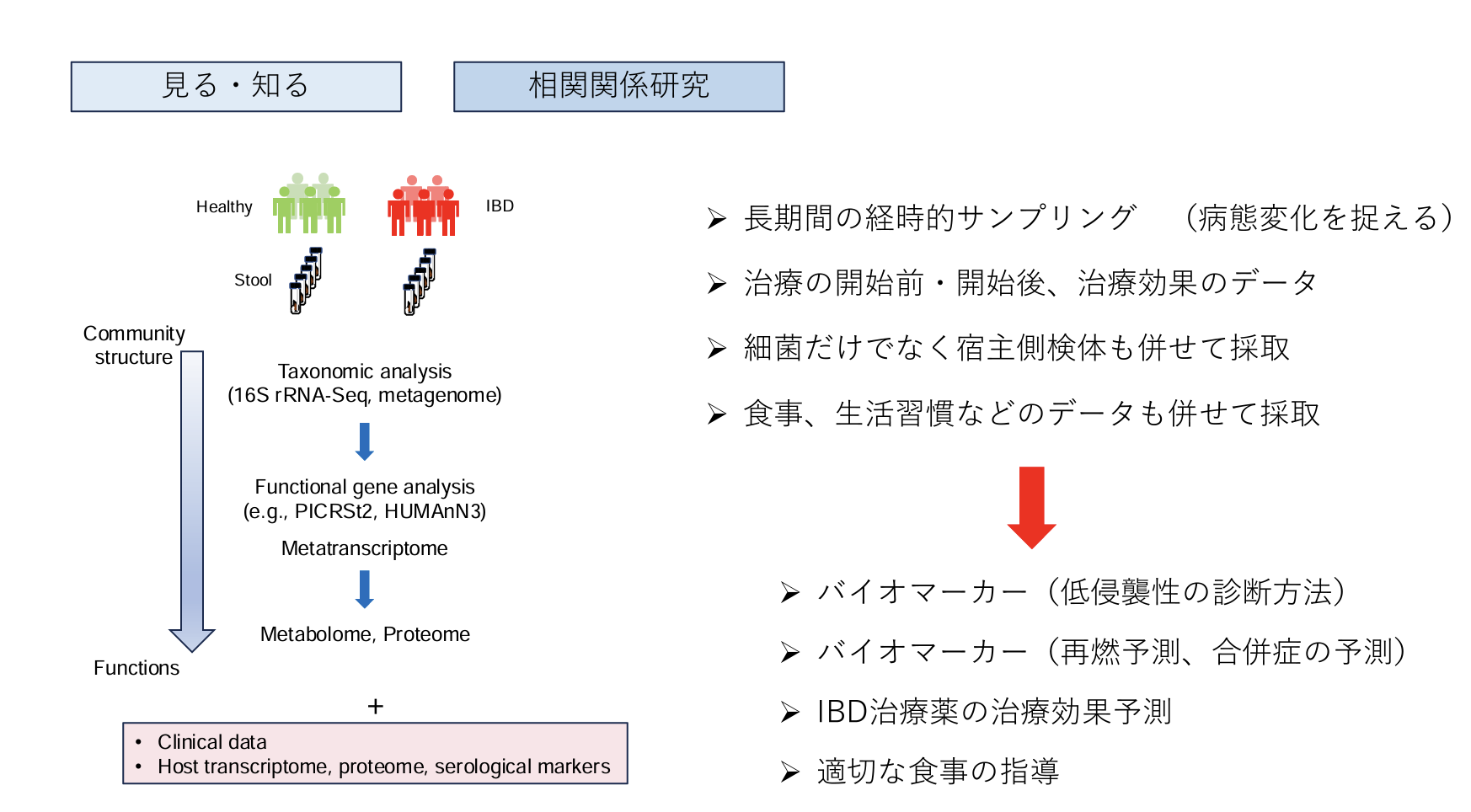
(鎌田信彦氏提供)
3.「病態形成メカニズム」 の基礎→臨床研究

(鎌田信彦氏提供)
4. 「治す」 基礎研究→臨床研究
「治す」 研究アプローチの具体的な方法
「病態形成メカニズム」 の研究には、 責任細菌の同定や疾患誘導メカニズムの解明等があり、 「治す」 研究アプローチとしては、 以下が挙げられる。
良い細菌に対するアプローチ
- 良い細菌を投与する
プロバイオティクス(単菌、 コンソーシアム)、 便微生物移植 (FMT)
- 良い細菌を増やす
プレバイオティクス (食物繊維等良い細菌の栄養源を投与)
- 良い細菌の機能を模す
良い細菌由来の代謝物、 活性物質を同定して投与
悪い細菌に対するアプローチ
- 悪い細菌を殺す
抗菌薬、 他の細菌由来の競合物質の投与
- 悪い細菌を飢えさせる
好む栄養素の除去
- 悪い細菌を追い出す
競合細菌の投与(単菌、 コンソーシアム、 FMT)
腸内細菌とIBDの将来展望 (金 倫基氏)
腸内細菌叢を健常に戻すための治療開発
現在、 IBD患者の腸内環境改善を目的として、 ①FMT、 ②生菌製剤 (LBPs) 投与、 ③ファージセラピーなどの臨床試験が行われている。
便微生物移植、 生菌製剤、 ファージセラピーのI/II相試験が進行中
便微生物移植 (FMT) では、 第Ⅰ相および第Ⅱ相試験が進行中であり、 有効性について結果が待たれる段階となっている。
またLBPs投与では、 複数の第Ⅰ相および第Ⅱ相試験が数社で進行中である。 不成功例や中断例がみられる一方で、 軽症・中等症の潰瘍性大腸炎(UC)を対象とした腸内細菌カクテル製剤MH002 (ベルギー・MRM health社) の第Ⅱa相試験が良好な結果を得ている。
このほか、 CD患者における接着性侵入性大腸菌 (AIEC) を標的としたファージセラピー(米・Intralytix社)においては、 第Ⅰ/Ⅱ試験が進行中である。
マイクロバイオーム創薬における着眼点 「リダクショニズム」 と 「ホーリズム」
現在、 健常人と比べてIBD患者で減少・欠損、 あるいは増加している腸内細菌に焦点を当てたマイクロバイオーム創薬 (LBPsやファージカクテルの開発) が主に進められているが、 マイクロバイオーム創薬における考え方としては、 大きく 「リダクショニズム」 と 「ホーリズム」 の2種類があり、 それぞれ特徴が異なる。
全体を部分に還元して観察しようとするリダクショニズムでは、 基礎研究等で作用機序が明らかになれば、 創薬にも応用しやすい。 しかし、 特定の腸内細菌株からなるLBPsなどは、 昨日が限定的である、 腸内環境によって機能性が変化する、 投与しても菌の定着がうまくいかないなどの問題が挙げられる。 今後、 これらの問題を解決する知見が得られれば、 非常に有効な薬剤となる可能性が期待できる。
一方、 全体から観察しようとするホーリズムでは、 腸内細菌叢をコミュニティとして考えるため、 リダクショニズムに比べてダイナミックな創薬が検討できる。 FMTが一つの例である。 ただし、 作用機序を明確にしにくく、 科学的にどのように切り込んでいくかが課題となる。
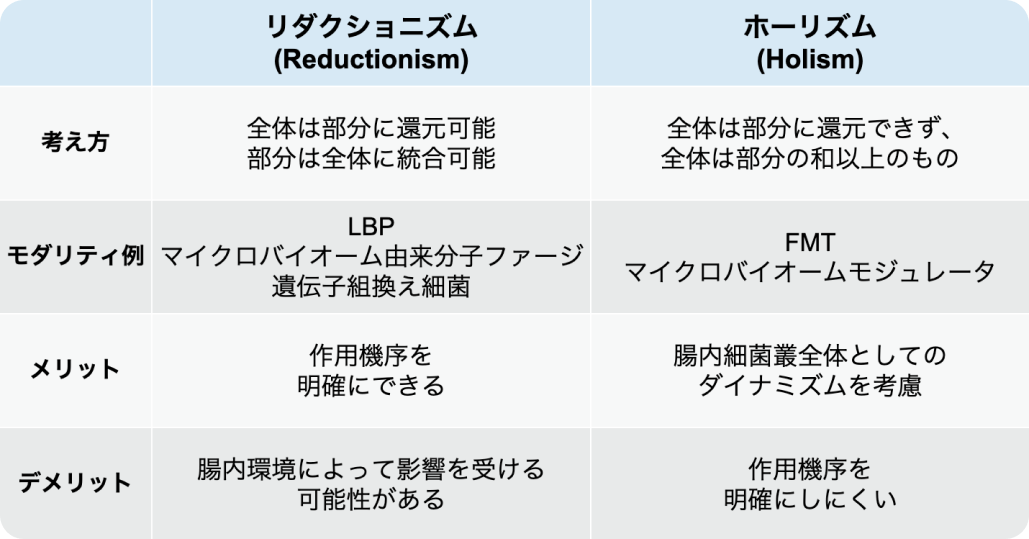
(金倫基氏講演資料を基に編集部作成)
リダクショニズムとホーリズム、 どちらの考え方によるアプローチがより有効かは、 今後、 明らかになると考えられるが、 それぞれにメリットとデメリットがあり、 双方の考え方を持つ必要がある。 現在、 リダクショニズム的な開発が盛んに行われているが、 金氏は「成功例に乏しく、 ホーリズムの考え方を含めた新たなパラダイムシフトも検討する必要があるのではないか」と指摘した。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。