HOKUTO編集部
8ヶ月前
【MM編】造血器腫瘍診療ガイドライン2024年版 改訂ポイント

2024年12月、 日本血液学会による『造血器腫瘍診療ガイドライン第3.1版 (2024年版)』が公開された。 今回は、 同ガイドラインのうち多発性骨髄腫 (MM) の節に関して、 旧版である第3版 (2023年版) からの改訂の主なポイントを紹介する。

日本血液学会の公式サイトに遷移します
MM編 主な5つの改訂点
❶ ダラツムマブ皮下注に関する試験結果の反映
❷ 2023年承認のエルラナタマブ関連の追記
❸ パノビノスタットの発売中止に関連した追記
❹ 2024年承認のテクリスタマブ関連の追記
❺ ide-celの適応拡大とその根拠を追記
❶ 未治療で移植適応 : ダラツムマブ皮下注に関する試験結果の反映
「未治療で移植適応のある多発性骨髄腫」 の CQ1「移植適応の未治療多発性骨髄腫に対する寛解導入療法としてどのような治療が勧められるか」 において、 Answerに変わりはなく、 ボルテゾミブ (BOR) やレナリドミド (LEN) を含むレジメンが推奨されている。
解説において、 2023年版ではBLd (BOR、 LEN、 低用量デキソメタゾン) とBLdにダラツムマブの点滴静注製剤 (商品名 ダラザレックス®点滴静注) を上乗せしたARA-BLdを比較した第Ⅱ相GRIFFIN試験の結果が示されていたが、 2024年版では皮下注製剤 (商品名 ダラキューロ®配合皮下注) を上乗せした第Ⅲ相PERSEUS試験の結果が代わりに記載された。
HOKUTO関連コンテンツ
PERSEUS : 移植適応のある新規多発性骨髄腫へのダラツムマブでPFS改善
該当する臨床試験はこちら
N Engl J Med. 2024 Jan 25;390(4):301-313.
❷ 再発・難治性 : 2023年承認のエルラナタマブ関連の追記
二重特異性抗体エルラナタマブ (商品名 エルレフィオ®) が2024年3月に承認された。
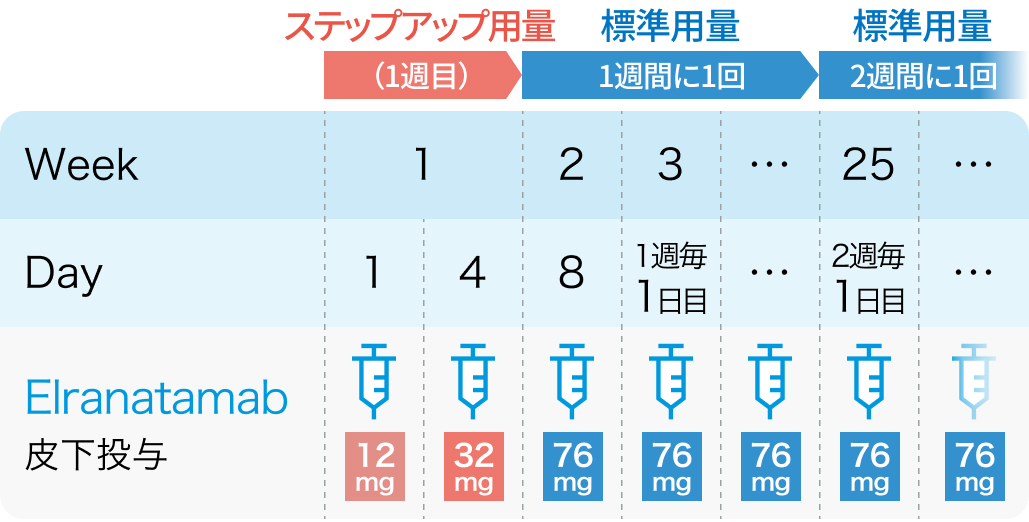
関連して、 2024年版では、 アルゴリズムの再発・難治性骨髄腫の欄に以下が追記された。
「3クラスの薬剤を含む少なくとも3つの標準的な治療が無効または治療後に再発した多発性骨髄腫において、 BCMAを標的とした治療歴のない患者に対するエルラナタマブ療法は、 有効で忍容性の高い治療として推奨される (推奨グレード : カテゴリー2A) 」
また根拠として、 第Ⅰ相試験MagnetisMM-1、 第Ⅱ相試験MagnetisMM-3、 MagnetisMM-3と実臨床における米国の治療成績 (COTAおよびFlatiron Healthデータベース) の比較検討の結果が併記された。
第Ⅰ相試験MagnetisMM-1
再発・難治性多発性骨髄腫88例が登録され、 55例がエルラナタマブの有効用量 (≧215 µg/kg) で治療された。
用量制限毒性は観察されず、 有害事象として血球減少やサイトカイン放出症候群が認められた。 観察期間中央値12ヵ月の時点において、 奏効率は63.6% (うち完全奏効以上38.2%) であった。
第Ⅱ相試験MagnetisMM-3
3クラス薬剤抵抗性の再発・難治性多発性骨髄腫患者が対象とされた。 B-cell maturation antigen (BCMA) を標的とした治療歴のない患者はコホートA (123例)、 BCMAを標的とした治療歴のある患者はコホートB (64例) として評価された。
コホートAにおける奏効率は61.0% (うち完全奏効以上35.0%)、 15ヵ月における無増悪生存率と全生存率は、 それぞれ50.9%と56.7%であった。 主な有害事象は、 感染症 69.9% (Grade 3以上39.8%)、 貧血48.8% (Grade 3以上37.4%)、 好中球減少症48.8% (Grade 3以上 48.8%) であった。 サイトカイン放出症候群は57.7%に発現したが、 Grade 3以上は認めなかった。
MagnetisMM-3と実臨床における米国の治療成績の比較検討
MagnetisMM-3のコホートAにおける結果と実臨床における米国の治療成績 (COTAおよびFlatiron Healthデータベース) が比較検討された。
コホートAの結果は奏効率 (RR 1.88-2.25)、 無増悪生存率 (HR 0.37-0.57)、 全生存率 (HR 0.46-0.66) において有意に優れていた。
該当する臨床試験はこちら
Nat Med. 2023 Oct;29(10):2570-2576.
Nat Med. 2023 Sep;29(9):2259-2267.
MagnetisMM-3と実臨床における米国の治療成績の比較検討
Future Oncol. 2024;20(17):1175-1189.
❸ 再発・難治性 : パノビノスタットの発売中止に関連した追記
「再発・難治性骨髄腫」 のCQ6 「抗CD38抗体に抵抗性の再発・難治性多発性骨髄腫に対してどのような治療が勧められるか」 において、 Answerの 「ポマリドミド、 カルフィルゾミブ、 またはパノビノスタット+ボルテゾミブを含む併用療法は無増悪生存期間の延長効果が期待できるため推奨される」 は2023年版から変更はない。
2024年版では 「パノビノスタット (商品名 ファリーダック®) は2023年3月に発売中止となった」 旨が追記された。
❹ 再発・難治性 : 2024年承認のテクリスタマブ関連の追記
二重特異性抗体テクリスタマブ (商品名 テクベイリ®皮下注) が2024年12月に承認された。
関連して、上記CQ6のAnswerにおいて、 2023年版の「B細胞成熟抗原に対するCAR-T細胞療法、 二重特異性抗体や抗体薬物複合体などの高い効果が示されており、 わが国で承認されれば推奨される」 の後半部分が、 2024年版では 「~二重特異性抗体は高い効果が示されており推奨される。 抗体薬物複合体についても、 わが国で承認されれば推奨される」 に変更された。
❺ 再発・難治性 : ide-celの適応拡大とその根拠を追記
「再発・難治性骨髄腫」 のCQ7 「再発・難治性多発性骨髄腫に対するCAR-T細胞療法の適応基準は何か、 どのような効果が期待されるか」 の解説において、 免疫調節薬、 プロテアソーム阻害薬および抗CD38抗体を含む2~4レジメンの前治療歴を有する症例を対象として、 CAR-T細胞製剤イデカブタゲン ビクルユーセル (ide-cel、 商品名 アベクマ®) と標準治療を比較した第Ⅲ相試験KarMMa-3における以下の内容が追記された。
- 観察期間中央値18.6ヵ月の時点において、 無増悪生存期間 (PFS) の中央値はide-cel群13.3ヵ月であり、 標準治療群 (4.4ヵ月) に比べ有意に延長することが示された
- 本試験の結果に基づきide-celの適応について、 免疫調節薬、 プロテアソーム阻害薬および抗CD38抗体を含む3レジメン以上の前治療歴を有する症例であったのが、 2レジメン以上に拡大した
上記の適応拡大はアルゴリズムにも反映された。
該当する臨床試験はこちら
N Engl J Med. 2023 Mar 16;388(11):1002-1014.
💬 藤野先生コメント
今回の改訂は、 主に二重特異性抗体 (エルラナタマブ、 テクリスタマブ) とCAR-T療法 (ide-cel) に関するものである。
二重特異性抗体について
エルラナタマブはすでに広く使用されていると考えられるが、 既存の化学療法と明らかに異なる治療効果を示し、 PENTA-REFRACTORY MM (ペンタリフラクトリー多発性骨髄腫) においてもsCR (厳密な完全奏効) を達成するような有効症例を経験している。
現時点において、 エルラナタマブとテクリスタマブの直接比較試験の結果は報告されておらず、 いずれを用いるべきか検討する際の明確な根拠はない。
CAR-T療法について
CAR-T療法も有効な治療法であり、 現時点においてide-celが使用可能である。 ただし、 いまだに使用可能な施設は限られており、 投与まで時間を要することから、 off-the-shelf製剤である二重特異性抗体がより多く使われていくであろうことは想像に難くない。
二重特異性抗体 vs CAR-T療法
二重特異性抗体とCAR-T療法のいずれを先に使用すべきかについては、 さらなる根拠が望まれるところである。
新規治療薬は医療費圧迫の問題がある。 特に、 二重特異性抗体は2製剤ともに病勢進行まで投与することになるため、 固定用量の製剤選択肢も望まれるところである。 治療期間によっては、 二重特異性抗体>CAR-T療法となることもあり得ると考える。
関連コンテンツ
添付文書
抗悪性腫瘍薬 > 抗CD38モノクローナル抗体
抗悪性腫瘍薬 > 抗CD38モノクローナル抗体
抗悪性腫瘍薬 > 二重特異性T細胞誘導抗体
抗BCMAキメラ抗原受容体 (CAR) 発現生T細胞
HOKUTO掲載レジメン
エルラナタマブ (エルレフィオ®)
Ide-cel (Idecabtagene vicleucel)
イデカブタゲン ビクルユーセル (アベクマ®)
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。