新薬承認情報
12ヶ月前
アレセンサ 「ALK融合遺伝子陽性非小細胞肺癌」 等への適応追加-8月の変更承認情報まとめ-
8剤を一部変更承認
医薬品医療機器総合機構 (PMDA) は、 2024年8月28日に7種類8製品の医薬品が厚生労働省から承認を受けたと発表した (すべて一部変更承認)。
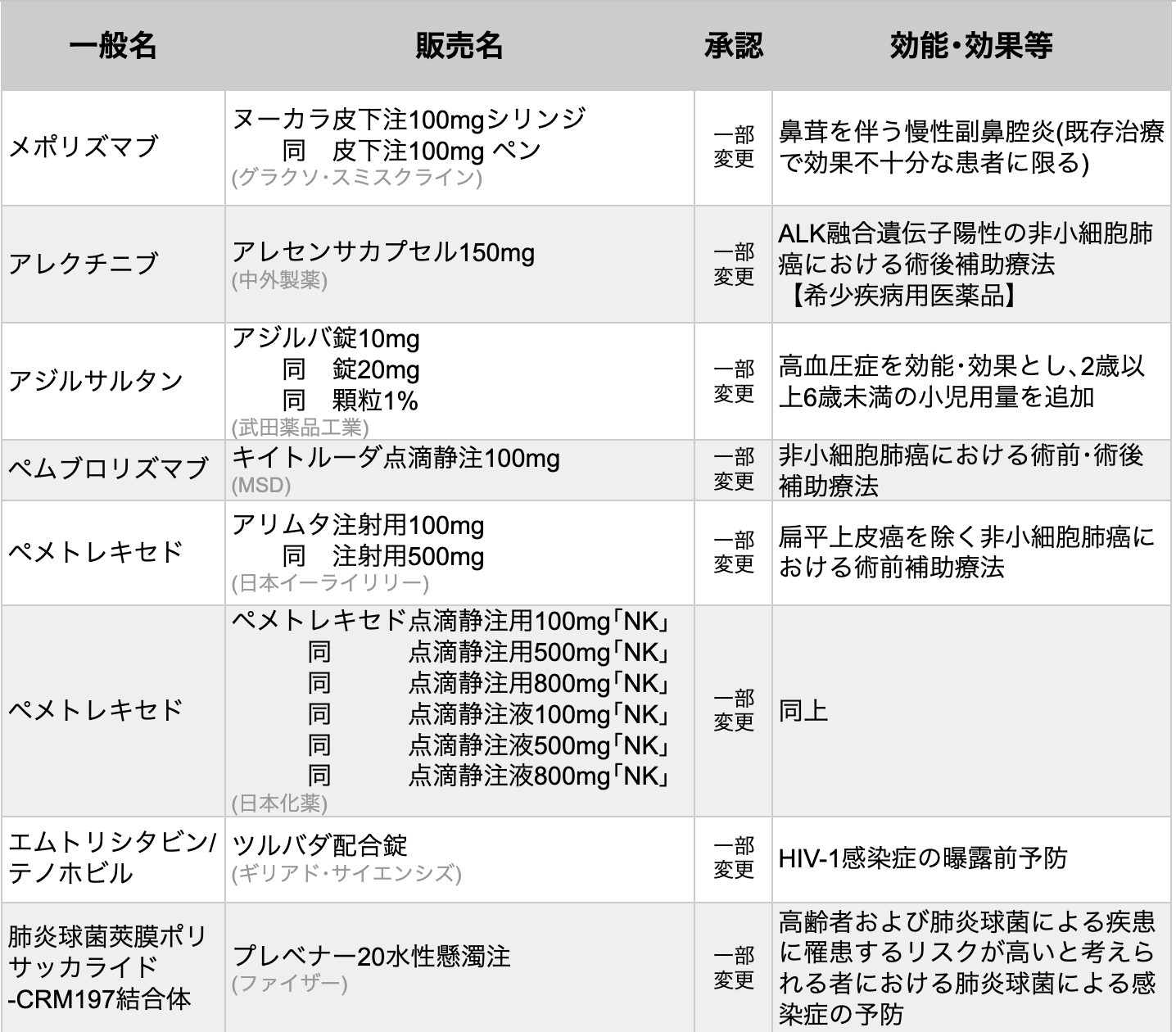
アレクチニブ
アレクチニブ (商品名アレセンサ) は、 2023年12月に承認申請を行い、 同月に希少疾病用医薬品の指定を受け優先審査の対象となっていた抗悪性腫瘍薬/ALK阻害薬である。
今回の承認は、 Stage IB (腫瘍径≧4cm) ~IIIA期で完全切除後のALK融合遺伝子陽性早期非小細胞肺癌 (NSCLC) を対象に実施された第III相試験ALINAの成績に基づく。 同試験において、 アレクチニブはプラチナ製剤ベースの化学療法と比較して、 再発または死亡リスクを76%低下させた (HR 0.24、 95%CI 0.13-0.43、 p<0.0001)。 同薬の承認により、 術後に約半数の患者が再発を経験する早期NSCLCにおいて、 術後再発リスクの低下および長期生存が期待される。
ペムブロリズマブ
抗PD-1抗体ペムブロリズマブ (商品名キイトルーダ) は、 NSCLCにおける術前・術後療法を効能または効果として適応拡大承認された。
今回の承認は、 cStageII期、 IIIA期またはIIIB期の周術期NSCLC797例 (うち日本人82例) を対象にした第Ⅲ相国際共同無作為化比較試験KEYNOTE-671の結果に基づく。 同試験において、 ペムブロリズマブ+化学療法併用による術前療法および切除後ペムブロリズマブ単剤での術後療法は、 プラセボと比較して、 全生存期間 (OS) および無イベント生存期間 (EFS) を有意に延長した (OSのHR 0.72 [95%CI 0.56-0.93]、 p=0.00517、 EFSのHR 0.58 [95%CI 0.46-0.72]、 p<0.00001)。
ペメトレキセド
代謝拮抗性抗悪性腫瘍薬ペメトレキセド (商品名アリムタ他) は、 扁平上皮癌を除くNSCLCにおける術前療法の効能または効果において、適応拡大承認された。
今回の追加承認により、 用法および用量は以下の通り改訂されている。
「他の抗悪性腫瘍剤との併用において、 通常、 成人にはペメトレキセドとして、 1日1回500mg/m² (体表面積) を10分間かけて点滴静注し、 少なくとも20日間休薬する。 これを1コースとし、 最大4コース投与を繰り返す。 なお、 患者の状態により適宜減量する。 」
🔗薬剤情報
沈降20価肺炎球菌結合型ワクチン
沈降20価肺炎球菌結合型ワクチン (無毒性変異ジフテリア毒素結合体) (商品名プレベナー20) は、 従来の沈降13価肺炎球菌結合型ワクチン (商品名プレベナー13) に7つの血清型を加えた不活性化ワクチンである。 今回の承認により、 さらに広範な血清型による肺炎球菌感染症の予防効果が期待される。
沈降20価肺炎球菌結合型ワクチンは3月26日に 「小児における肺炎球菌*による侵襲性感染症の予防」 を適応として、 既に承認されている。 なお、 沈降13価肺炎球菌結合型ワクチンは9月30日をもって販売終了となる予定である。
*血清型1、 3、 4、 5、 6A、 6B、 7F、 8、 9V、 10A、 11A、 12F、 14、 15B、 18C、 19A、 19F、 22F、 23Fおよび33F
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。