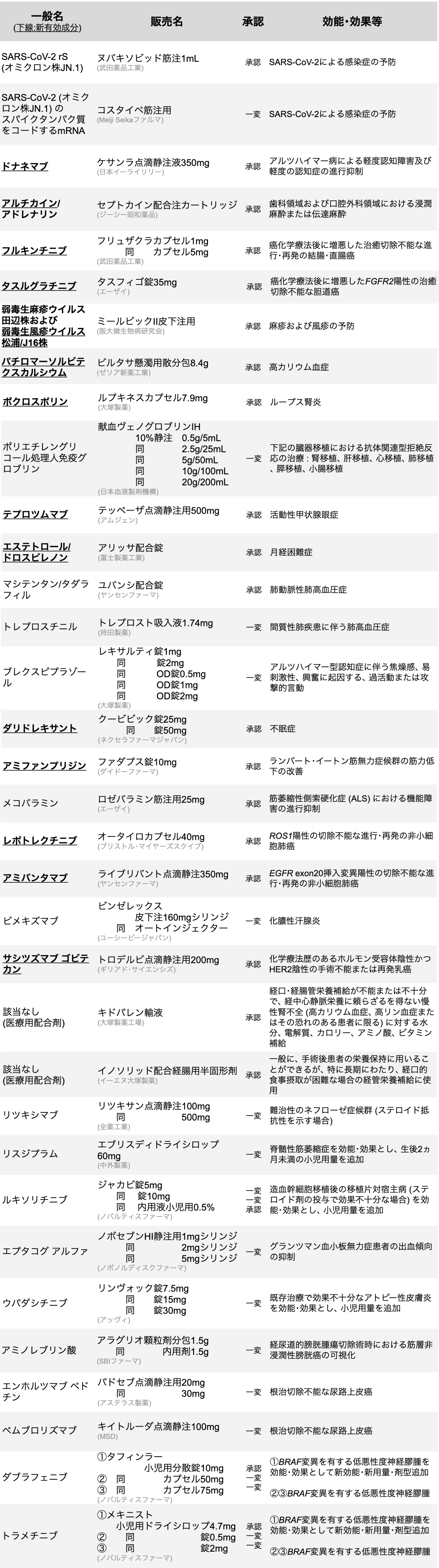
新薬承認情報
11ヶ月前
リンヴォック 「アトピー性皮膚炎」 等が適応追加へ-9月の承認情報まとめ-
34剤を承認、 うち新規有効成分は14剤
医薬品医療機器総合機構 (PMDA) は、 2024年9月に34種類の医薬品が厚生労働省から承認を受けたと発表した。 (うち新規有効成分14剤)
ビメキズマブ
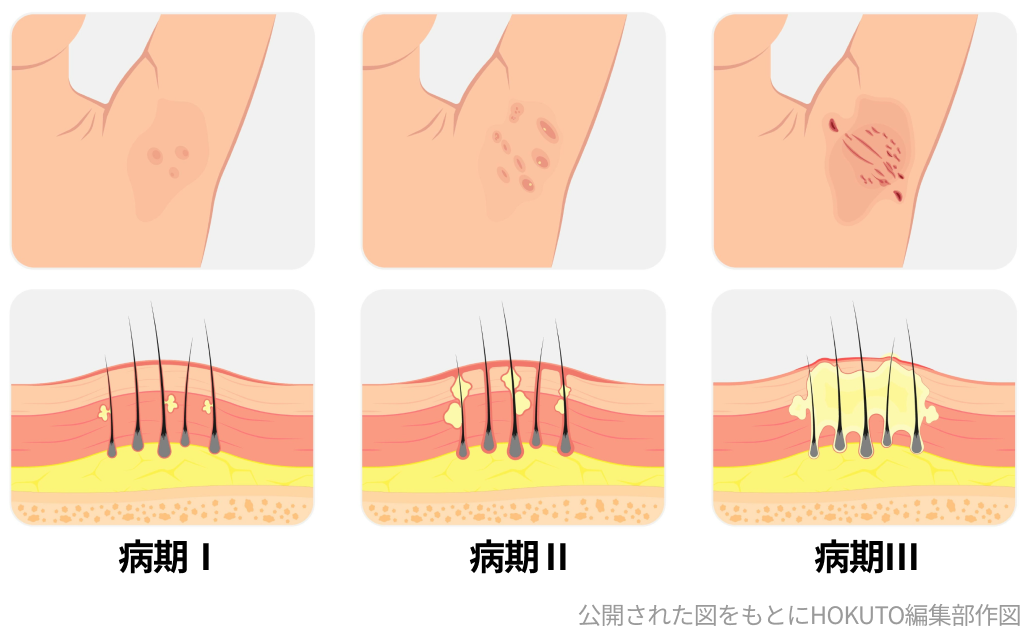
抗IL-17A/IL-F抗体ビメキズマブ (商品名ビンゼレックス®️) は、 化膿性汗腺炎に対し一部変更承認された。 今回の承認は、 中等症~重症の化膿性汗腺炎を対象に、 ビメキズマブの有効性と安全性を評価した第Ⅲ相二重盲検プラセボ対照多施設共同並行群間無作為化比較試験BE HEARD I、 および日本も参加した第Ⅲ相BE HEARD II 試験のデータに基づく。
同薬は、 既存治療で効果不十分な尋常性乾癬、 膿疱性乾癬、 乾癬性紅皮症、 乾癬性関節炎、 強直性脊椎炎、 X線基準を満たさない体軸性脊椎関節炎に対しても既に承認されており、 今回の承認により適応症は7疾患となる。
ウパダシチニブ
JAK阻害薬ウパダシチニブ (商品名リンヴォック®️) は、 既存治療で効果不十分な12歳以上のアトピー性皮膚炎に対し、 用法および用量が一部変更承認された。 今回の承認により、 12歳以上かつ体重30kg以上の小児アトピー性皮膚炎患者に対し、 患者の状態に応じてウパダシチニブ30mgの1日1回経口投与が可能となる。
今回の承認は、 日本人で中等症~重症の成人・青少年アトピー性皮膚炎を対象とした第III相二重盲検無作為化比較試験M17-377 (Rising Up) のほか、 2件の第Ⅲ相国際共同二重盲検無作為化比較試験 (M16-045、 M16-047) の結果に基づく。
関連コンテンツ
アトピー性皮膚炎評価指標
アトピー性皮膚炎コントロールツール
アトピー性皮膚炎の重症度分類
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。