新薬承認情報
1年前
【新発売】タスルグラチニブ (タスフィゴ®)~FGFR2陽性胆道癌に対して~

FGFR阻害薬タスルグラチニブが 「癌化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道癌」 に対して2024年9月に承認、 11月20日に薬価収載されました。 本稿では、 HOKUTOレジメンからその概要を紹介します。
薬剤情報
*エーザイ株式会社の外部サイトへ遷移します
効能または効果
癌化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道癌
薬価
35mg1錠 1万5,378円
用法用量
【1コース】連日投与
【催吐性】 報告なし
【FN発症】報告なし
タスフィゴ®添付文書¹⁾、 E7090-J000-201試験³⁾
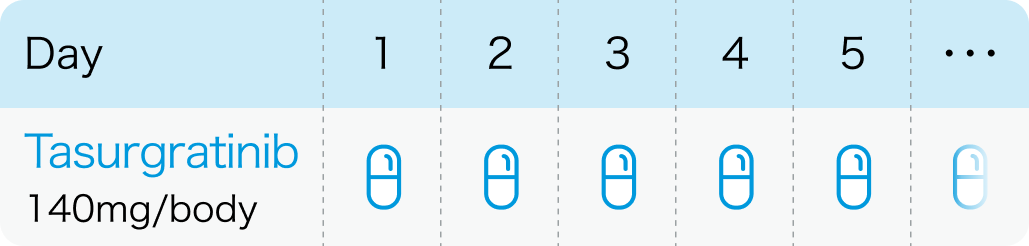
通常、 成人には、 タスルグラチニブとして1日1回140mgを空腹時に経口投与する。 なお、 患者の状態により適宜減量する。
タスフィゴ®添付文書 (2024年9月作成第1版)¹⁾より引用
各プロトコル
減量目安
- 1段階減量 105mg
- 2段階減量 70mg
- 3段階減量 35mg
- 4段階減量 投与中止
タスフィゴ®添付文書 (2024年9月作成第1版)¹⁾より引用
減量・休薬・中止基準
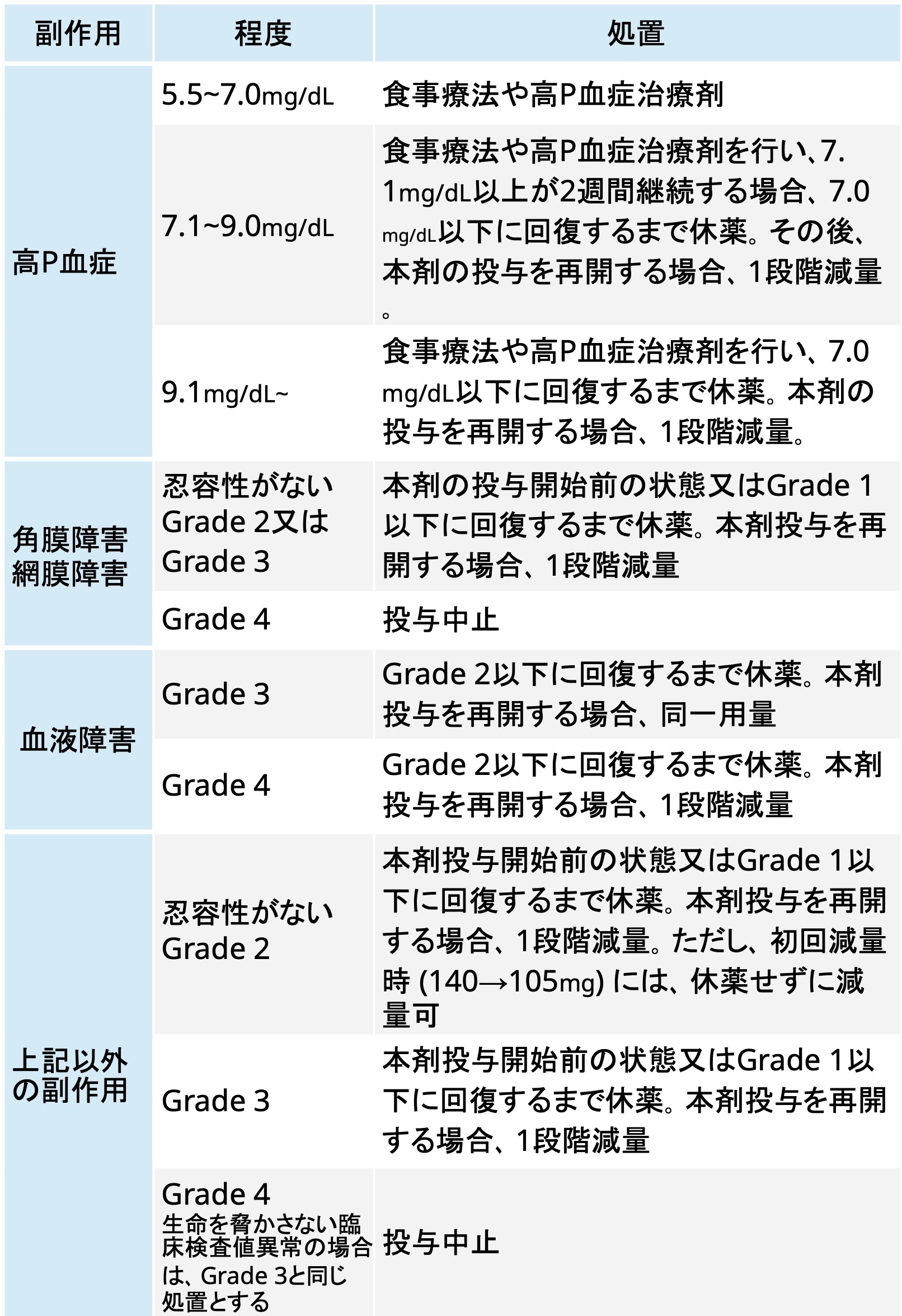
タスフィゴ®添付文書 (2024年9月作成第1版)¹⁾より引用
使用上の注意点
コンパニオン診断薬について
2024年8月26日、 タスルグラチニブのコンパニオン診断として、 「AmoyDx® FGFR2 Break-apart FISHプローブキット」が国内承認された。
最新情報については各社の発表やPMDAの情報を参照下さい
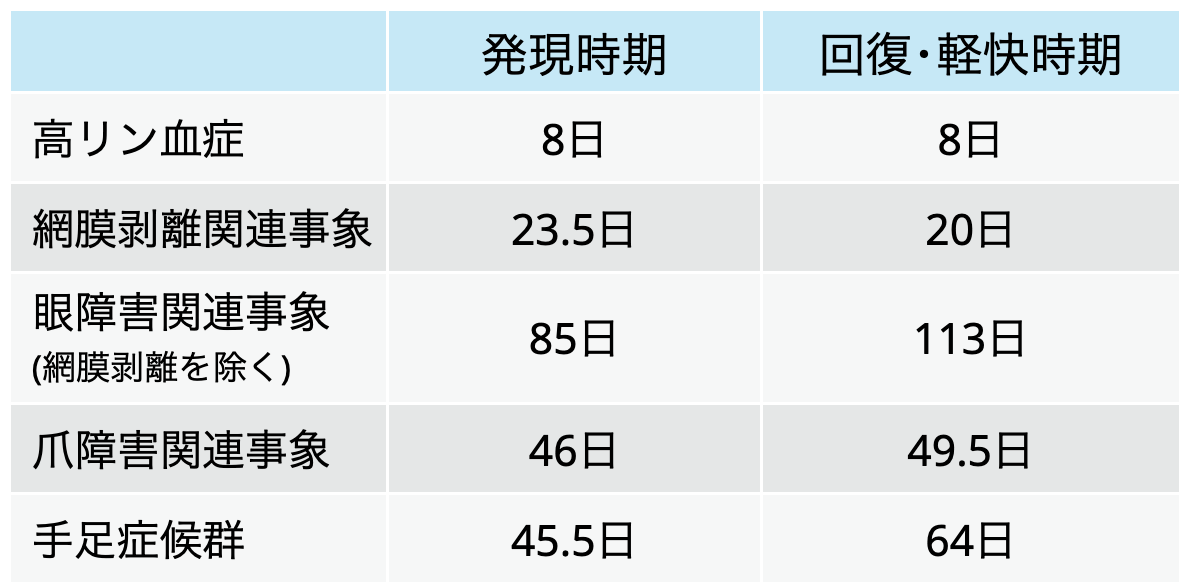
特徴的な有害事象の発現時期と回復時期
臨床試験 (国際共同第2相試験 E7090-J000-201)³⁾ に基づく有害事象データ (中央値)
眼障害のモニタリング
臨床試験 (国際共同第2相試験 E7090-J000-201)³⁾では、 スクリーニング期、 サイクル1 Day15、 サイクル2 Day1、 以後8週ごと (偶数サイクルのDay1) に眼科検査を実施。
網膜障害の臨床症状
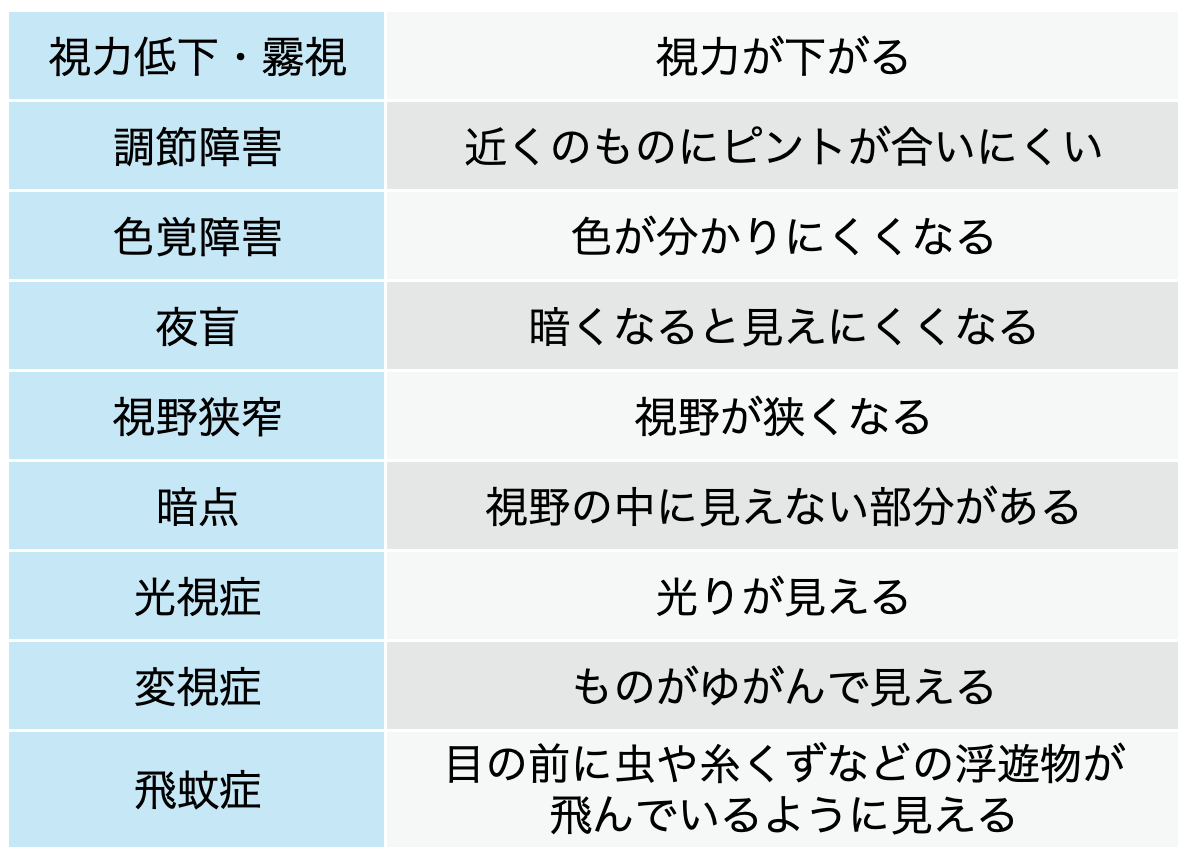
角膜炎、 ドライアイ、 角膜上皮欠損、 眼球乾燥症、 霧視等にも注意が必要
出典
1) エーザイ株式会社. タスフィゴ®錠35mg添付文書 (2024年9月作成第1版) [最終確認: 2024/11/26]
2) エーザイ株式会社. タスフィゴ®錠35mg適正使用ガイド (2024年9月作成) [最終確認: 2024/11/26]
3) Pivotal single-arm, phase 2 trial of tasurgratinib for patients with fibroblast growth factor receptor (FGFR)-2 gene fusion-positive cholangiocarcinoma (CCA). Journal of Clinical Oncology
関連コンテンツ
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。